
ЦБП
.pdf
|
|
|
|
|
|
|
C |
C |
C |
|
|
|
|
|
|
|
|||
C |
|
C |
|
|
|
||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
C |
C |
C |
||
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
2 |
|||||
|
|
|
|
||||||
В свою очередь циклические соединения делят на карбоциклические – они образованы только атомами углерода и гетероциклические – в их цикле помимо атомов углерода содержатся атомы других элементов (гетероатомы: азот, кислород, сера и др.).
Углеродный скелет может включать одинарные σ-связи, а также π-связи.
Химические свойства органических соединений характеризуются наличием функциональных групп, например гидроксильной группы −ОН, остатка аммиака (лишенного одного атома водорода) −NH2, остатка азотной кислоты −NO2, остатка серной кислоты −SО3Н. Присутствие той или иной функциональной группы определяет принадлежность соединения к определенному классу. Основные функциональные группы даны в таблице 1.4.
Таблица 1.4 − Основные функциональные группы и классы соединений
Класс Функциональная группа Общая Типичный представитель формула название формула
Галогенопроизводные |
|
−F, −Сl, |
|
Галогены |
|
R−Hal |
|
СН3−Сl |
|
хлорметан |
Спирты |
|
−Вr, −I |
|
Гидроксил |
|
|
|
С2Н5−ОH |
|
этиловый спирт |
|
−ОН |
|
|
R−OH |
|
|
||||
Альдегиды |
|
−С=O |
|
Карбонил |
|
R−CHO |
|
СН3–СНO |
|
уксусный альдегид |
|
|
|
|
|
||||||
Кетоны |
|
|
|
|
|
R−CO−R |
|
СН3−СО−СН3 |
|
ацетон |
Карбоновые кислоты |
|
−СOОН |
|
Карбоксил |
|
R−COOH |
|
СН3−СООН |
|
уксусная кислота |
Сложные эфиры |
|
−СOO− |
|
Сложноэфирн. |
|
R−COOR' |
|
СН3−СООС2Н5 |
|
этилацетат |
Нитросоединвния |
|
−NO2 |
|
Нитрогруппа |
|
R−NO2 |
|
СН3−NО2 |
|
нитрометан |
|
|
|
|
|
||||||
Амины |
|
−NH2 |
|
Аминогруппа |
|
R−NH2 |
|
C2H5−NH2 |
|
этиламин |
Сульфокислоты |
|
−SО3Н |
|
Сульфогруппа |
|
Ar−SO3H |
|
С6Н5−SО3Н |
|
бензолсульфокислота |
|
|
|
|
|
Примечание − R – углеводородный радикал соединений жирного ряда; Аr – радикал ароматических соединений.
В процессе изучения органической химии будут подробно рассматриваться свойства функциональных групп соответствующих классов соединений.
1.7 СОСТАВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Основные элементы, входящие в состав органических соединений, – углерод, водород, кислород, азот. В состав многих органических соединений могут входить сера, галогены, фосфор и другие элементы. Для определения состава органического вещества проводят качественный элементный анализ. Рассмотрим, как определяются в веществах элементы: углерод, водород, азот, сера и галогены.
Определение углерода и водорода. При нагревании вещества с оксидом меди (II) углерод окисляется в СО2, обнаруживаемый известковой или баритовой водой, а водород – в Н2О, наблюдаемую визуально на стенках пробирки:
(С) + 2СuО → CO2 + 2Сu,
21
2(Н) + СuO → H2O + Сu
(скобки, в которые заключены символы С и Н, означают, что эти элементы входят в состав органического вещества).
Кислород. Пока отсутствуют качественные реакции для определения кислорода. Обычно о его присутствии судят по результатам количественного анализа или с помощью физических методов.
Азот. При нагревании вещества с натронной известью выделяется аммиак, обнаруживаемый красной лакмусовой бумажкой. Это упрощенный способ определения азота
Сера. Упрощенно серу можно обнаружить, нагревая вещество с концентрированным раствором щелочи. Образовавшийся сульфид дает черный осадок при взаимодействии его с солью свинца (меди), например:
Na2S + Рb(NО3)2 = PbS↓ + 2NaNO3.
Галогены. Наиболее простой способ обнаружения галогенов – проба Бейльштейна: при нагревании вещества на прокаленном медном предмете (при прокаливании медь покрывается темным налетом СuO, играющим роль окислителя) образуется летучая соль меди, окрашивающая пламя в зеленый цвет.
Количественным анализом устанавливают массовые доли элементов в соединении. Полученные результаты качественного и количественного анализа вещества позволяют
установить его формулу. Допустим, анализ показал, что в состав вещества входит 80% углерода и 20% водорода, а относительная молекулярная масса равна 30. Разделив долю каждого элемента на его атомную массу, получаем соотношение атомов 6,66:20. Если это соотношение привести к целым числам, то получится 1:3, т.е. на один атом углерода приходится три атома водорода. Это простейшая формула СН3, молекулярная масса ее равна 15. По условию задачи относительная молекулярная масса вещества равна 30, следовательно, истинная молекулярная форму-
ла C2H6.
Рассмотрим еще один пример. При сжигании вещества массой 8,6 г образовалось 26,4 г CO2 и 12.6 г Н2О, плотность его 3,84 г/л. Определите молекулярную формулу вещества.
Прежде всего, можно по плотности определить молярную массу вещества: 3,84 г/л 22,4 л/моль = 86 г/моль,
отсюда Мr = 86. Далее рассчитываем массу углерода и водорода во взятой навеске вещества: m(С) = 26,4 12/44 = 7,2 г; m(Н) = 12,6 2/18 = 1,4 г.
Сумма масс углерода и водорода показывает, что вещество содержит только элементы углерод и водород.
Разделив массу каждого элемента на его атомную массу, получим соотношение 0,6:1,4 или в целых числах 3:7. Простейшая формула С3Н7 (ее Мr = 43), а истинная молекулярная фор-
мула C6H14.
После установления молекулярной формулы вещества определяют его химическое строе-
ние.
Таким образом, анализ чистого вещества слагается из следующих операций: установление элементного состава (качественный анализ), определение количественного состава, установление молекулярной формулы, доказательства химического строения.
22
УГЛЕВОДОРОДЫ
Название "углеводороды" показывает, что эти вещества состоят из двух элементов – углерода и водорода и образуют различные группы соединений: предельные углеводороды – алканы, циклические углеводороды – циклоалканы; непредельные углеводороды – алкены, алкины, алкадиены; ароматические углеводороды. Рассматривать их мы начнем с предельных углеводородов.
Глава 2. АЛКАНЫ. ЦИКЛОАЛКАНЫ
2.1 СОСТАВ И ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Алканы – углеводороды, в молекулах которых атомы углерода, проявляя валентность четыре, до предела насыщены атомами водорода.
Рассмотрите таблицу 2.1. Можно заметить, что состав алканов изменяется монотонно. Разница в составе между двумя соседними углеводородами постоянная – группа атомов -СН2.
Ряд веществ, отличающихся между собой на одну иди более групп −СН2, называется
гомологическим рядом, а сами вещества – гомологами (от греч. homologos – подобный):
группа −СН2 – гомологическая разность.
Таблица 2.1 − Состав и физические свойства алканов
Название |
Формула |
Температура |
Температура |
Плотность |
|
плавления, °C |
кипения, °C |
при 20°C |
|||
|
|
||||
Метан |
СН4 |
-184,0 |
-161,5 |
|
|
Этан |
С2Н6 |
-172,0 |
-88,3 |
|
|
Пропан |
С3Н8 |
-189,9 |
-42,17 |
|
|
Бутан |
С4Н10 |
-135,0 |
-0,6−0,3 |
|
|
Пентан |
С5Н12 |
-131,6 |
36,2 |
0,626 |
|
Гексан |
С6Н14 |
-94,3 |
69,0 |
0,659 |
|
Гептан |
С7Н16 |
-90,5 |
98,4 |
0,684 |
|
Октан |
С8Н18 |
-56,5 |
125,8 |
0,703 |
|
Нонан |
С9Н20 |
-53,7 |
150,8 |
0,718 |
|
Декан |
С10Н22 |
-30−32 |
174,0 |
0,730 |
|
Ундекан |
С11Н24 |
-26,5 |
195,8 |
0,740 |
|
Додекан |
С12Н26 |
-12,0 |
214,5 |
0,749 |
|
Тридекан |
С13Н28 |
-6,2 |
234,0 |
0,757 |
|
Тетрадекан |
С14Н30 |
5,5 |
252,5 |
0,764 |
|
Пентадекан |
С15Н32 |
10,0 |
270,0 |
0,769 |
|
Гексадекан |
С16Н34 |
20,0 |
287,5 |
0,775 |
Общая формула для алканов – СnН2n+2, где n – число атомов углерода. Например, при n = 7 алкан будет иметь состав C7H16.
Самый простой по составу углеводород – метан СН4. Это газ без цвета и запаха, почти в 2 раза легче воздуха (средняя молекулярная масса воздуха 29), очень мало растворим в воде. Поэтому его легко собирать вытеснением воды. Метан входит в состав природного газа. В природном газе, а также в попутном нефтяном газе содержатся кроме метана и другие газообразные углеводороды: этан С2Н6, пропан C3H8, бутан С4Н10. Метан встречается в заболоченных водоемах (болотный газ), каменноугольных шахтах (рудничный газ).
Первые четыре простейших углеводорода – метан, этан, пропан, бутан – имеют исторически сложившиеся (тривиальные) названия. Названия остальных углеводородов составляются из греческого (реже латинского) числительного, которое соответствует числу атомов углерода в молекуле углеводорода, и суффикса-ан, например пентан ("пента" – пять), октан ("окта" – восемь).
23
Первые четыре алкана (С1−С4) при комнатных условиях – газы, далее следуют жидкости и начиная с С16Н34 – твердые вещества.
В связи с тем что молекулы алканов состоят из неполярных С−С и малополярных С−Н связей, они практически не растворяются в воде. Согласно эмпирическому правилу "подобное растворяется в подобном" алканы растворимы в неполярных растворителях (эфир, бензол и др.) и нерастворимы в воде и других сильно полярных растворителях.
Все алканы легче воды; их плотность возрастает с увеличением числа атомов углерода в молекулах.
2.2 ХИМИЧЕСКОЕ СТРОЕНИЕ АЛКАНОВ. ИЗОМЕРИЯ
Молекулы алканов характеризуются наличием ковалентных связей С−Н и С−С, атомы углерода в них четырехвалентны и насыщены до предела атомами водорода. Поэтому алканы имеют другие названия: насыщенные, или предельные, углеводороды.
Атомы углерода в молекулах алканов химически связаны между собой в определенной последовательности. Так, в молекуле пропана атомы углерода соединены в такой последовательности:
H H H
H C C C H
H H H
Если написать структурную формулу пропана по-иному:
|
|
H |
|
|
H |
H |
H |
H |
||||
H |
|
|
|
|
|
|
|
|
|
|||
|
C |
|
|
C |
|
H |
H C |
C C |
H |
|||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
H |
H |
|
C |
|
H H |
H |
|||||||
|
|
|
|
|||||||||
H
последовательность соединения атомов не изменяется.
Структурные формулы веществ часто изображают в сокращенном виде: СН3−СН3,
СН3−СН2−СН3.
Для бутана С4Н10 А.М. Бутлеров, как вам известно, предложил двоякое расположение атомов углерода – в виде прямой и разветвленной цепи:
|
|
H |
|
H |
|
H |
|
H |
|
H |
|
H |
|
|
H |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H |
|
C |
|
C |
|
C |
|
C |
|
H и H |
|
C |
|
|
C |
|
|
C |
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
H |
|
H |
|
H H |
|
C |
|
H H |
|||||||||||||
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|||
Если в формуле I атом углерода соединен с одним или двумя другими атомами углерода, то в формуле II появился атом, который соединен с тремя атомами углерода.
Бутан с прямой (нормальной) цепью был уже известен науке, Бутлеров синтезировал предсказанный бутан с разветвленной цепью и назвал его изобутаном. Поскольку бутан и изобутан различаются порядком соединения атомов (химическим строением), то они различаются между собой и свойствами, например температурой кипения:
CH3 |
|
CH2 |
|
CH2 |
|
CH3 |
CH3 |
|
CH |
|
CH3 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t кип = 0,5oС |
CH3 |
||||||||||
|
t кип = 11,7oС |
|||||||||||
Для состава C5H12 Бутлеров предположил существование трех углеводородов, различающихся между собой химическим строением:
Все они получены учеником Бутлерова М.Д. Львовым. Вещества, имеющие одинаковый
24
состав, но различное химическое строение, а, следовательно, обладающие разными свойствами, называются изомерами. Само явление называют изомерией.
Химическое Строение часто называют структурой вещества, поэтому указанное явление называют структурной изомерией, а сами вещества – структурными изомерами.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|||
CH3 |
|
CH2 |
|
CH2 |
|
CH2 |
|
CH3 |
CH3 |
|
|
CH |
|
CH2 |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
CH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
o |
|
|
|
CH3 |
o |
|
|
CH3 |
o |
||||||||
|
|
t кип = 36,2 С |
t кип = 28,0 С |
t кип = 9,5 С |
|||||||||||||||||||
С увеличением числа атомов углерода в молекуле углеводорода число изомеров резко возрастает. Если бутан имеет 2 изомера, пентан – 3 изомера, то у декана С10Н22 –75 изомеров, а у пентадекана С15Н32 – 4347 изомеров.
Обратим внимание на такую особенность изомеров: изомеры с разветвленной углеродуглеродной цепью имеют более низкую температуру кипения, чем изомеры с прямой цепью; чем больше разветвлений, тем ниже температура кипения. Как объяснить это явление? Форма разветвленных молекул стремится к сферической, при этом уменьшается площадь поверхности, что приводит к уменьшению межмолекулярных сил, которые преодолеваются при более низкой температуре.
Таким образом, только теория химического строения (или структурная теория) смогла объяснить явление изомерии, широко распространенное в органической химии.
Без одного атома водорода молекула алкана превращается в одновалентный углеводородный радикал. Их названия образуются от названий соответствующих алканов, только меняется суффикс -ан на -ил. Например, метан СН4 – радикал метил СН3−, этан С2Н6 – этил C2H5− или
СН3–СН2−, пропан С3H8 – пропил С3Н7− или СН3–СН2–СН2−.
Названия алканов строят, исходя из химического строения. Из различных номенклатур современная – международная (систематическая) номенклатуре (IUPAC). При ее использо-
вании надо знать название углеводорода нормального строения и название замещающего радикала.
Чтобы составить название углеводорода разветвленного строения, необходимо выбрать наиболее длинную цепь атомов углерода и пронумеровать их начиная с того конца. к которому ближе разветвление (радикал). В названии углеводорода вначале цифрой указывают место радикала (заместителя) в цепи, затем называют сам радикал и, наконец, пишут название углеводорода по числу атомов углерода в наиболее длинной цепи. Например:
1 |
2 |
3 |
4 |
||||
CH3 |
|
|
CH |
|
CH2 |
|
CH3 |
|
|
|
|
||||
|
|
||||||
CH3
2-метилбутан
Если есть несколько одинаковых заместителей (радикалов), то их число пишут прописью (ди-, три-) перед названием радикала; цифры, указывающие положение заместителей, разделяют запятыми. Например:
1 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2 |
|
3 |
4 |
1 |
2 |
3 |
|
4 |
5 |
||||||||||
CH3 |
|
C |
|
CH2 |
|
CH3 |
CH3 |
|
CH |
|
CH |
|
CH2 |
|
CH3 |
||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH3 |
|
|
|
|
|
CH3 CH3 |
|
|
|
||||||||
2,2-диметилбутан |
|
2,3-диметилпентан |
|||||||||||||||||
При разных заместителях нумерацию ведут с того конца, к которому ближе расположен радикал более простого строения. Например:
1 |
2 |
|
3 |
4 |
5 |
|
6 |
||||||
CH3 |
|
CH |
|
CH2 |
|
CH |
|
CH2 |
|
CH3 |
|||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C2H5 |
|
||||||||
|
2-метил-4-этилгексан |
|
|||||||||||
25

Углеводороды нормального строения (атомы углерода образуют прямую цепь) обозначают буквой н-: н-пентан, н-гексан.
Атомы углерода в молекулах алканов изомерного строения занимают разное положение: одни находятся на краю углеродной цепи, другие в местах разветвлений. В связи с этим вводят классификацию атомов углерода: первичные (I), вторичные (II). третичные (III), четвертичные (IV). Например:
I
I |
|
II |
IV |
CH3 |
III II |
|
I |
||||||
|
|
|
|
||||||||||
CH3 |
|
CH2 |
|
|
C |
|
CH |
|
CH2 |
|
CH3 |
||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 CH3 |
|
|
||||||||
|
|
|
|
|
I |
I |
|
|
|||||
Первичный атом углерода затрачивает однувалентность на связь с другим атомом углерода; вторичный атом углерода затрачивает две валентности на связь с двумя другими атомами углерода; третичный атом углерода затрачивает три валентности на связь с тремя другими атомами углерода; четвертичный атом углерода затрачивает все валентности на связь с четырьмя другими атомами углерода. Положение атома углерода в соединении влияет на его свойства, поэтому мы будем часто обращатьсяк этомупонятиюпри изучении органической химии.
2.3 ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ АЛКАНОВ
Связь между атомами углерода и водорода осуществляется общими электронными парами. Так, электронная формула пропана может быть представлена следующим образом:
H H H
. . . . . .
H : C : C : C : H
. . . . . .
H H H
Рис. 2.1. Схема sp3-гибридизации
Однако такая трактовка химической связи еще не позволяет судить о том, как в действительности построена молекула, о ее пространственном строении.
Атомы углерода в молекулах метана и в целом в молекулах алканов находятся в состоянии sp3-гибридизации.
В результате гибридизации трех р-орбиталей и одной s-орбитали происходит их выравнивание по форме и энергии, появляются четыре одинаковые гибридные орбитали (рис. 2.1). Гибридные sp3-орбитали имеют грушевидную форму, они сильно вытянуты в одну сторону от ядра в направлении к вершинам тетраэдра (рис. 2.2). Такая форма орбиталей способствует большему перекрыванию с электронными облаками других атомов.
Экспериментально доказано, что все четыре гибридные орбитали атома углерода в молекуле метана направлены относительно друг друга под тетраэдрическими углами 109°28'. Такое пространственное направление позволяет им быть максимально удаленными друг от друга. В результате перекрывания гибридных sp3-орбиталей и s-орбиталей четырех атомов водорода образуется молекула с прочными ковалентными связями (рис. 2.3). Это простая, одинарная связь, ее принято называть сигма σ-связью. Она расположена на прямой, соединяющей ядра двух атомов:
26

Рис. 2.2. Гибридные sр3-орбитали |
Рис. 2.3. Перекрывание sр3-орбиталей с |
|
s-орбиталями атомов водорода |
Рис. 2.4. Шаростержневая модель молекулы метана
Рис. 2.5. Масштабная модель молекулы метана
Для лучшего понимания строения молекулы метана используют различные модели: шаростержневую (рис. 2.4) и масштабную (рис. 2.5). В шаростержневой модели шарики, изображающие атомы, соединяются стерженьками – связями. Атомы находятся друг от друга как бы на значительном расстоянии. В действительности же атомы в молекуле плотно "упакованы", химически связанные атомы непосредственно прилегают друг к другу, незаполненного пространства между атомами нет. Тем не менее шаростержневыми моделями широко пользуются, так как они просты в обращении, правильно передают валентные углы и весьма подвижны.
Точнее отражает строение молекулы метана масштабная модель. Детали в модели изготовляются в определенном масштабе по отношению к действительным размерам атомов. Модель дает представление о заполнении внутримолекулярного пространства.
Молекула этана построена из двух соединенных между собой углеродных тетраэдров, молекула пропана – из трех тетраэдров (рис. 2.6). Между атомами углерода образуется прочная σ-связь, ее длина равна 0,154 нм:
H |
C σ C |
H |
H |
H |
|
H |
0,154 нм |
H |
Модель молекулы этана представлена на рисунке 2.7.
В молекуле пропана и в последующих углеводородах атомы углерода расположены не по прямой линии, а зигзагообразно (рис.
Рис. 2.6. Образование σ-связей в молекулах |
Рис. 2.7. Масштабная модель |
этана и пропана |
молекулы этана |
27

Рис. 2.8. Масштабные модели молекул пропана |
Рис. 2.9. Зигзагообразное строение |
и бутана |
углеродной цепи (схема) |
2.8), поскольку валентные связи атомов углерода |
|
имеют тетраэдрическую направленность. При этом |
|
сохраняется тетраэдрический угол 109°28, а расстоя- |
|
ние между ядрами атомов углерода (длина связи) со- |
|
ставляет 0,154 нм (рис. 2.9). |
Рис. 2.10. Симметричное распределе- |
Таким образом, молекулы алканов имеют |
ние электронной плотности относи- |
тетраэдрическое строение. Полностью подтверди- |
тельно оси, соединяющей ядра атомов |
лось предположение Вант-Гоффа: с помощью физи- |
углерода |
ческих методов удается в наше время определять |
|
межатомные (точнее, межъядерные) расстояния и валентные углы, т.е. получать картину реального расположения атомов в молекуле.
В связи с тем, что молекулы находятся в постоянном движении, зигзагообразная углеродная цепь может принимать различные положения в пространстве. Этому способствуют σ-связи, у которых электронная плотность распределена симметрично относительно оси, соединяющей ядра атомов углерода (рис. 2.10). При вращении атомов вокруг этой оси не будет нарушаться перекрывание орбиталей, не будут искажаться валентные углы. Свободное вращение атомов вокруг σ-связей и позволяет молекуле принимать различные геометрические формы – конформации.
2.4 КОНФОРМАЦИОННАЯ ИЗОМЕРИЯ
Причина образования конформации – вращение атомов вокруг σ-связи. Рассмотрим это явление на простом примере. Молекула этана состоит из двух связанных между собой метильных радикалов. При вращении вокруг простой связи одной метильной группы относительно другой в молекуле этана возможно большое число положений. Из них можно выделить два крайних положения:
|
|
H |
|
H |
H |
H |
|
|
|
||
|
C |
|
H |
C |
|
|
|
|
|
||
C |
H |
H |
|
C |
H |
H |
H |
|
H |
H |
|
|
|
||||
|
А |
|
|
Б |
|
Они отличаются друг от друга тем, что в конформации А, если ее рассматривать вдоль связи С−С, атомы водорода ближайшей СН3-группы будут "заслонять" атомы водорода второй, удаленной СН3-группы. Такая конформация называется заслоненной.
В конформации Б атомы водорода второй СН3-группы расположены в промежутках между атомами водорода первой СН3-группы. Такая конформация называется заторможенной.
Геометрические формы молекул, переходящие друг в друга при вращении атомов вокруг простых связей, у которых валентные углы и длина связей остаются без изменения, называются конформациями.
28
|
|
|
|
|
Иногда |
конформации называ- |
|
|
H H |
|
H |
ют поворотными изомерами, хотя |
|||
|
|
H |
|
H |
название это не совсем удачное, так |
||
|
|
|
|
|
как изомеры – реальные вещества, |
||
|
|
|
|
|
отличающиеся строением. |
||
H |
|
|
|
|
Часто |
для |
более наглядного |
H |
|
|
|
изображения |
конформации пользу- |
||
|
|
|
|||||
H |
H |
H |
|
H |
ются другой проекцией – формула- |
||
|
А |
|
H |
ми Ньюмена (по имени американ- |
|||
|
|
Б |
ского ученого М.С. Ньюмена, пред- |
||||
Рис. 2.11. Формулы Ньюмена для двух конформаций этана: |
ложившего |
их |
использование). В |
||||
|
А − заслоненная; Б − заторможенная |
|
|
центре рисунка, на пересечении трех |
|||
|
|
|
|
|
|||
сходящихся прямых, находится атом углерода приближенной СН3-группы. Связи С−Н второй СН3-группы "выглядывают" из-за круга (рис. 2.11). Такой способ изображения конформации ускоряет их зарисовку, дает возможность быстрее разобраться в пространственном расположении атомов.
Энергетический барьер перехода одной конформации (А) в другую (Б) небольшой, примерно 12,6 кДж/моль. Поэтому выделить отдельные конформации при обычных условиях не удается.
Какая конформация обладает большей устойчивостью? Очевидно, более устойчива, более выгодна заторможенная, поскольку у нее меньше внутренняя энергия (в этом положении внутреннее вращение вокруг простых связей затормаживается).
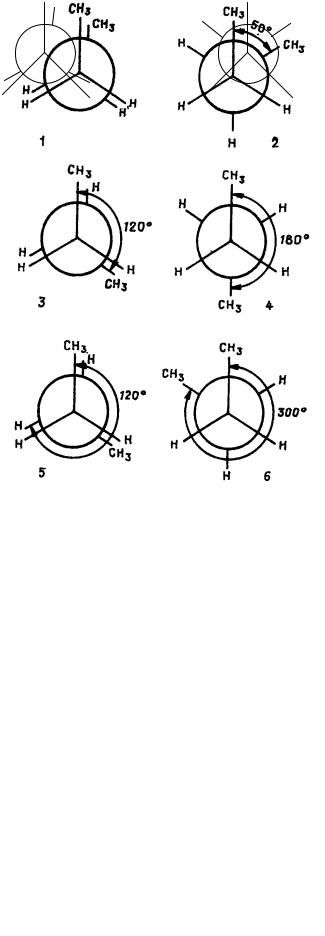
С удлинением углеродной цепи число возможных конформаций увеличивается. Например, у бутана по центральной связи С−С их шесть при условии, что угол между связями изменяется через 60°. Взаимная ориентация СН3-групп показана на рисунке 2.12. На нем слева (1, 3, 5) изображены заслоненные конформации с углами: 0°, 120° и 240°: справа (2, 4, 6) – заторможенные конформации: 60°, 180° и 300°.
Конформация 4, где СН3-группы противоположно направлены, называется трансоидной, она самая устойчивая, энергетически выгодная. Конформации 2 и 6 называются скошенными.
Длинные углеродные цепи могут принимать самые разнообразные конформации, среди которых преобладают более выгодные (они имеют меньшую энергию). Молекулы органического вещества, как правило, представляют смесь различных конформаций, имеющих одинаковое химическое строение.
Следует помнить, что молекулы
алканов и в целом органические соединения – не плоские фигуры, как это изображается на бумаге, а объемные тела определенного пространственного строения.
Представления о конформациях прочно вошли в органическую химию и стали частью стереохимии – учения о пространственном строении молекул. Они позволяют характеризовать физические и химические свойства органиче-
Рис. 2.12. Конформации бутана по центральной С−С- ских веществ. связи
29

2.5 ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Известно, что химические свойства соединений определяются составом и строением их молекул. Химические связи С−Н и С−С характеризуются высокой энергией, соответственно 415 кДж/моль и 347 кДж/моль, а также низкой или отсутствующей полярностью. Отсюда можно сделать вывод о малой химической активности алканов. Этим можно объяснить их историческое название "парафины" (от лат. рarum – мало и offinis – сродство). На них при обычной температуре не действуют концентрированные кислоты (серная, соляная), перманганат калия, металлический натрий и др.
1. Реакция замещения. Алканы вступают в реакцию лишь при сильном нагревании или под действием яркого дневного (или ультрафиолетового) света. Так проходит реакция взаимодействия метана и хлора. При этом атомы водорода в молекуле метана постепенно замещаются атомами хлора.
|
|
H |
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
H |
|
||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
H + Cl2 |
|
H |
|
C |
|
Cl + HCl , |
H |
|
C |
|
Cl + Cl2 |
|
H |
|
C |
|
Cl + HCl , |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
H |
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
Cl |
|
||||||||
|
|
|
|
|
|
|
хлорметан |
|
|
|
|
|
|
|
дихлорметан |
|||||||||||
|
|
H |
|
|
|
|
Cl |
|
|
|
Cl |
|
|
|
|
|
Cl |
|
||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
C |
|
Cl + Cl2 |
|
H |
|
C |
|
Cl + HCl , |
H |
|
C |
|
Cl + Cl2 |
|
Cl |
|
|
C |
|
Cl + HCl |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Cl |
|
|
|
|
Cl |
|
|
|
Cl |
|
|
|
|
|
Cl |
|
||||||||
|
|
|
|
|
|
|
трихлорметан |
|
|
|
|
|
|
тетрахлорметан |
||||||||||||
|
|
|
|
|
|
|
(хлороформ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
В результате реакции, которая называется хлорированием, образуется смесь хлорпроизводных.
Аналогично протекает реакция и с бромом (бромирование) с образованием бромпроизводных. Однако бромирование алканов протекает менее энергично, чем хлорирование. Фтор реагирует с алканами со взрывом, что делает невозможным их прямое фторирование.
Таким образом, на протекание реакции галогенирования влияет природа реагирующего галогена. О возможности реакции можно судить по энтальпиям диссоциации химических связей (энергия диссоциации связи равна энергии образования связи), т.е. по подсчету энергетического баланса. Так, при хлорировании метана (при замещении одного атома водорода)
Н3С−Н + Cl−Cl → Н3С−Cl + Н−Cl
происходит разрыв связей С−Н и Cl−Cl, на который надо затратить соответственно 415 + 240 = 655 кДж/моль. При образовании новых связей С−Сl и Н−Сl выделяется энергия 330 + 430 = 760 кДж/моль. Энтальпия хлорирования равна: ∆Нхл = 655 – 760 = -105 кДж/моль. Энергетический баланс, следовательно, положительный, реакция экзотермическая.
На галогенирование влияет не только природа галогена, но и природа алкана. Так, из изомеров состава С5Н12 быстрее подвергается галогенированию изомер разветвленного строения 2- метилбутан, а именно водород СН-группы при третичном атоме углерода.
Реакцию бромирования можно наблюдать на таком наглядном опыте. В пробирку помещают 2 капли брома и приливают 3,5 мл гексана (изооктана или очищенного керосина, состоящего из смеси предельных углеводородов). Смесь взбалтывают до получения прозрачного желтого раствора. Половину объема жидкости закрывают темной полоской бумаги (рис. 2.13). К пробирке присоединяют газоотводную трубку и соединяют ее с пробиркой 1 – с синим лакмусом и пробиркой 2 – с раствором нитрата серебра.
Реакцию бромирования проводят на солнечном или дневном рассеянном свете или при облучении кварцевой лампой. При использовании лампы пробирку устанавливают на
30
