
ЦБП
.pdf
тяжение). Затем следует три 2р-орбитали с равной энергией, имеющие форму гантели. Гантель состоит из двух частей, между которыми находится ядро атома. Орбитали расположены взаимно перпендикулярно (рис. 1.2) вдоль трех осей пространственных координат (х, у, z).
Существует правило, определяющее распределение электронов в атоме, т.е. электронную конфигурацию атома. Это – правило или принцип запрета В. Паули (1925), согласно которому данную электронную орбиталь могут занимать только два электрона с противоположны-
ми спинами. Такие электроны называются спаренными. Электроны с одинаково направленными спинами стремятся удалиться друг от друга на максимальное расстояние.
Рассмотрим строение атома углерода на основе квантово-механических представлений. На первом энергетическом уровне атома имеются два электрона, на втором – четыре электрона. Электронную формулу строения атома углерода можно записать так: 1s2, 2s2, 2р2, где цифры 1 и 2 перед буквами указывают на номер электронного уровня (значение главного квантового числа п), буквы s и p – условные обозначения подуровней (числовых значений орбитального квантового числа l), цифры вверху у букв указывают число электронов на подуровне. Следовательно, на первом энергетическом уровне атома углерода находится два электрона – 1s2, на втором уровне два электрона на s-подуровне (2s2) и два электрона на р-подуровне (2р2).
Распределение электронов по квантовым ячейкам (орбиталям) для атома углерода можно изобразить так:

 2px 2py 2pz
2px 2py 2pz
C  2s2
2s2
1s2
Направление стрелки обозначает направление спина электрона.
При изучении соединений углерода мы будем обращаться к внешнему (валентному) электронному уровню атома углерода, на котором имеются два электрона (2s2) с антипараллельными спинами (спаренные электроны или неподеленная электронная пара), два неспаренных р- электрона и одна вакантная орбиталь (2рZ).
Валентность определяется числом неспаренных электронов, у атома углерода их два (2рX и 2рУ), т.е. углерод в соединениях должен проявлять валентность два. В действительности в органических соединениях он четырехвалентен, это было установлено химическим путем еще в XIX в. Объясняется это тем, что один из 2s2-электронов переходит на вакантную орбиталь (2рZ) Теперь у возбужденного атома углерода появилось четыре неспаренных электрона:

 2px 2py 2pz
2px 2py 2pz
C* 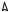 2s1
2s1
1s2
Атом углерода может проявлять свои четыре валентности и образовывать химические связи. Но связи получаются различные, т.к. разные электроны, разные орбитали. Три 2р- орбитали могут перекрываться с s-орбиталями трех атомов водорода, образуя прочные связи, при перекрывании 2s-орбитали атома углерода с s-орбиталью четвертого атома водорода может образоваться связь, отличная по энергии от других связей. Между тем доказано и химическим путем, и с помощью физических методов равноценность по прочности и другим показателям химических связей С−Э для метана, тетрахлорметана и других (где Э – элемент).
Выход из затруднения предложил известный американский химик Л. Полинг. Он выдвинул гипотезу, согласно которой одинаковую прочность связей следует объяснять гибридизацией орбиталей, т.е. смешением различных орбиталей и выравниванием их по форме и энергии. Гибридные орбитали отличаются по форме от негибридных: они имеют форму неправильной восьмерки, вытянутую в одну сторону (часто говорят грушевидную или гантелеобразную форму) На рисунке 1.3 показана схема образования гибридной орбитали.
Различают три вида гибридизации: sр3-, sр2- и sp-. Если гибридные орбитали образованы смешением одного s-электрона и трех р-электронов – это sp3-гибридизация, если гибридные
11
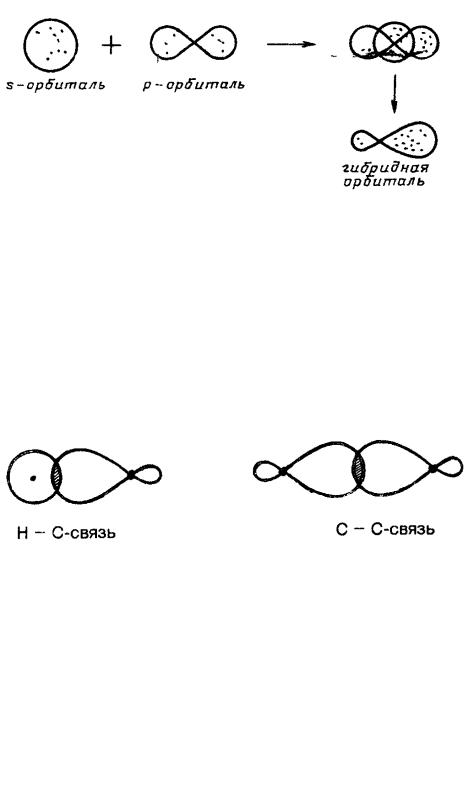
Рис 1.3. Схема образования гибридной орбитали
орбитали образованы одним s-электроном и двумя р-электронами – это sp2-гибридизация, наконец, образование гибридных орбиталей одним s-электроном и одним р-электроном называют sp-гибридизацией. Состояние атома углерода в sp3-гибридизации (первое валентное состояние) характерно для предельных углеводородов и их производных, sp2- и sp-гибридизация (соответственно второе и третье валентные состояния) характерны для непредельных соединений.
Перекрывание атомных орбиталей – образование связей – происходит по-разному. Если
перекрывание орбиталей осуществляется по прямой, соединяющей центры ядер атомов, то образовавшаяся связь называется σ (сигма) -связью. Такая связь образуется при перекры-
вании s- и гибридных орбиталей:
Перекрывание атомных орбиталей может происходить в плоскости, перпендикулярной σ-связи, такую связь принято называть π (пи) -связью. Она обычно образуется перекры-
ванием негибридных р-орбиталей, расположенных параллельно друг к другу:
Перекрывание р-орбиталей можно условно изобразить линиями, соединяющими гантели:
Прочность связи зависит от степени перекрывания орбиталей: чем больше их перекрывание, тем больше электронная плотность в пространстве между ядрами атомов, тем сильнее стягиваются ядра и прочнее химическая связь. Область перекрывания орбиталей значительно больше в случае σ-связи, чем π-связи.
Если связь между атомами осуществляется одной парой электронов с противоположными спинами, то такую связь называют одинарной или простой, это σ-связь. Если связь между двумя атомами осуществляется двумя парами электронов, то такая связь называется двойной (С=С), если связь осуществляется тремя парами электронов, то такая связь носит название тройной (С≡С). Двойные и тройные связи называются кратными. Их образование будет
12

Рис. 1.4. Тетраэдрическая модель молекулы метана
рассмотрено в следующих главах.
После выяснения природы химической связи стало возможным объяснение взаимного влияния атомов в молекулах на основе их электронного и пространственного строения. Зная распределение электронной плотности в молекулах соединений, можно сделать вывод об их химических свойствах, реакционной способности.
Таким образом, идеи А.М. Бутлерова и В.В. Марковникова о взаимном влиянии атомов в молекулах, высказанные на основе атомно-молекулярного учения, получили глубокое теоретическое обоснование на
основе электронных представлений.
Электронная природа химической связи позволила более глубоко рассматривать химические реакции, раскрывать механизмы их протекания
С химическим и электронным строением вещества непосредственно связано их пространственное строение. Теория химического строения рассматривает, как известно, только последовательность связи атомов в молекулах, зависимость свойств от химического строения, но не касается пространственного расположения атомов в молекулах соединений. Бутлеров считал, что для суждения о пространственном строении нужны доказательства, экспериментальные данные. Вместе с тем он утверждал возможность познания пространственного строения молекул веществ: "... Если атомы действительно существуют, то я не вижу, почему все наши попытки определить их пространственное расположение должны быть ... напрасны" (1863).
Идею о пространственном (стереохимическом) строении органических соединений выдвинули в 1874 г. голландский ученый Я.Г. Вант-Гофф и независимо от него французский ученый А. Ле Бель. Идея их заключалась в том, что четыре заместителя расположены симметрично в углах воображаемого тетраэдра вокруг четырехвалентного атома углерода, т.е. пространственное строение молекул обусловлено определенной направленностью валентных связей атома углерода. Это видно на примере молекулы метана (рис. 1.4).
Высказанная идея о пространственном строении была не более чем гипотезой. Последующее развитие науки дало этой гипотезе прочную физическую основу: с помощью физических методов (рентгенографии, электронографии) стало возможным определить расположение ядер атомов в молекуле, расстояния между ними, валентные углы, т.е. получить реальную картину расположения атомов в молекуле, ее геометрию.
1.3 ХАРАКТЕРИСТИКА КОВАЛЕНТНОЙ СВЯЗИ
Ковалентная связь характеризуется следующими физическими параметрами: энергией, длиной, пространственной направленностью, полярностью и поляризуемостью (табл. 1.1).
Известно, что образование ковалентной связи между атомами сопряжено с выделением энергии, называемой энергией связи. Энергия связи указывает на ее прочность и измеряется в килоджоулях на моль (кДж/моль). Мерой энергии связи чаще считают количество энергии, затрачиваемое на ее разрыв. Например, энергия связи С−Сl составляет 240 кДж/моль. Энергия связи зависит от природы связанных атомов и типа связи.
Ковалентная связь характеризуется определенной длиной – расстоянием между центрами ядер атомов. Так, длина связи Н−О выражается величиной 0,096 нм.
Ковалентные связи, образуемые многовалентными атомами, имеют определенную пространственную направленность; между направлениями ковалентных связей такого атома образуется валентный угол (в случае НОН угол равен 105°).
13

Многие молекулы веществ состоят из равного числа положительных и отрицательных зарядов и в целом электронейтральны. В то же время у них есть как бы центры положительных и отрицательных зарядов. Эти центры могут совпадать (такие молекулы будут неполярными) или не совпадать (такие молекулы будут полярными). Образование полярных молекул – результат поляризации связей, поскольку атомы, образующие молекулы, могут обладать разным сродством к электронам (отличаться электроотрицательностью), Из-за различной электроотрицательности атомов в молекуле (табл. 1.2) и может нарушаться симметрия распределения зарядов: одни атомы приобретаю частичный отрицательный заряд в результате сдвига к ним электронной плотности, другие атомы лишаются доли своей электронной плотности и приобретают частичный положительный заряд. Эти неполные заряды
Таблица 1.1 − Физические характеристики ковалентных связей |
|
|||
|
|
|
|
|
Связь |
Длина, нм |
Энергия, кДж/моль |
Полярность, D |
Поляризуемость, см3 |
С–С |
0,154 |
350 |
0 |
1,3 |
С=С |
0,133 |
620 |
0 |
4,2 |
С≡С |
0,120 |
810 |
0 |
6,2 |
С–О |
0,143 |
340 |
0,7 |
1,5 |
С=О |
0,121 |
695 |
2,4 |
3,3 |
C–N |
0,147 |
290 |
0,45 |
1,6 |
C=N |
0,127 |
615 |
1,1 |
3,8 |
C≡N |
0,115 |
866 |
3,1 |
4,8 |
C–F |
0,140 |
448 |
1,39 |
1,4 |
С–Сl |
0,176 |
330 |
1,47 |
6,5 |
C–Br |
0,191 |
280 |
1,42 |
9,4 |
C–I |
0,212 |
213 |
1,25 |
14,6 |
H–C |
0,109 |
415 |
0,4 |
1,7 |
H–O |
0,096 |
465 |
1,51 |
1,7 |
Н–N |
0,101 |
390 |
1,31 |
1,8 |
Сl–Сl |
0,196 |
240 |
0 |
11,9 |
Вг–Вг |
0,228 |
188 |
0 |
|
I–I |
0,266 |
150 |
0 |
27,8 |
Н–Сl |
0,127 |
430 |
1,03 |
7,1 |
Н–I |
0,161 |
300 |
0,78 |
15,0 |
N–N |
0,148 |
163 |
0 |
2,0 |
O=С |
0,121 |
495 |
0 |
|
N–O |
0,137 |
200 |
1,0 |
2,4 |
Н–Н |
0,074 |
435 |
0 |
|
или доли заряда электрона обозначают δ+ и δ- (δ – греч. "дельта"). Например:
δ+ |
δ− |
|
δ− |
|
|
H |
|
Cl |
δ+ |
O |
+ |
|
|||||
|
|
|
H |
|
Hδ |
Таблица 1.2 − Относительные величины электроотрицательности (χ) некоторых химических элементов (по Полингу)
Химический элемент |
χ |
Химический элемент |
χ |
Н |
2,1 |
Si |
1,8 |
С |
2,5 |
В |
2,0 |
N |
3,0 |
As |
2,0 |
О |
3,5 |
Li |
1,0 |
F |
4,0 |
Са |
1,0 |
Сl |
3,0 |
К |
0,8 |
Вr |
2,8 |
Ва |
0,9 |
I |
2,4 |
Na |
0,9 |
Р |
2,1 |
Мg |
1,2 |
S |
2,5 |
Аl |
1,5 |
14
Полярность ковалентных связей – их важнейшее свойство, определяющее реакционные возможности молекулы. При поляризации связей возникает диполь – два противоположных по заряду электрических полюса, находящихся на определенном расстоянии. Диполь характеризуется дипольным моментом – произведением величины заряда (е) на расстояние (l) между центрами положительных и отри-
|
цательных зарядов: |
||||
|
|
|
|
|
µ = е l. |
|
Величина дипольного момента измеряется в дебаях (по имени |
||||
|
ученого П. Дебая) и обозначается D (1D = 3,3 10-30Кл/м). Дипольный |
||||
|
момент – величина векторная, т.к. он характеризуется не только чи- |
||||
|
словым значением, но и направлением. Дипольный момент рассмат- |
||||
|
ривается как вектор, направленный от центра положительных заря- |
||||
|
дов к центру отрицательных зарядов. В хлороводороде электронная |
||||
|
плотность больше смещена к атому хлора, дипольный момент моле- |
||||
|
кулы (одновременно это будет и дипольный момент связи Н−С1) ра- |
||||
|
вен 1,03 D . H |
|
|
|
Cl |
|
|
|
|
||
|
|
|
|||
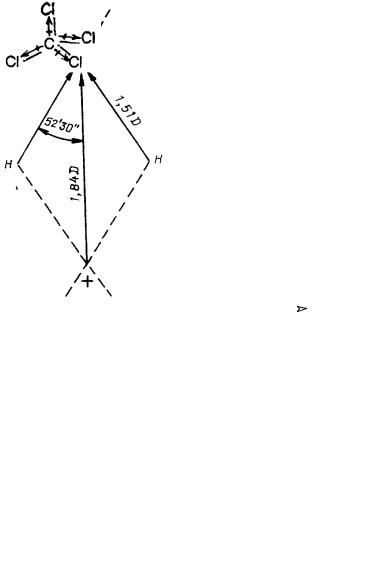
Рис. 1.5. Дипольный |
В многоатомной молекуле дипольный момент зависит не только |
||||
момент молекулы воды |
от электроотрицательности атомов, но и от геометрии молекулы. Ди- |
||||
|
польный момент воды определяется как векторная сумма моментов |
||||
связей Н−О, он равен 1.84 D (рис. 1.5).
Дипольный момент молекулы оксида углерода (IV) равен нулю, хотя в ней имеются полярные связи, но векторы дипольных моментов отдельных связей углерод-кислород противоположны по направлению и при сложении взаимно уничтожаются O
 C
C  O
O
У метана (СН4) и тетрахлорметана (ССl4) дипольные моменты равны нулю. Индивидуальные связи, например у тетрахлорметана, полярны, но вследствие симметричности тетраэдрического расположения они компенсируют друг друга:
Важная характеристика ковалентных связей – их поляризуемость, способность изменять свою полярность под действием внешнего электромагнитного поля. Такое влияние может оказывать и частица, приближающаяся к молекуле в процессе химической реакции. Поэтому поляризуемость часто имеет более важное значение для химических превращений, чем полярность.
Таковы важнейшие физические характеристики ковалентных связей. Их численные значения, к которым придется прибегать, даны в таблицах 1.1−1.3.
Таблица 1.3 − Дипольный момент некоторых органических соединений
Формула |
Дипольный момент, D |
Формула |
Дипольный момент, D |
СН4 |
0 |
CHF3 |
1.59 |
СН3–СН3 |
0 |
СF3Сl |
0.47 |
(СН3)3СН |
0 |
CFCl3 |
0.53 |
CH2=CH2 |
0 |
CF2Cl2 |
0.51 |
СН3–CH=СН2 |
0.35 |
СН3ОН |
1.69 |
C2Н5–СН=СН2 |
0.37 |
C2H5OH |
1.69 |
Н–С≡С–Н |
0 |
СН3–O–СН3 |
1.29 |
СН3–С≡СН |
0.75 |
СН3–СНО |
2.7 |
С2Н5–С≡СН |
0.80 |
C2H5–CHO |
2.73 |
С3Н7–С≡СН |
0.85 |
СН3–CО–СН3 |
2.71 |
С4H9–C≡СН |
0.87 |
СН3–СООН |
1.73 |
СН3Сl |
1.83 |
C2H5–COOH |
1.74 |
C2H5Cl |
2.00 |
СН3–NО2 |
3.54 |
CH2Cl2 |
1.57 |
С6Н6 |
0 |
15

СHCl3 |
1.05 |
C6H5–СН3 |
0.37 |
ССl4 |
0 |
C6H5–С2Н5 |
0.6 |
(СН3)3С–Сl |
2.13 |
C6H5F |
1.57 |
СН2=СН–Сl |
1.44 |
C6H5Cl |
1.73 |
|
|
C6H5OH |
1.40 |
1.4 ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ С ОРГАНИЧЕСКИМИ ВЕЩЕСТВАМИ
Ворганической химии, как и в неорганической, химические реакции можно классифицировать по результатам: реакции замещения, присоединения, отщепления, разложения, обмена. Кроме того, существует много специфических реакций, характерных для органических веществ, с которыми мы познакомимся по мере изучения органической химии.
Всовременной органической химии реакции классифицируют по их механизмам. Меха-
низм реакции раскрывает последовательность элементарных актов разрыва и образования химических связей, ведущих к превращению исходного вещества в конечный про-
дукт. Изучить механизм реакции – это значит раскрыть ряд последовательных промежуточных стадий, приводящих к продукту реакции. Знание механизма реакции позволяет ею управлять для получения целевого нужного продукта.
Воснову классификации реакций по механизмам положен тип разрыва ковалентной связи. Возможен двоякий разрыв связей.
1. Гомолитический (греч. homos – равный, одинаковый, общий) разрыв ковалентной
связи. Связующая электронная пара делится пополам между атомами σ-связи:
A |
|
: |
|
B |
|
|
A . + B . |
|
|||
|
|
|
|||||||||
|
|
|
|
|
|||||||
Конкретный пример: |
|
|
|
|
|||||||
H |
|
|
H |
|
|||||||
. . |
|
|
|
|
|
|
|
. . |
. H |
||
H : C |
: |
H |
|
|
|
H : C . + |
|||||
. . |
|
|
|
|
|
|
|
. . |
|
||
H |
|
|
|
H |
|
||||||
метан |
|
|
радикал |
|
|||||||
|
|
|
|
|
|
|
|
|
|
метил |
|
У каждой частицы (атома) или группы атомов остается по одному неспаренному электрону; они называются свободными радикалами. У радикалов отсутствует заряд, они весьма активны, неустойчивы и быстро вступают в дальнейшие превращения. Так, радикалы метил и
атом водорода могут превратиться в устойчивые продукты: |
|
. |
. |
|
|
||||||||
. |
. |
|
|
|
|
. |
. |
|
|
|
|
||
CH3 + CH3 |
|
CH3 |
|
CH3 ; |
CH3 + H |
|
CH4 ; |
H + H |
|
H2 |
|||
|
|
||||||||||||
|
|
|
|
||||||||||
Обычно радикальному разрыву подвергаются неполярные или малополярные ковалентные связи (С−С, С−Н и другие) при высокой температуре, под действием света или радиоактивного излучения.
2. Гетеролитический (греч. heteros – другой, разнородный) разрыв ковалентной связи.
При гетеролитическом разрыве ковалентной связи связующая электронная пара переходит к одному из осколков молекулы, в результате чего образуются катион и анион:
A : B  A+ + B-
A+ + B-
Конкретный пример:
16

.H. |
|
.H. |
+ |
+ |
: I - |
H : C : I |
|
H : C |
|||
|
|
||||
. . |
. . |
|
|
|
|
H |
|
H |
|
|
|
метилиодид |
|
метилкатион |
|
иодиданион |
|
|
|
(карбкатион) |
|
|
|
К гетеролитическому разрыву склонны сильно полярные и легко поляризующиеся связи (Н−О, С−I и другие). Этому способствуют растворители, обладающие большой полярностью.
Образовавшиеся ионы вступают во взаимодействие с частицами, у которых противоположный заряд. Так, метил-катион легко реагирует с частицами, у которых частичный или полный отрицательный заряд (ОН−, CN−, Сl− и другие). Такие частицы называют нуклеофильными реагентами ("любящими ядро").
При гетеролитическом разрыве связей могут образовываться органические анионы (карбанионы):
.H. |
|
.H. |
- |
+ |
Li + |
H : C : Li |
|
H : C |
|||
|
|
||||
. . |
. . |
|
|
|
|
H |
|
H |
|
|
|
метиллитий |
|
метиланион |
катион |
||
|
|
(карбанион) |
лития |
||
Карбанионы неустойчивы, они вступают во взаимодействие с частицами, имеющими полный или частичный положительный заряд (H+, NO2+, SO3Н+ и другие). Такие частицы называют электрофильными реагентами ("любящими электроны").
В органических соединениях можно отметить центры атаки электрофильных и нуклеофильных реагентов. Например:
R |
δ+ |
δ− |
|
|
H − |
δ+ |
|||||
|
C |
|
|
|
O : |
R |
|
C |
δ |
Li |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|||||||
R' |
|
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
||
|
|
|
|
|
|
|
|
|
|
||
электро- |
нуклео- |
нуклео- |
|
электро- |
|||||||
фильный |
фильный |
фильный |
фильный |
||||||||
центр |
|
|
|
|
центр |
центр |
|
центр |
|||
Следует различать неорганические и органические ионы: неорганические ионы, образующиеся в результате диссоциации соли, основания или кислоты, присутствуют в водных растворах до реакции и после нее: органические ионные частицы появляются только в момент реакции. Во многих случаях правильнее вообще говорить не о свободных ионах, а о сильно поляризованных молекулах.
Таким образом, реакции могут протекать по радикальному или ионному механизмам, которые будут рассмотрены в соответствующих главах.
Реакции с органическими веществами имеют такую особенность: в ходе реакции рвется, как правило, одна связь. Эту особенность заметил в прошлом веке Бутлеров и назвал ее принципом наименьшего изменения строения.
1.5 ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Что необходимо для того, чтобы произошла реакция? Во-первых, реагирующие молекулы должны столкнутся, при этом должно выделиться некоторое минимальное количество энергии. Однако их столкновение возможно, если молекулы обладают достаточной энергией. Энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации (Еакт) данной реакции. Молекулы, обладающие такой энергией, называются активными молекулами. Источником избыточной энергии служит кинетическая энергия движущихся частиц. Энергию активации выражают в
17

кДж/моль.
Во-вторых, молекулы (частицы) должны быть ориентированы соответствующим образом. Следовательно, для химической реакции требуется столкновение молекул, обладающих достаточной энергией (Еакт) и соответствующей ориентацией.
Рассмотрим в общем виде течение реакции и изменение при этом энергии. В качестве примера воспользуемся равновесной реакцией
A2 + B2 → 2АВ,
где A2 и В2 – молекулы исходных веществ, состоящие из двух атомов или частиц, АВ – молекулы продукта реакции.
Молекулы A2 и В2, сближаясь, могут вступить в реакцию, если они обладают достаточной для этого энергией. При их сближении создается переходное состояние, или активный комплекс. Для его образования необходимо затратить определенную энергию, которую называют энергией активации.
Рассмотрим вопрос образования переходного состояния. При сближении молекул исходных веществ происходит разрыхление связей А−А и В−В; они как бы растягиваются, но не совсем разрываются, а новая связь А−В начинает только образовываться, но еще полностью не образовалась. Схематично переходное состояние можно изобразить так:
A . . . A
: :
. .
B . . . B
Изменение энергии реакции показано на рисунке 1.6. Горизонтальная ось диаграммы отражает ход реакции, вертикальная ось – потенциальную энергию, кривая описывает изменение потенциальной энергии сталкивающихся молекул.
В начальный период реакции потенциальная энергия реагирующей системы постепенно возрастает от начального значения (Енач), до максимального, отвечающего переходному состоянию, затем потенциальная энергия начинает падать, достигая по завершении реакции значения Екон. Время существования переходного состояния невелико, примерно 10-13с.
Из диаграммы следует, что энергия активации (Еакт) – это ровность между энергией пере-
Рис. 1.6. Изменение энергии в ходе реакции
18
ходного состояния и анергией исходных веществ (Енач) это энергетический барьер для исходных веществ. Разность между энергией исходных веществ и энергией конечных продуктов реакции показывает тепловой эффект реакции.
На рисунке Екон лежит ниже, чем Енач: это соответствует экзотермической реакции, при которой продукт реакции имеет меньший запас энергии, чем исходное вещество (и поэтому более устойчив), а часть энергии выделяется в окружающую среду (обычно в виде теплоты).
Вслучае эндотермической реакции Екон будет находиться выше Енач (конечный продукт богаче энергией по сравнению с начальным); реакция идет с поглощением теплоты, в остальном картина аналогична.
Можно ли уменьшить энергетический барьер образования переходного состояния? Оказывается, это можно сделать, используя катализатор. Влияние катализатора также показано на рисунке 1.6.
Сплошная кривая А обозначает энергетический профиль для реакции без катализатора. Пунктирная линия Б – энергетический профиль реакции с участием катализатора. В присутствии катализатора образуется иной активированный комплекс, и энергия переходного состояния понижается. Барьер может преодолеть большее число частиц, скорость реакции повышается. На рисунке 1.6 видно, что энергия активации прямой и обратной реакции различны, однако как для прямой, гак и для обратной реакций введение катализатора понижает энергию активации на одинаковое значение. Следовательно, катализатор в равной степени ускоряет прямую и обратную реакции. Это значит также, что катализатор не может сместить равновесие обратимой реакции, а может лишь ускорить его установление.
Ворганических молекулах значительную часть занимает углеводородный радикал, который в большинстве случаев в реакции не участвует: столкнувшись своими углеводородными радикалами, органические молекулы в реакцию не вступают. Активная часть органических мо-
лекул – функциональные группы (гидроксил −ОН, карбонил −С=О, карбоксил −СООН и другие), являющиеся реакционными центрами.
Для того чтобы произошла реакция с участием органической молзкулы, реагент должен сблизиться с реакционным центром этой молекулы; при реакциях между двумя органическими молекулами должны сблизиться их реакционные центры. Это значит, что в процессе реакции молекулы должны занять определенное положение, ориентироваться нужным образом, создать переходное состояние.
Для рассмотрения переходного состояния не случайно взята равновесная реакция: в органической химии таких реакций очень много.
Возвратимся снова к понятию о тепловом эффекте. Известно, что каждое вещество характеризуется определенным запасом энергии, которая слагается из кинетической и потенциальной (она обусловлена силами притяжения и отталкивания между частицами). Внутренняя энергия зависит от состояния вещества, оно изменяется в процессе химических реакций и определяется тепловым эффектом. В науке тепловой эффект при постоянном давлении получил название энтальпии и обозначается буквой Н. Изменение энтальпии обозначается ∆Н. Энтальпия является мерой накопления энергии веществом, она изменяется с изменением температуры и давления.
Если энтальпия реагирующих веществ больше, чем у продуктов реакции, то реакция проходит с выделением теплоты, и наоборот. Например, реакция паров воды с углем сопровождается поглощением теплоты в количестве 136 кДж/моль:
Н2О(г) + С(т) = СО(г) + Н2(г) ,
поэтому образующиеся продукты имеют большую энтальпию, чем реагенты:
∆H = (HCO + HH2 ) −(HH2O + HC ) > 0.
Следует обратить внимание на то, что экзотермическим процессам соответствует отрицательное значение изменения энтальпии, а эндотермическим процессам – ее положительное значение, т.е. знак ∆Н противоположен знаку теплового эффекта в термохимических уравнениях. Например, реакция гидратации этилена идет с выделением теплоты в количестве 46 кДж/моль (энтальпия реагирующих веществ больше, чем у продуктов реакции) и может быть выражена так:
19
С2Н4(г) + Н2О(г) С2Н5ОН(ж), ∆Н = -46кДж.
Известно, что образование молекул из атомов можно рассматривать как переход от менее упорядоченной системы (хаотичное движение атомов) в более упорядоченную (образование молекул). Процесс сопровождается выделением энергии, система переходит в состояние с оптимальной потенциальной энергией. Эту тенденцию часто называют энергетическим факто-
ром.
В природе наблюдается два процесса: процесс, когда система стремится к порядку (например, образование молекул), и процесс, когда система стремится к беспорядку. От того, какой процесс берет верх, зависит его направление. Первый процесс определяется энергетическим фактором, второй процесс – энтропийным фактором.
Процессы растворения, диффузии, плавления, кипения, испарения и другие процессы, протекающие с увеличением объема системы, приводят к увеличению беспорядка. Степень беспорядка характеризует величина, называемая энтропией (греч. en+trope – превращение). Ее обозначают буквой S. Чем больше беспорядка в системе, тем выше энтропия (∆S>0). Можно сказать, что энтропия, или энтропийный фактор, показывает стремление системы перейти из упорядоченного состояния в неупорядоченное.
Связь энтропии с энтальпией рассмотрим на примере обратимой реакции.
С2H4(г) + H2(г) С2Н6(г).
Прямая реакция: C2H4 + Н2 → C2H6 сопровождается выделением энергии (∆Н<0). Энтропия системы уменьшается (∆S<0), т.к. в результате реакции из двух молей газов образуется один моль газа. Здесь главную роль играет энергетический фактор.
Протекание обратной реакции: C2H6 → C2H4 + Н2 сопровождается поглощением энергии (∆Н>0); энтропия системы возрастает (∆S>0). В этой реакции главную роль играет энтропийный фактор.
Пользование понятиями энтальпии и энтропии позволяет судить о возможности и направлении реакции, в этом вы убедились, изучая общую и неорганическую химию.
1.6 КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
При классификации органических соединений принимается во внимание их химическое строение (характер углеродного скелета). В соответствии с этим органические соединения делят на ациклические и циклические (греч. а – частица отрицания, например асимметрия).
Ациклические соединения – соединения с открытой цепью углеродных атомов – прямой или разветвленной (в схемах представлены только углеродные атомы):
C
C C C C C C C C
C
По-другому их называют соединениями жирного ряда (жирными их называют потому, что исторически первыми изученными соединениями этого ряда были органические кислоты, входящие в состав жиров).
Циклические соединения делят на алициклические (1) и ароматические (2), у них атомы углерода образуют замкнутые циклы:
20
