
ЦБП
.pdf
Рис. 3.1. Расположение трехгибридных sp2-орбиталей в одной плоскости Рис. 3.2. Схема образования σ-связи в молекуле этилена
Гибридные орбитали принимают одинаковую форму вытянутых объемных восьмерок и расположены в одной плоскости под углом 120° (рис. 3.1). В результате перекрывания орбиталей двух атомов углерода и s-орбиталей атомов водорода образуются σ-связи (рис. 3.2).
У каждого атома углерода остается по одной 2рZ-орбитали, не принявшей участие в гибридизации, и поэтому ее форма не изменилась (объемная восьмерка с равномерным распределением электронной плотности по обе стороны от ядра), 2рZ-орбитали двух атомов углерода, расположенные параллельно друг другу и перпендикулярно плоскости гибридных орбиталей (плоскости σ-связей), частично перекрываются между собой над и под плоскостью σ-связей с образованием новой π (пи)-связи (рис. 3.3).
Перекрывание иногда показывают линиями, соединяющими рZ-орбитали над и под плоскостью σ-связи (рис. 3.4). Воображаемую плоскость π-связи изображают так, как дано на рис. 3.5.
С установлением π-связи ядра атомов углерода несколько стягиваются, поэтому длина двойной связи составляет 0,134 нм.
Шаростержневая и масштабная модели молекул этилена представлены на рис. 3.6.
При образовании σ-связей перекрывание гибридных орбиталей происходит по прямой, соединяющей ядра атомов, поэтому такая связь прочная. π-Связь образуется в результате небольшого бокового перекрывания орбиталей вне плоскости σ-связей, поэтому эта связь менее прочна, чем σ-связь, легко разрывается, подвижна под влиянием заряженных частиц. В целом двойная связь прочнее простой: энергия простой σ-связи С−С – 350 кДж/моль, энергия двойной
Рис. 3.3. Схема образования π-связи в молекуле этилена Рис. 3.4. Изображение перекрывания р-орбиталей линиями
41
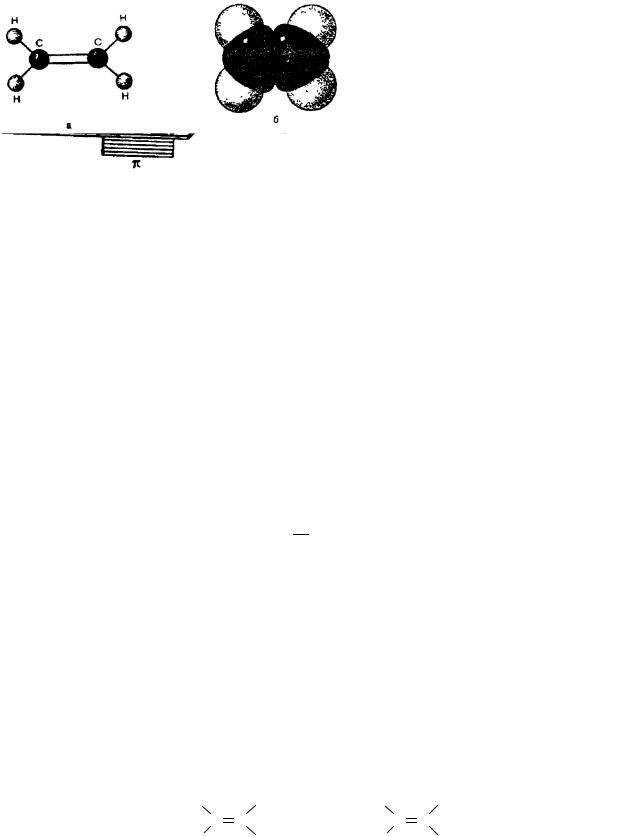
Рис. 3.5. Плоскости π-связи в молекуле этилена Рис. 3.6. Модели молекулы этилена: а – шаростержневая; б – масштабная
связи С=С – 620 кДж/моль. |
|
|
Таким образом, двойная связь |
||
– это сочетание σ- и π-связей, |
||
отличающихся |
своей |
энергией |
(прочностью). |
Это |
следует |
учитывать, когда речь будет идти о |
||
химических свойствах алкенов. |
||
Подобное |
строение |
имеют и |
гомологи этилена. Рассмотрим второе |
||
валентное состояние атома |
углерода Рис. 3.7. Схема σ- и π-связей в молекуле пропилена |
|
на примере пропилена. Обозначим у |
||
каждого атома углерода его валентное |
||
состояние – это важно для соблюдения валентных углов: sp3 sp2 sp2
CH3 CH CH2
CH2
После этого составим схему σ-связей, а затем обозначим π-связь (рис. 3.7).
3.3 ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
Двойная связь обладает большей суммарной прочностью, чем простая σ-связь, и прочнее удерживает атомы углерода: они не могут вращаться. Невозможность вращения атомов вокруг двойной связи – причина образования пространственных изомеров – устойчивых конфигураций, называемых геометрическими, или цис-, транс-изомерами. Рассмотрим это явление на примере бутена-2: СН3–СН=СН–СН3.
Атомы в молекуле могут располагаться в пространстве по-разному, не нарушая последовательности соединения атомов:
CH3 |
CH3 |
CH3 |
H |
C |
C |
C |
C |
H |
H |
H |
CH3 |
|
а) |
|
б) |
В одном случае (а) замещающие группы (метильные радикалы) находятся по одну сторону плоскости π-связи (рис. 3.8 а), это цис-изомер (от лат. cis – по эту сторону); в другом случае (б) замещающие группы находятся по разные стороны плоскости р-связи (рис. 3.8 б), это трансизомер (от лат. trans – через). На рисунке 3.9 представлены модели этих изомеров. Цис-бутен и транс-бутен – разные вещества с устойчивым, фиксированным пространственным расположением атомов (конфигурацией). Они отличаются по свойствам, например, у цис-изомера т. кип.
42

Рис. 3.8. Пространственная изомерия бутена-2: а − цис-изомер; б − транс-изомер
3,7°С, у транс-изомера 0,9°С; температура плавления соответственно – 139°С и – 106°С. Цис-бутен-2 имеет небольшой дипольный момент, у транс-бутена-2 = 0, т.к. метильные
радикалы расположены по разные стороны двойной связи (дипольные моменты связей компенсируют друг друга). Небольшое различие в полярности отражается в более высокой температуре кипения цис-изомера. Цис-изомер менее симметричен, чем трансизомер, поэтому его упаковка в кристаллической решетке менее плотная, что обусловливает, как правило, его более низкую температуру плавления. Такая зависимость между конфигурацией и температурой кипения или плавления наблюдается у многих пар геометрических изомеров (хотя есть исключения). Измерение дипольных моментов часто позволяет определить цисили транс-строение изомера.
Геометрическая изомерия свойственна и производным алкенов, например:
Cl |
Cl |
Cl |
H |
C |
C |
C |
C |
H |
H |
H |
Cl |
цис-1,2-дихлорэтен транс-1,2-дихлорэтен
m = 1,85 D tкип = 60 oС
tпл = - 80 oС
m = 0 D tкип = 48 oС
tпл = - 50 oС
Приведенный пример показывает, что появление в молекулах электроотрицательных атомов (Сl, Вr, I и других) сильно влияет на различие в полярности, температуре кипения и плав-
Рис. 3.9. Шаростержневые и масштабные модели пространственных изомеров бутена-2: а − цис-изомер; б − транс-изомер
43

ления и плавления цис- и транс-изомеров.
Вы, очевидно, обратили внимание на то, что, кроме двойной связи как основной причины существования пространственных изомеров, есть еще одно обязательное условие: у каждого атома углерода при двойной связи не должно быть одинаковых атомов или групп атомов. Например, СlНС=CНCl или СН3НС=СНС2Н5. Не может быть цис-транс-изомеров у веществ, имеющих одинаковые атомы или группы атомов при одном углеродном атоме (гем- соединений), например:
H |
H |
CH3 |
H |
Br |
H |
C |
C |
C |
C |
C |
C |
H |
CH3 |
CH3 |
H |
Br |
CH3 |
Таким образом, рассмотренный вид изомерии обусловлен не различным химическим строением, а различной пространственной конфигурацией молекул.
3.4 ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Сходство в химическом и электронном строении алкенов (наличие π-связи) обусловливает их сходные химические свойства.
1. Для алкенов характерны реакции присоединения за счет разрыва π-связи.
В присутствии катализатора (Ni) и при нагревании этиленовые углеводороды реагируют с водородом с образованием предельных углеводородов, например:
СН2=СН2 + Н2 –→ СН3−СН3.
В результате разрыва π-связи атомы углерода насыщаются атомами водорода до предела, поэтому этилен и его гомологи считаются непредельными (ненасыщенными) углеводородами. Реакцию с водородом называют реакцией гидрирования, или гидрогенизации.
Подсчитаем энергетический баланс (энтальпию) реакции гидрирования этилена по энтальпиям диссоциации связей (энергиям связей) и определим, какая это реакция – экзоили эндотермическая:
H |
|
H |
|
|
|
H |
|
H |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C + H |
|
H |
|
H |
|
C |
|
C |
|
H |
||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
H |
|
H |
||||||||
Разрываются связи: С=С и Н−Н; образуются новые связи: С−С, 2(С−Н). Энтальпия гидрирования равна сумме энергий диссоциации связей реагентов минус сумма энергий диссоциации связей продуктов реакции:
∆Нг = ∆Ндисс (С=С) + ∆Ндисс (Н−Н) − ∆Ндисс (С−С) − 2∆Ндисс (С−Н).
Подставив энергии связей, получаем:
∆Н = 620 + 435 − 350 − 2•415 = -125 кДж/моль.
Следовательно, реакция экзотермическая. Гидрирование в отсутствие катализатора протекает с небольшой скоростью (даже при повышенной температуре), т.к. необходима высокая энергия активации. Катализатор понижает энергию активации (Еакт) настолько, что реакция протекает быстро при умеренных условиях.
Уменьшение энергетического барьера одновременно понижает энергию активации обратной реакции и увеличивает скорость дегидрирования. Катализатор, таким образом, ускоряет реакцию (прямую и обратную), но не сдвигает равновесие.
С точки зрения электронной теории процесс гидрирования заключается в том, что атомы углерода, находящиеся в состоянии sp2-гибридизации (во втором валентном состоянии), переходят в состояние sp3-гибридизации (первое валентное состояние), при этом изменяется пространственное строение исходных молекул:
44

sp3 |
|
sp2 |
sp2 |
|
sp3 |
|
sp3 |
|
sp3 |
|
CH3 |
|
CH |
|
CH2 + H2 |
|
CH3 |
|
CH2 |
|
CH3 |
|
|
|||||||||
|
|
|
||||||||
|
|
|
||||||||
При пропускании этилена или пропилена в бромную воду происходит ее обесцвечивание:
sp2 |
|
sp2 |
|
sp3 |
|
sp3 |
||
CH2 |
|
CH2 + Br2 |
|
|
CH2 |
|
|
CH2 |
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
||||||
|
|
|
|
Br |
|
Br |
||
1,2-дибромэтан
Реакция бромирования (взаимодействия с бромной водой) – качественная реакция для
распознавания алкенов.
Этиленовые углеводороды вступают в реакцию со сложными веществами, например с галогеноводородами:
СН2=СН2 + НВr → СН3−СН2Вr.
бромэтан
Реакция присоединения может протекать между алканами и алкенами. По двойной связи в присутствии катализатора (Н2SО4, АlСl3 и других) присоединяется парафиновый углеводород (преимущественно с третичным атомом углерода):
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
H + CH2 |
|
CH2 |
|
CH3 |
|
C |
|
CH2 |
|
CH3 |
||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
CH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2,2-диметилбутан |
|||||||
Эта реакция называется алкилированием. Она позволяет получать углеводороды разветвленного строения, повышающие качество топлива для двигателей внутреннего сгорания.
2. Молекулы алкенов могут соединяться между собой с образованием длинных цепных молекул (реакция полимеризации). Например, при повышенной температуре и давлении, в присутствии катализатора в реакцию вступают сотни и тысячи молекул этилена по схеме:
СН2=СН2 + СН2=СН2 + СН2=СН2 + ... → −CH2−CH2−СН2−СН2−CH2−CH2− …
При этом разрываются π-связи, за счет которых происходит взаимодействие молекул эти-
лена.
Процесс соединения одинаковых молекул в более крупные молекулы называется ре-
акцией полимеризации, а получающийся продукт – полимером (от греч. poly – много, meres – часть), или высокомолекулярным соединением. Исходное вещество, вступающее в реакцию полимеризации, называется мономером.
Таким образом, из мономера (этилена) получается полимер (полиэтилен), из которого изготовляют различные пластмассовые изделия.
Часто реакцию полимеризации записывают в виде краткой схемы: nСН2=СН2 → (−CН2−СН2−)n.
где п – в левой части схемы показывает, сколько молекул мономера вступило в реакцию, а в правой части – степень полимеризации: −СН2−СН2− – элементарное (или структурное) звено.
Краткая схема реакции полимеризации пропилена выглядит так:
nCH |
|
CH2 |
|
|
|
CH |
|
CH2 |
|
|
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
CH3 |
n |
||||||||||
пропилен |
|
полипропилен |
||||||||||
3. Этилен и его гомологи легко окисляются в результате разрыва π-связи. Если, например, пропускать этилен в раствор перманганата калия (он отдает кислород), то фиолетовая окраска КмnО4 быстро исчезает. Этого не наблюдается у предельных углеводородов.
Обозначив окислитель в виде атома кислорода, можно написать такое уравнение реакции (не для запоминания):
45

CH2 |
|
CH2 + O + H2O |
|
CH2 |
|
CH2 |
|
|
|
OH OH
этиленгликоль
При этом двойная связь разрывается, к освободившимся валентностям присоединяются две ОН-группы.
Реакция окисления часто используется для обнаружения непредельности соединения. При окислении алкенов кислородом воздуха в присутствии серебряного катализатора при
нагревании образуется оксид соответствующего алкена:
2CH2 |
|
CH2 + O2 |
2CH2 CH2 |
|
|||
|
O
этиленоксид
4. Алкены горят. Так, при поджигании на воздухе этилен горит светящимся пламенем:
С2Н4 + 3О2 → 2СО2 + 2Н2О.
Метан, как известно, горит несветящимся пламенем. Характер горения этилена и метана различен потому, что массовая доля углерода в этилене больше, чем в метане. Этиленовые углеводороды с воздухом дают сильно взрывчатые смеси.
3.5МЕХАНИЗМ РЕАКЦИИ ПРИСОЕДИНЕНИЯ. ПРАВИЛО МАРКОВНИКОВА
Реакции присоединения к алкенам протекают чаще всего по ионному механизму; это реакции электрофильного присоединения. Так они названы потому, что повышенная электронная плотность по месту двойной связи способствует воздействию положительно заряженных реагентов, т.е. реагентов, имеющих недостаток электронов, а потом "любящих" место, где они могут этот недостаток компенсировать.
В качестве примера рассмотрим присоединение бромоводорода к этилену. Известно, что молекула бромоводорода – сильно полярное соединение: на атоме водорода имеется частичный положительный заряд, а на атоме брома – частичный отрицательный заряд. При сближении с молекулой этилена положительно заряженный атом водорода вступает во взаимодействие с легко доступными электронами π-связи, отрывается в виде протона от молекулы бромоводорода и присоединяется к тому атому углерода, к которому сместилась пара электронов:
δ+ δ− |
+ H |
H2C CH2 + H : Br |
H2C CH2 + Br- |
Образовалась новая ковалентная связь С−Н. Однако в результате смещения пары электронов к одному из атомов углерода другой атом углерода, лишившись электрона, приобретает положительный заряд, к нему притягивается отрицательно заряженный ион брома, и образуется еще одна ковалентная связь С−Вr:
Н2С+−СН3 + Вr− → Вr−CН2−СН3.
Упрощенно механизм реакции присоединения как бы условно слагается из трех стадий: вначале разрывается связь Н−Вr с образованием неорганических ионов, затем образуется положительно заряженный ион – карбокатион СН3−СН2+ и, наконец, нейтральный продукт реакции.
CH3 |
|
CH2 |
|
CH2 |
+ |
HBr |
|
CH3 |
|
CH2 |
|
|
CH2 |
|
Br |
(1) |
||
|
|
|||||||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
1-бромпропан |
|
|||||||||
CH3 |
|
CH2 |
|
CH2 |
+ |
HBr |
|
CH3 |
|
|
CH |
|
|
CH3 |
(2) |
|||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
2-бромпропан |
|
|||||||||
46

Владимир Васильевич МАРКОВНИКОВ (1838−1904) – профессор Московского университета,
ученик Бутлерова и продолжатель его работ. Синтезировал несколько соединений, предсказанных теорией химического строения. Широко развил идеи Бутлерова о взаимном влиянии атомов в молекулах, установив ряд закономерностей в этой области. Много внимания уделял изучению природных богатств России, особенно исследованию нефтяных месторождений. Открыл в составе кавказских нефтей новый класс углеводородовнафтены (циклопарафины) и обстоятельно изучил
эти соединения. Исследовал состав соляных озер и минеральных источников России.
По такому же механизму происходит присоединение галогеноводорода к гомологам этилена, например к пропилену. Присоединяться галогеноводород к пропилену может по-разному:
Какая реакция преимущественная? Русский химик В.В. Марковников экспериментально доказал, что преимущественно идет реакция (2).
Он вывел закономерность, известную как прявило Марковникова. По этому правилу водород галогеноводорода (воды или других веществ, содержащих водород) присоединяется к наиболее гидрироваиному (т.е. связанному с наибольшим числом атомов водорода) углеродному атому при двойной связи. Это правило применяется к несимметричным гомологам этилена.
Правило Марковникова получило в наше время электронное истолкование. Молекула пропилена по сравнению с этиленом несимметрична из-за присутствия радикала метила СН3. Под его влиянием молекула пропилена становится частично поляризована. Рассмотрим подробнее этот вопрос.
Связи С−Н в метильном радикале слабо поляризованы из-за различной электроотрицательности атомов: электронная плотность оттянута от атомов водорода к атому углерода. на котором скапливается частичный отрицательный заряд. Под его влиянием происходит сдвиг электронной плотности к центральному атому углерода, что в свою очередь вызывает сильное смещение подвижных электронов р-связи. Такое смещение электронной плотности приводит к тому, что на углероде СН3-группы будет частичный отрицательный заряд, а на углероде СНгруппы – частичный положительный завял.
H |
+ |
− |
|
δ |
δ |
H C |
CH |
CH2 |
H |
|
|
Таким образом, поляризация двойной связи наблюдается уже в исходных, не вступивших в реакцию молекулах пропилена.
Теперь можно описать механизм реакции присоединения бромоводорода к пропилену:
|
|
|
δ+ |
|
|
δ− |
δ+ δ− |
|
|
|
|
+ |
|
|
|
CH3 + Br-, |
||||
CH3 |
|
CH |
|
|
CH2 + H : Br |
|
|
CH3 |
|
|
CH |
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
CH3 |
|
+ |
|
|
|
|
+ Br- |
|
|
|
CH3 |
|
|
CH |
|
|
CH3 |
|||
|
|
CH |
|
|
CH3 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||||||
Br
Частично поляризует двойную связь не только метильный радикал, то же самое происходит и в случае других углеводородных радикалов: этила С2H5−, пропила С3Н7− и др.
Механизм реакции зависит от создаваемых условий. Например, хлорирование пропилена в растворе тетрахлорметана при низкой температуре проходит по ионному механизму:
СН3−СН=СН2 + Сl2 → СН3−СНСl−СН2Сl.
1,2-дихлорпропан
47

Хлорирование пропилена в газовой фазе при температуре 500−600°С проходит по свобод- но-радикальному механизму:
СН3−СН=СН2 + Сl2 → CH2Cl−СН=СН2 + НСl.
3-хлорпропен-1
Нужно различать правило Марковникова и механизм реакции присоединения. Правило указывает лишь на основное направление реакции, а механизм реакции присоединения раскрывает отдельные стадии превращения, в частности образование органического иона.
По месту двойной связи могут присоединяться не только неорганические реагенты, но и органические молекулы. Например, реакция димеризации изобутилена, открытая А.М. Бутлеровым, протекает по ионному механизму в присутствии серной кислоты. Кислота – это катализатор, поставщик протонов. К π-электронам двойной связи молекулы изобутилена присоединяется протон и образуется катион (I). Последний присоединяется к π-связи другой молекулы изобутилена с образованием более сложного катиона (II). Реакция проходит как бы ступенчато. Сложный катион приобретает устойчивость, отдавая протон, в результате образуется смесь двух непредельных изомеров.
|
|
|
|
|
|
|
|
+H+ |
|
|
|
|
|
|
|
|
CH3 |
|
|
(CH3)2C |
|
CH2 |
|
|
|
|
|
|
CH3 |
CH3 |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH3 |
|
C |
|
CH2 |
|
|
CH3 |
|
|
C+ |
|
CH3 |
|
C |
|
|
CH2 |
|
C |
|
CH3 |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
-H |
|||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
|
CH2 |
|
C |
|
CH3 |
|
C |
|
CH |
|
|
C |
|
CH3 |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
-H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
CH3 |
CH3 |
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80% |
|
|
|
|
|
|
|
|
|
20% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
При каталитическом гидрировании оба изомера превращаются в предельный углеводород
– изооктан, широко применяемый в качестве высокооктанового моторного топлива.
3.6 ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ АЛКЕНОВ
Алкены из-за их высокой реакционной способности – ценное сырье в органическом син-
тезе.
Этилен и пропилен широко используются для получения полимеров – полиэтилена, полипропилена, идущих на изготовление пластмассовых изделий, синтетических волокон (полипропиленовое волокно) и каучуков.
Этилен широко используется в производстве этилового спирта:
C2H4 + Н2O → С2Н5ОН.
Взаимодействием этилена с хлором получают 1,2-дихлорэтан:
CH2=CH2 + Cl2 → CIH2C−CH2CI.
Дихлорэтан – бесцветная летучая жидкость со специфическим запахом, плохо горит, пары ядовиты. Хороший растворитель жиров, смол, воска и т. п. Токсичные свойства дихлорэтана используются в сельском хозяйстве для борьбы с филлоксерой на виноградниках, а также для обеззараживания зернохранилищ.
Основной способ получения хлорэтана – реакция между этиленом и хлороводородом:
СН2=СН2 + НСl → СН3−СН2Сl.
Хлорэтан – бесцветный газ (при нормальных условиях), кипит при 12°С. При небольшом охлаждении превращается в жидкость, которая при обычной температуре легко испаряется, по-
48

глощая большое количество теплоты. Это свойство используется в медицине при мелких хирургических операциях, когда требуется местная анестезия: капли этой жидкости, попадая на кожу, быстро испаряются и сильно охлаждают место оперирования.
Этилен обладает интересным свойством – в его атмосфере ускоряется созревание плодов.
Пропилен используется для синтеза глицерина, спирта и других веществ. Исходя из бутена-1 получают синтетический каучук.
Рис. 3.10. Получение этилена из этилового спирта В связи с тем, что алкены химиче- ски весьма активны, они не встречаются
в природе. Их получают в промышленности при переработке нефтепродуктов путем высокотемпературного разложения, дегидрированием (отщеплением водорода) предельных углеводо-
родов. Так, при высокой температуре (пиролизе) из этана получают этилен:
H H
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 + H2 |
H |
|
C |
|
C |
|
H |
|
CH2 |
|
|||||
|
|
|||||||||||||
|
|
|
|
|||||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H H
Изобутилен, или 2-метилпропен, получают каталитическим дегидрированием изобутана при нагревании:
CH3 |
|
CH |
|
CH3 |
|
CH3 |
|
C |
|
CH2 + H2 |
||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
||||||||||
Он используется для получения каучука, спирта и т.д. Реакции гидрирования и дегидрирования – взаимопротивоположные реакции, причем первая реакция протекает с выделением теплоты (экзотермическая), вторая – с поглощением теплоты (эндотермическая). Эти две реакции выражаются схемой:
|
|
|
|
-H+ |
|||
CH3 |
|
CH3 |
|
|
CH2 |
|
CH2 |
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
+H+ |
|||
В лаборатории алкены можно получить из спиртов. Так, из этилового спирта при нагревании с серной кислотой (она отнимает элементы воды) получается этилен (рис. 3.10.):
C2H5OH → С2Н4 + Н2O.
Алкены также можно получить из их галогенопроизводных при нагревании со спиртовым раствором щелочи. Например:
CH3 |
|
CH |
|
|
CH2 + KOH |
|
CH3 |
|
CH |
|
CH2 + KCl + H2O |
|||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
Cl |
|
|
|
|
|
|
||
3.7 ГАЛОГЕНОПРОИЗВОДНЫЕ АЛКЕНОВ. СОПРЯЖЕНИЕ
Простейшее монохлорпроизводное этилена – хлорвинил или винилхлорид.
Химические свойства галогенопроизводных зависят от взаимного влияния галогена и двойной связи, от положения галогена относительно двойной связи. При соседстве галогена и двойной связи, как, например, в хлорвиниле, галоген отличается малой реакционной способно-
49

стью. Для лучшего понимания сравним некоторые физические данные хлорэтана СН3−СН2−Cl и хлорвинила СН2=СН−Сl: дипольный момент первого µ=2,05, второго µ=1,44; длина связи C−Cl равна 0,177 и 0,169 нм соответственно, т.е. атом хлора в хлорвиниле находится ближе к атому углерода, чем в хлорэтане.
Особенности строения молекулы хлорвинила характеризуются взаимодействием между подвижными π-электронами двойной связи и неподеленной электронной парой атома хлора (не занятой в химической связи). Такое взаимодействие называется сопряжением, или мезомерным эффектом. В молекуле хлорвинила электронная пара хлора смещена в сторону винильного радикала, образуя общую электронную систему с π-электронами двойной связи:
δ+. . |
δ− |
|
:Cl CH |
CH |
2 |
. . |
|
В результате этого на атоме хлора будет частичный положительный заряд, а на крайнем атоме углерода – частичный отрицательный заряд. Связь C−Cl частично имеет характер двойной связи. Это приводит к уменьшению ее длины.
Часто такое сопряжение показывают пунктиром между атомами:
δ+ |
|
δ− |
||
Cl |
|
CH |
|
CH2 |
|
|
|||
Данная запись показывает некоторое выравнивание связей. Частичная двоесвязность повышает энергию связи C−Cl, поэтому галоген труднее оторвать. Понижается его реакционноспособность и из-за уменьшения дипольного момента, т.е. меньшей полярности связи С−Сl.
Нам известно, что атом хлора проявляет также отрицательный индукционный эффект: как элемент электроотрицательный, он оттягивает на себя s-электроны соседних связей. Таким образом, мезомерный и индукционный эффекты хлора действуют в противоположных направлениях.
Различие между индукционным и мезомерным эффектами прежде всего в том, что первый передается по цепи σ-связей и заключается в том, что заряд электроотрицательного атома вызывает поляризацию этих связей, при этом нет перехода электронной пары во владение другого атома. Мезомерный эффект – передаче взаимного влияния в единой системе подвижных π- электронов, охватывающей несколько связей. При проявлении мезомерного эффекта под-
вижные электроны могут переходить из октета одного атома в октет другого.
В случае, если галоген находится у соседнего с двойной связью углеродного атома, как, например, в аллилхлориде CH2=CH−CH2Cl, реакционноспособность его, наоборот, повышена по сравнению с предельными галогенопроизводными. Реакции аллилхлорида наиболее часто идут через аллил-катион, образующийся при гетеролитическом разрыве связи:
CH2  CH CH2 Cl
CH CH2 Cl 
 CH2
CH2  CH CH2+ + Cl-
CH CH2+ + Cl-
Положительный заряд на атоме углерода гасится сдвигом электронов двойной связи. Это снижает энергию аллил-катиона и увеличивает вероятность его образования. Истинная структура аллил-катиона нечто среднее между двумя структурами:
CH2  CH CH2+
CH CH2+ 
 +CH2 CH
+CH2 CH  CH2
CH2
и его можно записать так:
1/2+ 1/2+
CH2  CH
CH 

 CH2
CH2
По мере удаления галогена от двойной связи уменьшается взаимодействие между ними. В соединении строения СН2=СН−СН2−СН2Сl (4-хлорбутен-1) галоген по своим свойствам не отличается от предельных галогенопроизводных, а двойная связь имеет обычные свойства этиленовой двойной связи.
Из галогенопроизводных наибольшее значение имеет винилхлорид, вступающий в реакцию полимеризации с образованием полимера:
50
