
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
Ответ.
По химическому строению пиридин
(Азин)
можно рассматривать как аналог бензола,
в молекуле которого группа —СН= замещена
атомом азота. Азинами называют шестичленные
гетероароматические азотсодержащие
соединения, которые содержат в цикле
хотя бы один пиридиновый атом азота, а
также би- и полициклические системы на
основе азинового цикла. Пиридин
— бесцветная жидкость с характерным
неприятным запахом (т. кип. 115), смешивающаяся
с водой, этанолом и большинством
органических растворителей. Является
гетероароматическим соединением,
содержащим циклическую шести-π-электронную
сопряженную систему. Неподеленная пара
электронов атома азота не участвует в
образовании ароматического секстета
и обусловливает основные свойства
пиридина. в отличие от бензола, в молекуле
пиридина электронная плотность
распределена неравномерно. Пиридин
является π-дефицитной гетероароматической
системой. Влияние атома азота на
электронную плотность пиридинового
ядра сравнимо с влиянием нитрогруппы
на бензольное кольцо в молекуле
нитробензола. Пиридин является слабым
основанием.
Основность пиридина (рKвн+ = 5,25) близка
к основности анилина (рKвн+ = 4,6). Водные
растворы пиридина окрашивают красную
лакмусовую бумагу в синий цвет. При
взаимодействии с сильными минеральными
и органическими кислотами (хлороводородная,
бромоводородная, серная, пикриновая и
др.) пиридин образует хорошо кристаллизующиеся
пиридиниевые соли:
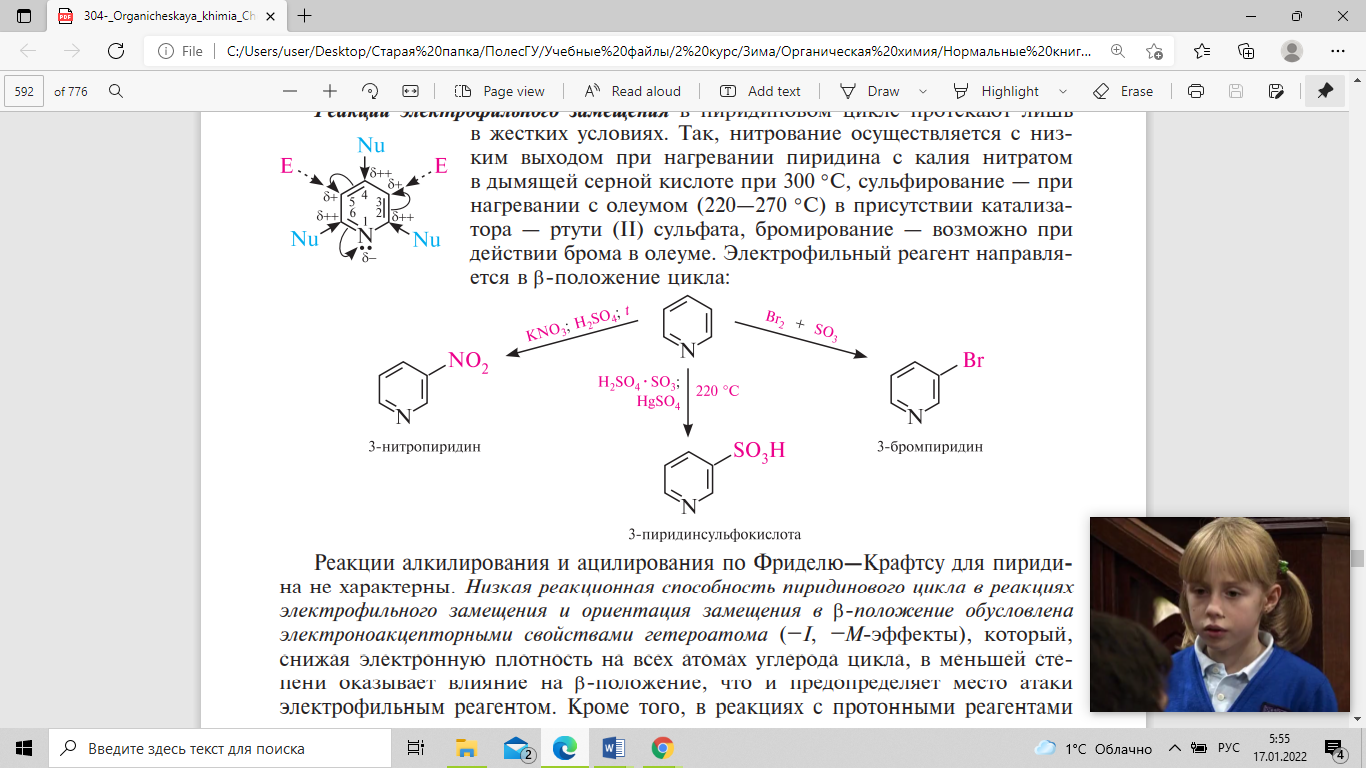
 Реакции
электрофильного
замещения в пиридиновом цикле протекают
лишь в жестких условиях. Так, нитрование
осуществляется с низким выходом при
нагревании пиридина с калия нитратом
в дымящей серной кислоте при 300С,
сульфирование — при нагревании с олеумом
(220—270С) в присутствии катализатора —
ртути (ІІ) сульфата, бромирование —
возможно при действии брома в олеуме.
Электрофильный реагент направляется
в β-положение цикла:
Реакции
электрофильного
замещения в пиридиновом цикле протекают
лишь в жестких условиях. Так, нитрование
осуществляется с низким выходом при
нагревании пиридина с калия нитратом
в дымящей серной кислоте при 300С,
сульфирование — при нагревании с олеумом
(220—270С) в присутствии катализатора —
ртути (ІІ) сульфата, бромирование —
возможно при действии брома в олеуме.
Электрофильный реагент направляется
в β-положение цикла:
 Реакции
алкилирования и ацилирования по
Фриделю—Крафтсу для пиридина не
характерны. Низкая реакционная способность
пиридинового цикла в реакциях
электрофильного замещения и ориентация
замещения в β-положение обусловлена
электроноакцепторными свойствами
гетероатома (–I, –M-эффекты), который,
снижая электронную плотность на всех
атомах углерода цикла, в меньшей степени
оказывает влияние на β-положение, что
и предопределяет место атаки электрофильным
реагентом. Кроме того, в реакциях с
протонными реагентами (нитрование,
сульфирование) пиридин образует по
гетероатому соли пиридиния, а с галогенами
— донорно-акцепторные комплексы, в
которых на атоме азота появляется
положительный заряд, а это, в свою
очередь, приводит к еще большей
дезактивации пиридинового цикла.
Пиридин-N-оксид,
в отличие от пиридина, более активен в
реакциях электрофильного замещения.
Это обусловлено некоторым электронодонорным
эффектом атома кислорода. на атомах
углерода в α- и γ-положениях молекулы
пиридин-N-оксида в результате смещения
электронной плотности от атома кислорода
в кольцо электронная плотность повышена
в сравнении с пиридином. Так, пиридин-N-оксид
вступает в реакцию нитрования гораздо
легче, чем пиридин. При нитровании
азотной кислотой или калия нитратом в
серной кислоте с высоким выходом
образуется 4-нитропиридин-N-оксид.
Реакции
алкилирования и ацилирования по
Фриделю—Крафтсу для пиридина не
характерны. Низкая реакционная способность
пиридинового цикла в реакциях
электрофильного замещения и ориентация
замещения в β-положение обусловлена
электроноакцепторными свойствами
гетероатома (–I, –M-эффекты), который,
снижая электронную плотность на всех
атомах углерода цикла, в меньшей степени
оказывает влияние на β-положение, что
и предопределяет место атаки электрофильным
реагентом. Кроме того, в реакциях с
протонными реагентами (нитрование,
сульфирование) пиридин образует по
гетероатому соли пиридиния, а с галогенами
— донорно-акцепторные комплексы, в
которых на атоме азота появляется
положительный заряд, а это, в свою
очередь, приводит к еще большей
дезактивации пиридинового цикла.
Пиридин-N-оксид,
в отличие от пиридина, более активен в
реакциях электрофильного замещения.
Это обусловлено некоторым электронодонорным
эффектом атома кислорода. на атомах
углерода в α- и γ-положениях молекулы
пиридин-N-оксида в результате смещения
электронной плотности от атома кислорода
в кольцо электронная плотность повышена
в сравнении с пиридином. Так, пиридин-N-оксид
вступает в реакцию нитрования гораздо
легче, чем пиридин. При нитровании
азотной кислотой или калия нитратом в
серной кислоте с высоким выходом
образуется 4-нитропиридин-N-оксид.
 Многие
производные гидроксипиридинов применяются
в медицине. Представителем этой группы
соединений является пиридоксин (витамин
В6),
содержится в неочищенных зернах злаков,
в овощах, мясе, рыбе, молоке, яичном
желтке и др, играет важную роль в обмене
веществ. В организме пиридоксин
превращается в пиридоксаль-5-фосфат,
который с некоторыми белками образует
пиридоксалевые ферменты, осуществляющие
декарбоксилирование и переаминирование
аминокислот. Применяется пиридоксин в
виде соли с хлороводородной кислотой
при в6-гиповитаминозе, токсикозах,
анемиях, лейкопениях и заболеваниях
нервной системы. Пиридинкарбоновые
кислоты находят широкое применение в
синтезе ЛС. Так, никотиновая кислота и
ее амид (никотинамид) известны в
медицинской практике как две формы
витамина РР (кислота является провитамином,
а амид — витамином РР). При недостатке
витамина РР в организме развивается
заболевание кожи — пеллагра. суточная
потребность человека в никотиновой
кислоте составляет 20—30 мг и удовлетворяется
в основном за счет пищевых продуктов —
молока, рыбы, овощей, фруктов, гречневой
крупы и др. На основе производных
изоникотиновой кислоты созданы
лекарственные препараты (изониазид,
фтивазид), которые применяют при лечении
туберкулеза. Хинолин
(бензо[b]пиридин) представляет собой
конденсированную гетероциклическую
систему, состоящую из пиридинового и
бензольного колец. Бесцветная жидкость
с весьма неприятным запахом (т. кип.
237), хорошо смешивается с водой, этанолом,
диэтиловым эфиром и другими органическими
растворителями, перегоняется с водяным
паром. Молекула имеет плоское строение
и содержит замкнутую сопряженную
π-электронную систему из 10 π-электронов,
что соответствует правилу Хюккеля. По
химическим свойствам хинолин напоминает
пиридин. Как основание хинолин немного
слабее пиридина (рKвн+ хинолина — 4,94;
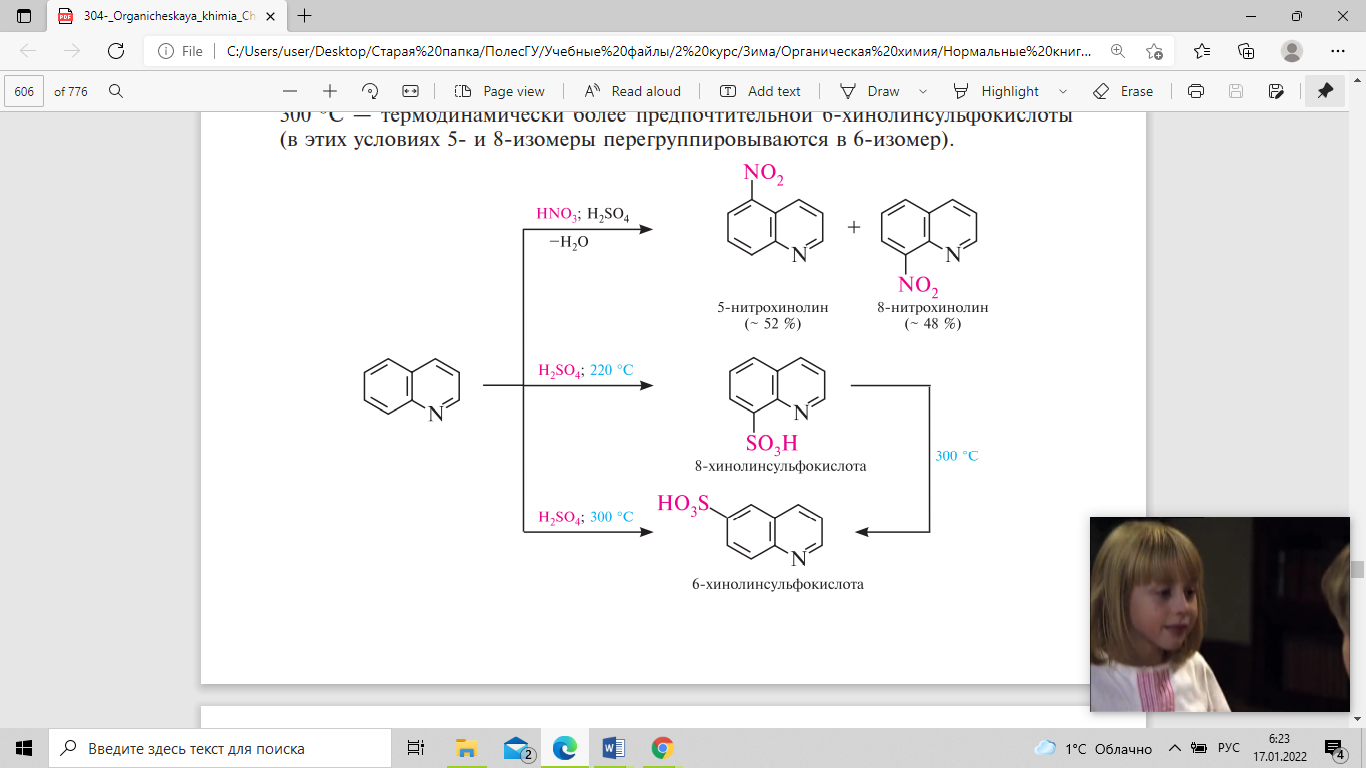
рKвн+ пиридина в H2O — 5,25). Реакции
электрофильного замещения в молекуле
хинолина протекают преимущественно в
положениях 5 и 8. Так, при нитровании
нитрующей смесью образуется смесь 5- и
8-нитрохинолинов, сульфирование
концентрированной серной кислотой при
220С приводит к образованию
8-хинолинсульфокислоты, а при 300С —
термодинамически более предпочтительной
6-хинолинсульфокислоты (в этих условиях
5- и 8-изомеры перегруппировываются в
6-изомер).
Многие
производные гидроксипиридинов применяются
в медицине. Представителем этой группы
соединений является пиридоксин (витамин
В6),
содержится в неочищенных зернах злаков,
в овощах, мясе, рыбе, молоке, яичном
желтке и др, играет важную роль в обмене
веществ. В организме пиридоксин
превращается в пиридоксаль-5-фосфат,
который с некоторыми белками образует
пиридоксалевые ферменты, осуществляющие
декарбоксилирование и переаминирование
аминокислот. Применяется пиридоксин в
виде соли с хлороводородной кислотой
при в6-гиповитаминозе, токсикозах,
анемиях, лейкопениях и заболеваниях
нервной системы. Пиридинкарбоновые
кислоты находят широкое применение в
синтезе ЛС. Так, никотиновая кислота и
ее амид (никотинамид) известны в
медицинской практике как две формы
витамина РР (кислота является провитамином,
а амид — витамином РР). При недостатке
витамина РР в организме развивается
заболевание кожи — пеллагра. суточная
потребность человека в никотиновой
кислоте составляет 20—30 мг и удовлетворяется
в основном за счет пищевых продуктов —
молока, рыбы, овощей, фруктов, гречневой
крупы и др. На основе производных
изоникотиновой кислоты созданы
лекарственные препараты (изониазид,
фтивазид), которые применяют при лечении
туберкулеза. Хинолин
(бензо[b]пиридин) представляет собой
конденсированную гетероциклическую
систему, состоящую из пиридинового и
бензольного колец. Бесцветная жидкость
с весьма неприятным запахом (т. кип.
237), хорошо смешивается с водой, этанолом,
диэтиловым эфиром и другими органическими
растворителями, перегоняется с водяным
паром. Молекула имеет плоское строение
и содержит замкнутую сопряженную
π-электронную систему из 10 π-электронов,
что соответствует правилу Хюккеля. По
химическим свойствам хинолин напоминает
пиридин. Как основание хинолин немного
слабее пиридина (рKвн+ хинолина — 4,94;
рKвн+ пиридина в H2O — 5,25). Реакции
электрофильного замещения в молекуле
хинолина протекают преимущественно в
положениях 5 и 8. Так, при нитровании
нитрующей смесью образуется смесь 5- и
8-нитрохинолинов, сульфирование
концентрированной серной кислотой при
220С приводит к образованию
8-хинолинсульфокислоты, а при 300С —
термодинамически более предпочтительной
6-хинолинсульфокислоты (в этих условиях
5- и 8-изомеры перегруппировываются в
6-изомер).
 8-гидроксихинолин
образует малорастворимые в воде комплексы
(хелаты). Ряд производных 8-гидроксихинолина
применяют в медицинской практике в
качестве противомикробных средств
(хинозол, нитроксолин (5-нок) и др.).
Изохинолин
(бензо[c]пиридин) является изомером
хинолина. Молекула изохинолина, как и
хинолина, состоит из конденсированных
пиридинового и бензольного циклов, но,
в отличие от хинолина, циклы соединены
по связи С-3—C-4 пиридинового кольца.
Изохинолин — бесцветное кристаллическое
вещество (т. пл. 24,6), растворимое в воде,
этаноле, диэтиловом эфире, хлороформе
и бензоле. По химическим свойствам
изохинолин мало отличается от хинолина.за
счет гетероатома изохинолин проявляет
основные и нуклеофильные свойства и
легко образует соли с кислотами, алкил-
и ацилгалогенидами. Как основание
изохинолин немного сильнее хинолина
(рKвн+ изохинолина в Н2О — 5,14; рKвн+ хинолина
— 4,94). Реакции электрофильного замещения
в изохинолиновом цикле подобны
хинолиновому и протекают главным образом
в положениях 5 и 8.
8-гидроксихинолин
образует малорастворимые в воде комплексы
(хелаты). Ряд производных 8-гидроксихинолина
применяют в медицинской практике в
качестве противомикробных средств
(хинозол, нитроксолин (5-нок) и др.).
Изохинолин
(бензо[c]пиридин) является изомером
хинолина. Молекула изохинолина, как и
хинолина, состоит из конденсированных
пиридинового и бензольного циклов, но,
в отличие от хинолина, циклы соединены
по связи С-3—C-4 пиридинового кольца.
Изохинолин — бесцветное кристаллическое
вещество (т. пл. 24,6), растворимое в воде,
этаноле, диэтиловом эфире, хлороформе
и бензоле. По химическим свойствам
изохинолин мало отличается от хинолина.за
счет гетероатома изохинолин проявляет
основные и нуклеофильные свойства и
легко образует соли с кислотами, алкил-
и ацилгалогенидами. Как основание
изохинолин немного сильнее хинолина
(рKвн+ изохинолина в Н2О — 5,14; рKвн+ хинолина
— 4,94). Реакции электрофильного замещения
в изохинолиновом цикле подобны
хинолиновому и протекают главным образом
в положениях 5 и 8.
 Ядро
изохинолина является структурным
фрагментом молекул алкалоидов
изохинолинового ряда — папаверина,
морфина, кодеина и др.
Ядро
изохинолина является структурным
фрагментом молекул алкалоидов
изохинолинового ряда — папаверина,
морфина, кодеина и др.
