
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
69. Классификация углеводов. Биологическая роль и распространенность углеводов.
Ответ. Термин «углеводы» предложен в 1844 году русским химиком Шмидтом на основании данных элементного состава первых представителей этого класса соединений, так как было установлено, что их молекулы состоят из атомов углерода, водорода и кислорода, причем соотношение атомов водорода и кислорода такое же, как в молекуле воды [Cx(H2O)y]. Углеводы (сахара, карбогидраты) — обширная группа природных и синтетических соединений, являющихся по химическому строению полигидроксильными веществами, содержащими альдегидную или кетонную группы, или образующие их в результате гидролиза. Углеводы (сахара) составляют основную массу органических веществ нашей планеты. В растительном и животном мире они широко распространены главным образом в виде различных производных и значительно реже — в свободном виде. Углеводы, выполняя различные жизненно важные функции, служат исходным материалом для биосинтеза многих органических соединений живых организмов. В природе углеводы образуются в результате фотосинтеза, осуществляемого растениями с участием углерода (IV) оксида, воды и поглощающих солнечный свет пигментов (хлорофилл и др.). Для растений одни виды углеводов служат строительным материалом, выполняя опорную функцию (целлюлоза), другие — источником резервной энергии (крахмал, инулин). для человека и животных углеводы являются продуктами питания с высокой энергетической ценностью. в организме крахмал, дисахариды, а в некоторых случаях и целлюлоза под влиянием ферментов распадаются с образованием в основном глюкозы, которая окисляется в тканях до углерода (IV) оксида и воды с выделением энергии. избыток глюкозы превращается в гликоген, запасаемый в печени и мышцах. Гликоген снабжает организм глюкозой при выполнении физических нагрузок, а также при недостатке или отсутствии пищи. Углеводы входят в состав гликолипидов, гликопротеидов, нуклеотидов, нуклеозидов и нуклеиновых кислот, составляющих, как известно, основу живой материи. Углеводы составляют сырьевую базу для текстильной, целлюлозно-бумажной, пищевой, деревообрабатывающей и других отраслей промышленности. Углеводы делят на простые и сложные в зависимости от количества моносахаридных единиц, связанных в молекулу. Простые углеводы, или моносахариды (монозы), не способны гидролизоваться. Сложные углеводы при гидролизе образуют моносахариды. Сложные углеводы, в свою очередь, хотя и условно, подразделяют на олигосахариды, образующие при гидролизе от двух до десяти молекул моносахаридов, и полисахариды (полиозы), гидролизующиеся с образованием более десяти молекул моносахаридов.
70. Моносахариды (рибоза, дезоксирибоза, глюкоза, фруктоза). Стереохимия моносахаридов, D- и L-ряды. Кольчато-цепная таутомерия. Пиранозные и фуранозные формы. α- и β-аномеры. Мутаротация. Эпимеризация.
Ответ.
Моносахариды
(монозы) — полигидроксильные соединения,
содержащие альдегидную или кетонную
группы. Моносахариды, за исключением
глюкозы и фруктозы, редко встречаются
в природе в свободном виде, в основном
они входят в состав олиго- и полисахаридов,
гликозидов, гликолипидов, нуклеозидов
и других высокомолекулярных соединений.
Молекулы моносахаридов содержат
несколько асимметрических атомов
углерода и поэтому существуют в виде
различных пространственных изомеров.
Альдопентоза имеет три асимметрических
атома углерода, а следовательно, одной
и той же структурной формуле соответствует
восемь стереоизомеров (23),
альдогексоза содержит четыре
асимметрических углеродных атома и
может существовать в виде 16 стереоизомеров
(24)
(N = 2n,
где n — количество асимметрических
атомов углерода). Изомеры моносахаридов
подразделяют на D- и L-стереохимические
ряды, принадлежность к которым определяется
по конфигурации асимметрического атома
углерода, максимально удаленного от
карбонильной группы (для пентоз — с-4,
для гексоз — с-5). Если конфигурация
этого хирального атома углерода совпадает
с конфигурацией D-глицеринового альдегида,
то моносахарид относят к D-ряду, если же
с конфигурацией L-глицеринового альдегида
— то к L-ряду:
 Представители
D-ряда являются оптическими антиподами
L-ряда, то есть альдогексоза существует
в виде восьми пар энантиомеров. D-Глюкоза
и L-глюкоза являются энантиомерами,
большинство природных моносахаридов
относится к D-ряду. Пространственные
изомеры моносахаридов, отличающиеся
конфигурацией одного или нескольких
атомов углерода и не являющиеся
зеркальными изомерами (энантиомерами),
называются диастереомерами. так,
D-глюкоза и D-галактоза, D-манноза и
D-глюкоза, D-манноза и D-галактоза составляют
пары диастереомеров. Моносахариды
обладают оптической активностью.
Вращение плоскости поляризованного
света вправо обозначают знаком (+), а
влево — знаком (–). Однако следует
помнить, что направление вращения
определяется экспериментально и никаким
образом не связано с конфигурацией, то
есть принадлежностью к D- или L-ряду. так,
встречающаяся в природе форма D-глюкозы
является правовращающей, а природная
форма D-фруктозы — левовращающей.
Моносахариды, являясь полигидроксиальдегидами
или полигидроксикетонами, образуют
циклические полуацетали в результате
внутримолекулярного взаимодействия
карбонильной и пространственно сближенной
с ней спиртовой групп. Причем, в
соответствии с теорией напряжения
циклов, наиболее благоприятно
взаимодействие, если оно приводит к
образованию пяти- или шестичленных
циклов. При взаимодействии оксогруппы
с гидроксильной группой при с-5 альдогексоз
или с-6 кетогексоз образуется пиранозный
шестичленный цикл (от названия
шестичленного гетероцикла пиран +
окончание -оза). При взаимодействии
оксогруппы с гидроксильной группой при
с-4 альдогексоз или с-5 кетогексоз
образуется фуранозный
пятичленный цикл (от названия пятичленного
гетероцикла фуран + окончание -оза).
Аномеры
— диастереомеры, отличающиеся
конфигурацией аномерного атома углерода.
У альфа-аномера расположение полуацетального
гидроксила такое же, как гидроксила
«концевого» хирального центра
(асимметрического атома углерода,
определяющего принадлежность к D- или
L-ряду). Таким образом, в проекционных
формулах моносахаридов D-ряда гликозидный
гидроксил у альфа-аномера расположен
справа от вертикальной линии углеродной
цепи, а у бета-аномера — слева. Моносахариды
являются таутомерными
веществами, в кристаллическом состоянии
они имеют циклическое строение. так,
D-глюкоза, полученная дробной кристаллизацией
из этилового спирта или воды, находится
в форме альфа-D-глюкопиранозы. в водном
растворе циклическая форма под влиянием
растворителя превращается через открытую
оксоформу в другие циклические формы
— пиранозные и фуранозные с альфа- и
бета-конфигурацией аномерного центра.
Таким образом, в водном растворе
моносахариды существуют в виде пяти
таутомерных форм — открытой, альфа- и
бета-пиранозных и альфа- и бета-фуранозных.
Такой вид таутомерии называется
кольчато-цепной, или цикло-оксо-таутомерией.
Cпособность моносахаридов к
цикло-оксо-таутомерии объясняет
выявленное задолго до установления их
строения явление мутаротации
— самопроизвольного изменения величины
оптического вращения свежеприготовленных
растворов оптически активных соединений.
В свежеприготовленном водном растворе
глюкозы наблюдается уменьшение угла
оптического вращения с +112,2° до установления
постоянного значения +52,5°, химической
основой этого процесса является
цикло-оксо-таутомерия. В разбавленных
растворах щелочей при комнатной
температуре моносахариды подвергаются
изомеризации с образованием равновесной
смеси моноз, различающихся конфигурацией
углеродных атомов C-1 и с-2. так, D-глюкоза,
выдержанная в растворе натрия гидроксида
(8•10–3)
при 35 °с в течение 4 суток, превращается
в смесь, состоящую из D-фруктозы (~ 28 %),
D-маннозы (~ 3 %) и D-глюкозы (~ 69 %). аналогичная
изомеризация наблюдается у кетоз
(фруктозы). Изомерные превращения
моносахаридов под действием щелочей
называют эпимеризацией
и приводят к образованию эпимеров -
диастереоизомеров, отличающиеся
конфигурацией только одного из нескольких
хиральных центров (например, D-глюкоза
и D-манноза, D-ксилоза и D-рибоза и др.).
Взаимопревращения в слабощелочной
среде протекает через ендиольную форму,
которая образуется в результате миграции
протона от альфа-углеродного атома к
карбонильной группе. При обратном
превращении ендиольной формы в
карбонильную образуется смесь трех
моносахаридов. В бета-фуранозной форме
D-рибоза
входит в состав РНК, ряда коферментов,
гликозидов и антибиотиков. Дезоксирибоза
C5H10O4 — углевод, альдопентоза: моносахарид,
содержащий пять атомов углерода и
альдегидную группу в линейной структуре.
Это дезоксисахар — производное рибозы,
где гидроксильная группа у второго
атома углерода замещена водородом с
потерей атома кислорода (дезокси —
отсутствие атома кислорода). Рибоза
формирует пятичленное кольцо, состоящее
из четырёх атомов углерода и атома
кислорода. Гидроксильные группы соединены
с тремя атомами углерода. Последний
атом углерода и гидроксильная группа
связаны с одним из атомов углерода,
соединённых с кислородом. В дезоксирибозе
атом углерода, расположенный дальше
всего от атома кислорода, лишён
гидроксильной группы. Входит в состав
ДНК, вместе с азотистым основанием и
остатком фосфорной кислоты образуя
мономерную единицу дезоксирибонуклеиновой
кислоты — нуклеотид. D-Глюкоза
(виноградный сахар, декстроза), широко
распространена в природе: в свободном
состоянии содержится в растениях, меде,
крови; входит в состав многих дисахаридов
(лактоза, сахароза и др.); полисахаридов
(крахмал, клетчатка, гликоген и др.).
Глюкоза — главный источник энергии для
большинства организмов. Получают
гидролизом крахмала или целлюлозы в
присутствии минеральных кислот. Глюкоза
используется в качестве сырья для
производства витамина с и лекарственного
препарата «кальция глюконата»; в медицине
применяется в виде растворов для
внутривенного введения при гипогликемии,
инфекционных заболеваниях, заболеваниях
печени и так далее; является компонентом
различных кровезаменителей и противошоковых
жидкостей. Под действием ферментов
глюкоза подвергается брожению. известно
много видов брожения — спиртовое,
молочнокислое, маслянокислое, лимоннокислое
и др. наиболее важным из них является
спиртовое брожение, которое происходит
под влиянием фермента дрожжей — зимазы.
Этот вид брожения используют в
промышленности для получения этанола,
а также в виноделии и пивоварении.
D-Фруктоза
(плодовый или фруктовый сахар, левулеза),
в свободном состоянии содержится во
фруктах, меде; входит в состав ряда
олигосахаридов (сахароза, раффиноза) и
полисахаридов (инулин). Фосфаты D-фруктозы
— промежуточные продукты энергетического
обмена углеводов в живых организмах.
фруктоза слаще глюкозы и сахарозы.
Кристаллическая фруктоза представляет
собой фруктопиранозу. В состав олиго-
и полисахаридов обычно входит в фуранозной
форме. Получают фруктозу гидролизом
инулина, содержащегося в клубнях
георгинов, корнях цикория.
Представители
D-ряда являются оптическими антиподами
L-ряда, то есть альдогексоза существует
в виде восьми пар энантиомеров. D-Глюкоза
и L-глюкоза являются энантиомерами,
большинство природных моносахаридов
относится к D-ряду. Пространственные
изомеры моносахаридов, отличающиеся
конфигурацией одного или нескольких
атомов углерода и не являющиеся
зеркальными изомерами (энантиомерами),
называются диастереомерами. так,
D-глюкоза и D-галактоза, D-манноза и
D-глюкоза, D-манноза и D-галактоза составляют
пары диастереомеров. Моносахариды
обладают оптической активностью.
Вращение плоскости поляризованного
света вправо обозначают знаком (+), а
влево — знаком (–). Однако следует
помнить, что направление вращения
определяется экспериментально и никаким
образом не связано с конфигурацией, то
есть принадлежностью к D- или L-ряду. так,
встречающаяся в природе форма D-глюкозы
является правовращающей, а природная
форма D-фруктозы — левовращающей.
Моносахариды, являясь полигидроксиальдегидами
или полигидроксикетонами, образуют
циклические полуацетали в результате
внутримолекулярного взаимодействия
карбонильной и пространственно сближенной
с ней спиртовой групп. Причем, в
соответствии с теорией напряжения
циклов, наиболее благоприятно
взаимодействие, если оно приводит к
образованию пяти- или шестичленных
циклов. При взаимодействии оксогруппы
с гидроксильной группой при с-5 альдогексоз
или с-6 кетогексоз образуется пиранозный
шестичленный цикл (от названия
шестичленного гетероцикла пиран +
окончание -оза). При взаимодействии
оксогруппы с гидроксильной группой при
с-4 альдогексоз или с-5 кетогексоз
образуется фуранозный
пятичленный цикл (от названия пятичленного
гетероцикла фуран + окончание -оза).
Аномеры
— диастереомеры, отличающиеся
конфигурацией аномерного атома углерода.
У альфа-аномера расположение полуацетального
гидроксила такое же, как гидроксила
«концевого» хирального центра
(асимметрического атома углерода,
определяющего принадлежность к D- или
L-ряду). Таким образом, в проекционных
формулах моносахаридов D-ряда гликозидный
гидроксил у альфа-аномера расположен
справа от вертикальной линии углеродной
цепи, а у бета-аномера — слева. Моносахариды
являются таутомерными
веществами, в кристаллическом состоянии
они имеют циклическое строение. так,
D-глюкоза, полученная дробной кристаллизацией
из этилового спирта или воды, находится
в форме альфа-D-глюкопиранозы. в водном
растворе циклическая форма под влиянием
растворителя превращается через открытую
оксоформу в другие циклические формы
— пиранозные и фуранозные с альфа- и
бета-конфигурацией аномерного центра.
Таким образом, в водном растворе
моносахариды существуют в виде пяти
таутомерных форм — открытой, альфа- и
бета-пиранозных и альфа- и бета-фуранозных.
Такой вид таутомерии называется
кольчато-цепной, или цикло-оксо-таутомерией.
Cпособность моносахаридов к
цикло-оксо-таутомерии объясняет
выявленное задолго до установления их
строения явление мутаротации
— самопроизвольного изменения величины
оптического вращения свежеприготовленных
растворов оптически активных соединений.
В свежеприготовленном водном растворе
глюкозы наблюдается уменьшение угла
оптического вращения с +112,2° до установления
постоянного значения +52,5°, химической
основой этого процесса является
цикло-оксо-таутомерия. В разбавленных
растворах щелочей при комнатной
температуре моносахариды подвергаются
изомеризации с образованием равновесной
смеси моноз, различающихся конфигурацией
углеродных атомов C-1 и с-2. так, D-глюкоза,
выдержанная в растворе натрия гидроксида
(8•10–3)
при 35 °с в течение 4 суток, превращается
в смесь, состоящую из D-фруктозы (~ 28 %),
D-маннозы (~ 3 %) и D-глюкозы (~ 69 %). аналогичная
изомеризация наблюдается у кетоз
(фруктозы). Изомерные превращения
моносахаридов под действием щелочей
называют эпимеризацией
и приводят к образованию эпимеров -
диастереоизомеров, отличающиеся
конфигурацией только одного из нескольких
хиральных центров (например, D-глюкоза
и D-манноза, D-ксилоза и D-рибоза и др.).
Взаимопревращения в слабощелочной
среде протекает через ендиольную форму,
которая образуется в результате миграции
протона от альфа-углеродного атома к
карбонильной группе. При обратном
превращении ендиольной формы в
карбонильную образуется смесь трех
моносахаридов. В бета-фуранозной форме
D-рибоза
входит в состав РНК, ряда коферментов,
гликозидов и антибиотиков. Дезоксирибоза
C5H10O4 — углевод, альдопентоза: моносахарид,
содержащий пять атомов углерода и
альдегидную группу в линейной структуре.
Это дезоксисахар — производное рибозы,
где гидроксильная группа у второго
атома углерода замещена водородом с
потерей атома кислорода (дезокси —
отсутствие атома кислорода). Рибоза
формирует пятичленное кольцо, состоящее
из четырёх атомов углерода и атома
кислорода. Гидроксильные группы соединены
с тремя атомами углерода. Последний
атом углерода и гидроксильная группа
связаны с одним из атомов углерода,
соединённых с кислородом. В дезоксирибозе
атом углерода, расположенный дальше
всего от атома кислорода, лишён
гидроксильной группы. Входит в состав
ДНК, вместе с азотистым основанием и
остатком фосфорной кислоты образуя
мономерную единицу дезоксирибонуклеиновой
кислоты — нуклеотид. D-Глюкоза
(виноградный сахар, декстроза), широко
распространена в природе: в свободном
состоянии содержится в растениях, меде,
крови; входит в состав многих дисахаридов
(лактоза, сахароза и др.); полисахаридов
(крахмал, клетчатка, гликоген и др.).
Глюкоза — главный источник энергии для
большинства организмов. Получают
гидролизом крахмала или целлюлозы в
присутствии минеральных кислот. Глюкоза
используется в качестве сырья для
производства витамина с и лекарственного
препарата «кальция глюконата»; в медицине
применяется в виде растворов для
внутривенного введения при гипогликемии,
инфекционных заболеваниях, заболеваниях
печени и так далее; является компонентом
различных кровезаменителей и противошоковых
жидкостей. Под действием ферментов
глюкоза подвергается брожению. известно
много видов брожения — спиртовое,
молочнокислое, маслянокислое, лимоннокислое
и др. наиболее важным из них является
спиртовое брожение, которое происходит
под влиянием фермента дрожжей — зимазы.
Этот вид брожения используют в
промышленности для получения этанола,
а также в виноделии и пивоварении.
D-Фруктоза
(плодовый или фруктовый сахар, левулеза),
в свободном состоянии содержится во
фруктах, меде; входит в состав ряда
олигосахаридов (сахароза, раффиноза) и
полисахаридов (инулин). Фосфаты D-фруктозы
— промежуточные продукты энергетического
обмена углеводов в живых организмах.
фруктоза слаще глюкозы и сахарозы.
Кристаллическая фруктоза представляет
собой фруктопиранозу. В состав олиго-
и полисахаридов обычно входит в фуранозной
форме. Получают фруктозу гидролизом
инулина, содержащегося в клубнях
георгинов, корнях цикория.
71. Гликозиды. Особые свойства гликозидного гидроксила. Реакции окисления и восстановления глюкозы. Глюконовая, глюкаровая и глюкуроновая кислоты. Глюцит (сорбит), ксилит. Реакции алкилирования и ацилирования моносахаридов. Аскорбиновая кислота (витамин С).
Ответ.
Моносахариды, являясь циклическими
полуацеталями, реагируют в присутствии
кислотного катализатора со спиртами и
фенолами. Реакция протекает с участием
полуацетальной гидроксильной группы
и приводит к образованию циклических
ацеталей, получивших название «гликозиды».
В циклической форме возникает
дополнительный центр хиральности, т.
е.асимметрическим становится карбонильный
атом углерода. Этот новый хиральный
центр называют аномерным, а 2 стереоизомера
– α- и β-аномерами, ОН– называют
гликозидным
гидроксилом.
Гликозидный гидроксил может легко
взаимодействовать со спиртами, образуя
полный ацеталь, который называют
О-гликозидом:
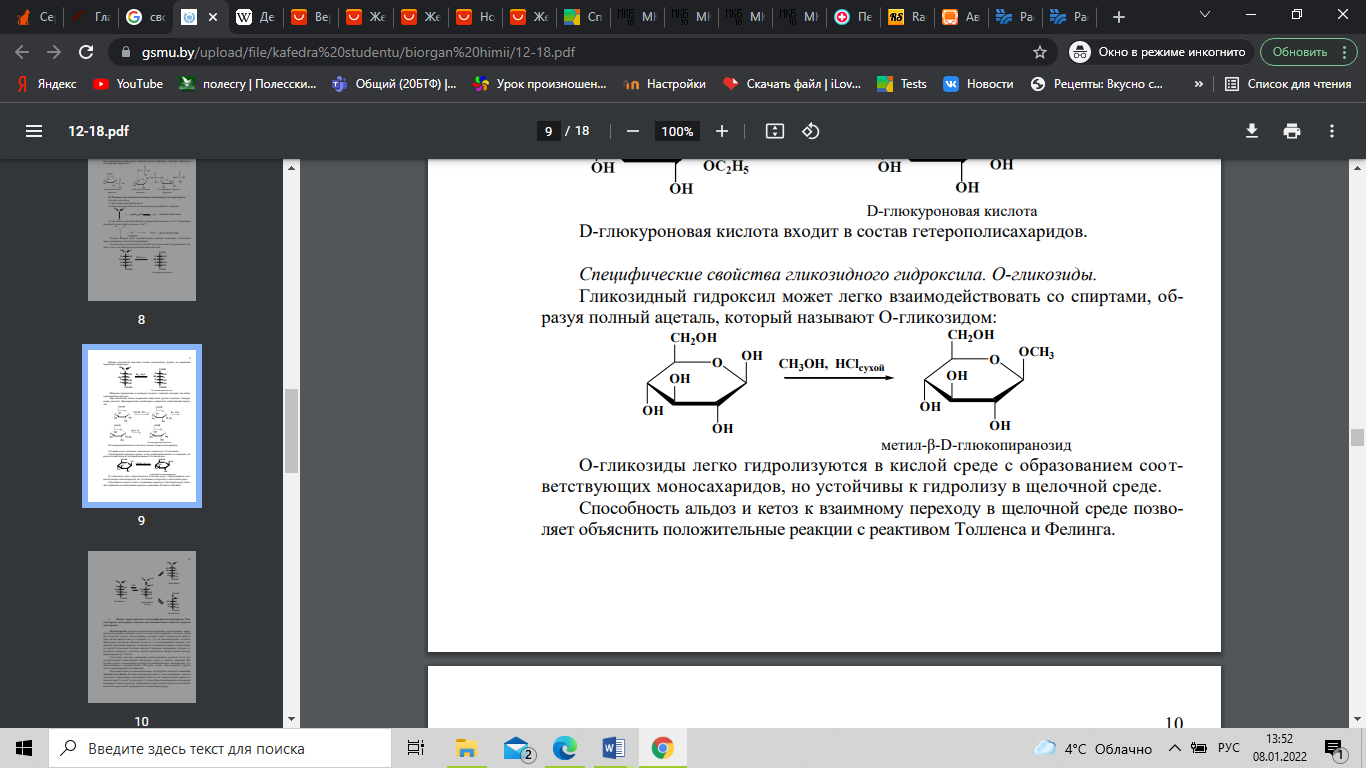 О-гликозиды
легко гидролизуются в кислой среде с
образованием соответствующих
моносахаридов, но устойчивы к гидролизу
в щелочной среде. Способность альдоз и
кетоз к взаимному переходу в щелочной
среде позволяет объяснить положительные
реакции с реактивом Толленса и Фелинга.
При восстановлении
моносахаридов водородом в присутствии
катализатора (никеля, палладия), натрия
борогидридом или натрия амальгамой в
разбавленной серной кислоте образуются
многоатомные спирты, из D-глюкозы —
D-сорбит, кристаллическое вещество,
сладкое на вкус, применяется при сахарном
диабете как заменитель сахара. D-сорбит
является промежуточным продуктом в
промышленном синтезе аскорбиновой
кислоты из D-глюкозы. Моносахариды легко
окисляются,
но в зависимости от природы окислителя
и условий окисления образуются разные
продукты. При использовании слабых
окислителей (бромной воды или разбавленной
азотной кислоты) альдозы окисляются с
образованием одноосновных полиоксикислот,
получивших общее название «альдоновые
кислоты». D-Глюкоза в этих условиях дает
D-глюконовую кислоту. Сильные окислители
(концентрированная НNO3) окисляют в
молекуле альдоз альдегидную и первичную
спиртовую группы с образованием
дикарбоновых оксикислот, получивших
общее название «альдаровые», или
«сахарные кислоты». Так, D-глюкоза
окисляется в D-глюкаровую кислоту.
Подобно альдегидам, моносахариды
окисляются аммиачным раствором серебра
оксида (реактив Толленса) и меди (II)
гидроксидом в щелочном растворе или с
реактивом Фелинга. С реактивом толленса
осуществляется реакция «серебряного
зеркала», с меди (II) гидроксидом в щелочном
растворе и реактивом Фелинга образуется
осадок меди (I) оксид кирпично-красного
цвета. Моносахариды при окислении в
щелочной среде расщепляются до смеси
продуктов окисления. Глюконовая
кислота
— органическая кислота из группы
альдоновых кислот, химическая формула
(C6H12O7). Образуется при окислении альдегидной
группы глюкозы. Соли кислоты называются
глюконаты (например, глюконат кальция,
глюконат железа). Фосфорилированная
форма глюконовой кислоты является
важным промежуточным продуктом
углеводного обмена в живых клетках.
Глюконовая кислота активизирует обмен
веществ в организме, повышает
работоспособность мышц и оказывает
другие полезные действия на организм.
Применяется в фармацевтической
промышленности в качестве наполнителя
для таблеток. В пищевой промышленности
вещество зарегистрировано в качестве
пищевой добавки E574 как регулятор
кислотности и разрыхлитель. D-глюкаровая
кислота
– игольчатые
кристаллы, C6H10O8. Кристаллы самопроизвольно
превращаются в смесь лактонов.
Восстанавливает аммиачный раствор
нитрата серебра, но не реактив Фелинга.
Глюкуроновая
кислота
— одноосновная органическая кислота,
относящаяся к группе уроновых кислот.
Глюкуроновая кислота содержится в
небольших количествах в организме
человека, где образуется при окислении
D-глюкозы. Глюкуроновая кислота входит
в состав слизи, слюны, внеклеточного
матрикса, гликокаликса. Является одним
из ключевых компонентов пигментного
обмена в печени. Свойства глюкуроновой
кислоты аналогичны свойствам глюкозы,
но вследствие наличия в её молекуле
карбоксильной группы, она способна
образовывать лактоны и соли. При
нагревании глюкуроновая кислота
дегидратируется и декарбоксилируется.
Глюкуроновая кислота способна образовывать
растворимые конъюгаты (глюкурониды) со
спиртами, фенолами, карбоновыми кислотами,
тиолами, аминами и рядом других веществ,
за счёт чего достигается их обезвреживание
(снижение токсичности) и выведение из
организма. Сорбит
— органическое соединение, шестиатомный
спирт. Имеет сладкий вкус. Получают
путём гидрирования глюкозы с восстановлением
альдегидной группы до первичной
спиртовой. Используется в производстве
аскорбиновой кислоты, в косметике и др.
Зарегистрирован в качестве пищевой
добавки как E420. В естественном виде
встречается в косточковых плодах,
водорослях, высших растениях. Сорбит
вырабатывается организмом человека
естественным образом, хотя усваивается
плохо. Слишком большое его количество
в клетках организма может вызвать их
дисфункцию. В современной косметике
сорбит используется как гигроскопическое
вещество и загуститель. Некоторые
прозрачные бесцветные гели можно
приготовить только с его использованием,
так как у него достаточно высокий
показатель преломления. Сорбит считается
важным химическим веществом для
производства биотоплива из растительной
биомассы. Полное восстановление сорбита
водородом позволяет получать алканы,
например гексан, которые можно применять
в качестве биотоплива. Также в самом
сорбите содержится достаточно водорода
для реакции восстановления до гексана.
Употребление большого количества
сорбита может привести к боли в животе,
вздутию живота, диарее (от легкой до
тяжелой). Избыточное потребление сорбита
— более 20 г в день, например в виде
жевательной резинки без сахара, приводит
к тяжелой диарее, вызывающей непреднамеренную
потерю веса или даже требующей
госпитализации. Ксилит
CH2OH(CHOH)3CH2OH — многоатомный спирт
(пентанпентаол). В пищевой промышленности
ксилит зарегистрирован в качестве
пищевой добавки E967, как подсластитель,
влагоудерживающий агент, стабилизатор
и эмульгатор. Применяется в пищевой
промышленности, например вместо сахара
в производстве жевательных резинок и
кондитерских изделий для больных
диабетом. Ксилитол — слабительное
средство. При взаимодействии моносахаридов
с галогеналканами или диметилсульфатом
(CH3)2SO4 в реакцию вступают все гидроксильные
группы, включая полуацетальный гидроксил.
В результате реакции образуются
гликозиды, алкилированные
по всем гидроксильным группам. Такие
соединения в кислой среде гидролизуются
только по гликозидной связи. Образовавшиеся
простые эфиры по остальным гидроксильным
группам гидролизу не подвергаются. При
взаимодействии моносахаридов с
ангидридами карбоновых кислот легко
образуются сложные эфиры при участии
всех гидроксильных групп. При действии
на глюкозу уксусным ангидридом образуется
пентаацетилглюкоза.
В кислой и щелочной среде сложные эфиры
моносахаридов гидролизуются.
Аскорбиновая кислота
(витамин С), водорастворимый витамин,
содержащийся во многих овощах и фруктах,
недостаток витамина с в пище вызывает
заболевание цингу, а также понижает
сопротивляемость организма к инфекционным
заболеваниям. Аскорбиновая кислота —
сильный восстанавливающий агент; при
окислении превращается в дегидроаскорбиновую
кислоту, которая, в свою очередь, способна
довольно легко восстанавливаться до
аскорбиновой кислоты. Роль витамина с
в организме связана с его участием в
окислительно-восстановительных
процессах, углеводном обмене, в регенерации
тканей, в синтезе стероидов и др. Обладает
сильными кислотными свойствами (рКа =
4,2), что связано с диссоциацией одной из
гидроксильных групп ендиольного
фрагмента. В промышленности получают
из D-глюкозы. Потребность в витамине с
для человека 50—70 мг в сутки.
О-гликозиды
легко гидролизуются в кислой среде с
образованием соответствующих
моносахаридов, но устойчивы к гидролизу
в щелочной среде. Способность альдоз и
кетоз к взаимному переходу в щелочной
среде позволяет объяснить положительные
реакции с реактивом Толленса и Фелинга.
При восстановлении
моносахаридов водородом в присутствии
катализатора (никеля, палладия), натрия
борогидридом или натрия амальгамой в
разбавленной серной кислоте образуются
многоатомные спирты, из D-глюкозы —
D-сорбит, кристаллическое вещество,
сладкое на вкус, применяется при сахарном
диабете как заменитель сахара. D-сорбит
является промежуточным продуктом в
промышленном синтезе аскорбиновой
кислоты из D-глюкозы. Моносахариды легко
окисляются,
но в зависимости от природы окислителя
и условий окисления образуются разные
продукты. При использовании слабых
окислителей (бромной воды или разбавленной
азотной кислоты) альдозы окисляются с
образованием одноосновных полиоксикислот,
получивших общее название «альдоновые
кислоты». D-Глюкоза в этих условиях дает
D-глюконовую кислоту. Сильные окислители
(концентрированная НNO3) окисляют в
молекуле альдоз альдегидную и первичную
спиртовую группы с образованием
дикарбоновых оксикислот, получивших
общее название «альдаровые», или
«сахарные кислоты». Так, D-глюкоза
окисляется в D-глюкаровую кислоту.
Подобно альдегидам, моносахариды
окисляются аммиачным раствором серебра
оксида (реактив Толленса) и меди (II)
гидроксидом в щелочном растворе или с
реактивом Фелинга. С реактивом толленса
осуществляется реакция «серебряного
зеркала», с меди (II) гидроксидом в щелочном
растворе и реактивом Фелинга образуется
осадок меди (I) оксид кирпично-красного
цвета. Моносахариды при окислении в
щелочной среде расщепляются до смеси
продуктов окисления. Глюконовая
кислота
— органическая кислота из группы
альдоновых кислот, химическая формула
(C6H12O7). Образуется при окислении альдегидной
группы глюкозы. Соли кислоты называются
глюконаты (например, глюконат кальция,
глюконат железа). Фосфорилированная
форма глюконовой кислоты является
важным промежуточным продуктом
углеводного обмена в живых клетках.
Глюконовая кислота активизирует обмен
веществ в организме, повышает
работоспособность мышц и оказывает
другие полезные действия на организм.
Применяется в фармацевтической
промышленности в качестве наполнителя
для таблеток. В пищевой промышленности
вещество зарегистрировано в качестве
пищевой добавки E574 как регулятор
кислотности и разрыхлитель. D-глюкаровая
кислота
– игольчатые
кристаллы, C6H10O8. Кристаллы самопроизвольно
превращаются в смесь лактонов.
Восстанавливает аммиачный раствор
нитрата серебра, но не реактив Фелинга.
Глюкуроновая
кислота
— одноосновная органическая кислота,
относящаяся к группе уроновых кислот.
Глюкуроновая кислота содержится в
небольших количествах в организме
человека, где образуется при окислении
D-глюкозы. Глюкуроновая кислота входит
в состав слизи, слюны, внеклеточного
матрикса, гликокаликса. Является одним
из ключевых компонентов пигментного
обмена в печени. Свойства глюкуроновой
кислоты аналогичны свойствам глюкозы,
но вследствие наличия в её молекуле
карбоксильной группы, она способна
образовывать лактоны и соли. При
нагревании глюкуроновая кислота
дегидратируется и декарбоксилируется.
Глюкуроновая кислота способна образовывать
растворимые конъюгаты (глюкурониды) со
спиртами, фенолами, карбоновыми кислотами,
тиолами, аминами и рядом других веществ,
за счёт чего достигается их обезвреживание
(снижение токсичности) и выведение из
организма. Сорбит
— органическое соединение, шестиатомный
спирт. Имеет сладкий вкус. Получают
путём гидрирования глюкозы с восстановлением
альдегидной группы до первичной
спиртовой. Используется в производстве
аскорбиновой кислоты, в косметике и др.
Зарегистрирован в качестве пищевой
добавки как E420. В естественном виде
встречается в косточковых плодах,
водорослях, высших растениях. Сорбит
вырабатывается организмом человека
естественным образом, хотя усваивается
плохо. Слишком большое его количество
в клетках организма может вызвать их
дисфункцию. В современной косметике
сорбит используется как гигроскопическое
вещество и загуститель. Некоторые
прозрачные бесцветные гели можно
приготовить только с его использованием,
так как у него достаточно высокий
показатель преломления. Сорбит считается
важным химическим веществом для
производства биотоплива из растительной
биомассы. Полное восстановление сорбита
водородом позволяет получать алканы,
например гексан, которые можно применять
в качестве биотоплива. Также в самом
сорбите содержится достаточно водорода
для реакции восстановления до гексана.
Употребление большого количества
сорбита может привести к боли в животе,
вздутию живота, диарее (от легкой до
тяжелой). Избыточное потребление сорбита
— более 20 г в день, например в виде
жевательной резинки без сахара, приводит
к тяжелой диарее, вызывающей непреднамеренную
потерю веса или даже требующей
госпитализации. Ксилит
CH2OH(CHOH)3CH2OH — многоатомный спирт
(пентанпентаол). В пищевой промышленности
ксилит зарегистрирован в качестве
пищевой добавки E967, как подсластитель,
влагоудерживающий агент, стабилизатор
и эмульгатор. Применяется в пищевой
промышленности, например вместо сахара
в производстве жевательных резинок и
кондитерских изделий для больных
диабетом. Ксилитол — слабительное
средство. При взаимодействии моносахаридов
с галогеналканами или диметилсульфатом
(CH3)2SO4 в реакцию вступают все гидроксильные
группы, включая полуацетальный гидроксил.
В результате реакции образуются
гликозиды, алкилированные
по всем гидроксильным группам. Такие
соединения в кислой среде гидролизуются
только по гликозидной связи. Образовавшиеся
простые эфиры по остальным гидроксильным
группам гидролизу не подвергаются. При
взаимодействии моносахаридов с
ангидридами карбоновых кислот легко
образуются сложные эфиры при участии
всех гидроксильных групп. При действии
на глюкозу уксусным ангидридом образуется
пентаацетилглюкоза.
В кислой и щелочной среде сложные эфиры
моносахаридов гидролизуются.
Аскорбиновая кислота
(витамин С), водорастворимый витамин,
содержащийся во многих овощах и фруктах,
недостаток витамина с в пище вызывает
заболевание цингу, а также понижает
сопротивляемость организма к инфекционным
заболеваниям. Аскорбиновая кислота —
сильный восстанавливающий агент; при
окислении превращается в дегидроаскорбиновую
кислоту, которая, в свою очередь, способна
довольно легко восстанавливаться до
аскорбиновой кислоты. Роль витамина с
в организме связана с его участием в
окислительно-восстановительных
процессах, углеводном обмене, в регенерации
тканей, в синтезе стероидов и др. Обладает
сильными кислотными свойствами (рКа =
4,2), что связано с диссоциацией одной из
гидроксильных групп ендиольного
фрагмента. В промышленности получают
из D-глюкозы. Потребность в витамине с
для человека 50—70 мг в сутки.
