
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
Ответ.
При взаимодействии фенолятов с
галогеналканами образуются простые
эфиры.
Такие реакции называют O-алкилированием,
так как при этом алкилируется атом
кислорода. Метиловые эфиры фенолов
обычно получают взаимодействием
фенолятов с диметилсульфатом
(о-алкилирование):
![]() Аналогично
протекает реакция образования сложных
эфиров при взаимодействии фенолят-иона
с ацилирующими реагентами —
галогенангидридами и ангидридами
карбоновых кислот (о-ацилирование):
Ацилирование
фенолов карбоновыми кислотами в
присутствии серной кислоты, в отличие
от ацилирования спиртов, практически
не используется, так как эта реакция
из-за уменьшения электронной плотности
на атоме кислорода в молекуле фенола
идет значительно медленнее. Гидроксильная
группа, проявляя электронодонорные
свойства, очень сильно активирует
бензольное кольцо по отношению к
электрофильным реагентам. Фенолят-ионы
в реакции
SE
еще более активны, чем соответствующие
фенолы. В связи с высокой активностью
фенолов необходимо принимать специальные
меры для того, чтобы предотвратить
реакции окисления и полизамещения.
Обычно для введения атома галогена
в бензольное кольцо требуются катализаторы
— кислоты Льюиса. Реакция галогенирования
фенолов, учитывая их высокую реакционную
способность, протекает очень легко в
отсутствие катализатора. они обесцвечивают
бромную воду, причем происходит замещение
всех атомов водорода в о- и п-положениях:
Аналогично
протекает реакция образования сложных
эфиров при взаимодействии фенолят-иона
с ацилирующими реагентами —
галогенангидридами и ангидридами
карбоновых кислот (о-ацилирование):
Ацилирование
фенолов карбоновыми кислотами в
присутствии серной кислоты, в отличие
от ацилирования спиртов, практически
не используется, так как эта реакция
из-за уменьшения электронной плотности
на атоме кислорода в молекуле фенола
идет значительно медленнее. Гидроксильная
группа, проявляя электронодонорные
свойства, очень сильно активирует
бензольное кольцо по отношению к
электрофильным реагентам. Фенолят-ионы
в реакции
SE
еще более активны, чем соответствующие
фенолы. В связи с высокой активностью
фенолов необходимо принимать специальные
меры для того, чтобы предотвратить
реакции окисления и полизамещения.
Обычно для введения атома галогена
в бензольное кольцо требуются катализаторы
— кислоты Льюиса. Реакция галогенирования
фенолов, учитывая их высокую реакционную
способность, протекает очень легко в
отсутствие катализатора. они обесцвечивают
бромную воду, причем происходит замещение
всех атомов водорода в о- и п-положениях:
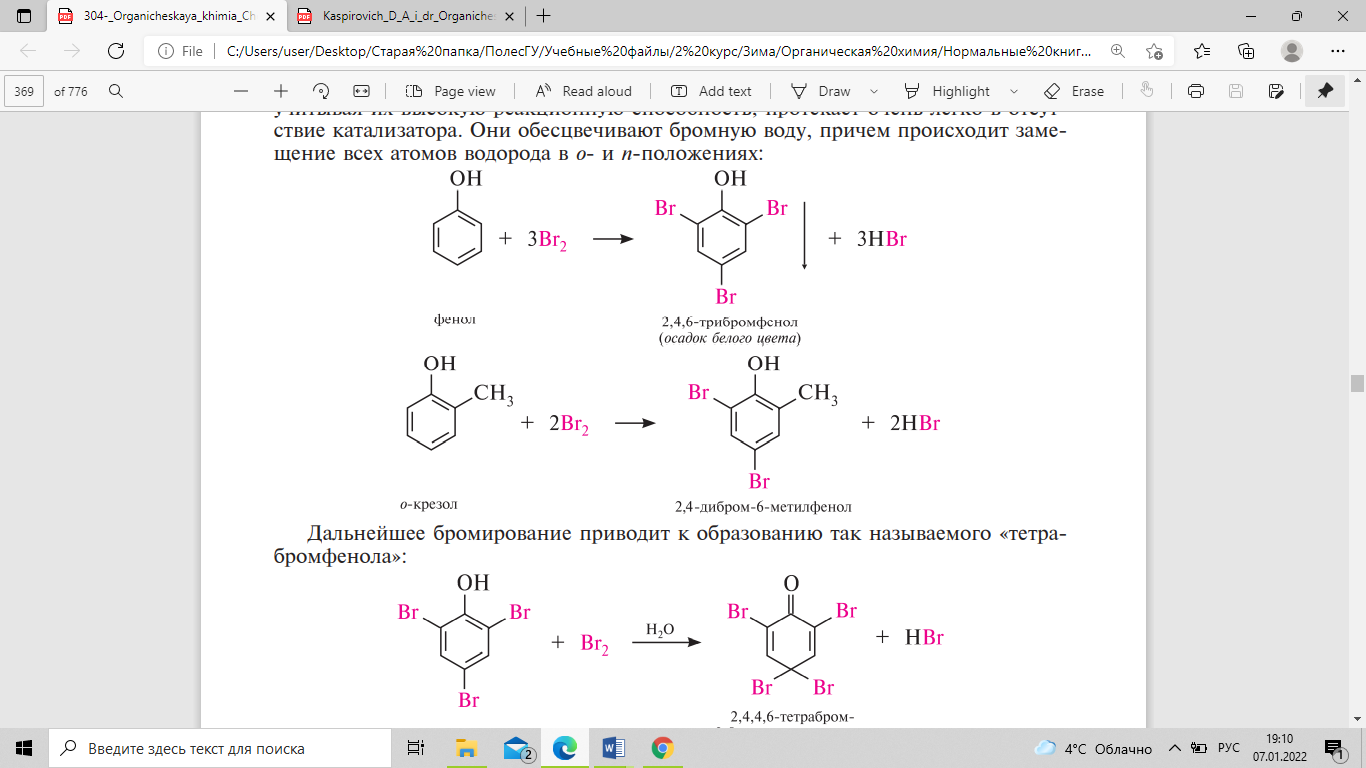 Дальнейшее
бромирование приводит к образованию
так называемого «тетрабромфенола». При
этом происходит нарушение ароматичности
бензольного кольца. Для введения в
молекулу фенола одного или двух атомов
галогена необходимы специальные условия.
Если бромирование проводить в низкополярном
растворителе (CCl4, CHCl3), образуются
преимущественно монобромфенолы с
преобладающим количеством пара-изомера.
При хлорировании образуется преимущественно
орто-изомер. Йод непосредственно не
йодирует фенолы. Реакция нитрования
фенола происходит при комнатной
температуре уже при обработке разбавленной
азотной кислотой, тогда как для нитрования
бензола используют нитрующую смесь.
При этом образуется смесь о- и
п-нитрофенолов:
Дальнейшее
бромирование приводит к образованию
так называемого «тетрабромфенола». При
этом происходит нарушение ароматичности
бензольного кольца. Для введения в
молекулу фенола одного или двух атомов
галогена необходимы специальные условия.
Если бромирование проводить в низкополярном
растворителе (CCl4, CHCl3), образуются
преимущественно монобромфенолы с
преобладающим количеством пара-изомера.
При хлорировании образуется преимущественно
орто-изомер. Йод непосредственно не
йодирует фенолы. Реакция нитрования
фенола происходит при комнатной
температуре уже при обработке разбавленной
азотной кислотой, тогда как для нитрования
бензола используют нитрующую смесь.
При этом образуется смесь о- и
п-нитрофенолов:
 При
действии концентрированной азотной
кислоты фенол превращается в
2,4,6-тринитрофенол (пикриновую кислоту):
Ранее
пикриновую кислоту использовали как
взрывчатое вещество. Сульфирование
фенола проходит очень легко и в зависимости
от температурного режима приводит к
образованию орто- или пара-изомеров:
При
действии концентрированной азотной
кислоты фенол превращается в
2,4,6-тринитрофенол (пикриновую кислоту):
Ранее
пикриновую кислоту использовали как
взрывчатое вещество. Сульфирование
фенола проходит очень легко и в зависимости
от температурного режима приводит к
образованию орто- или пара-изомеров:
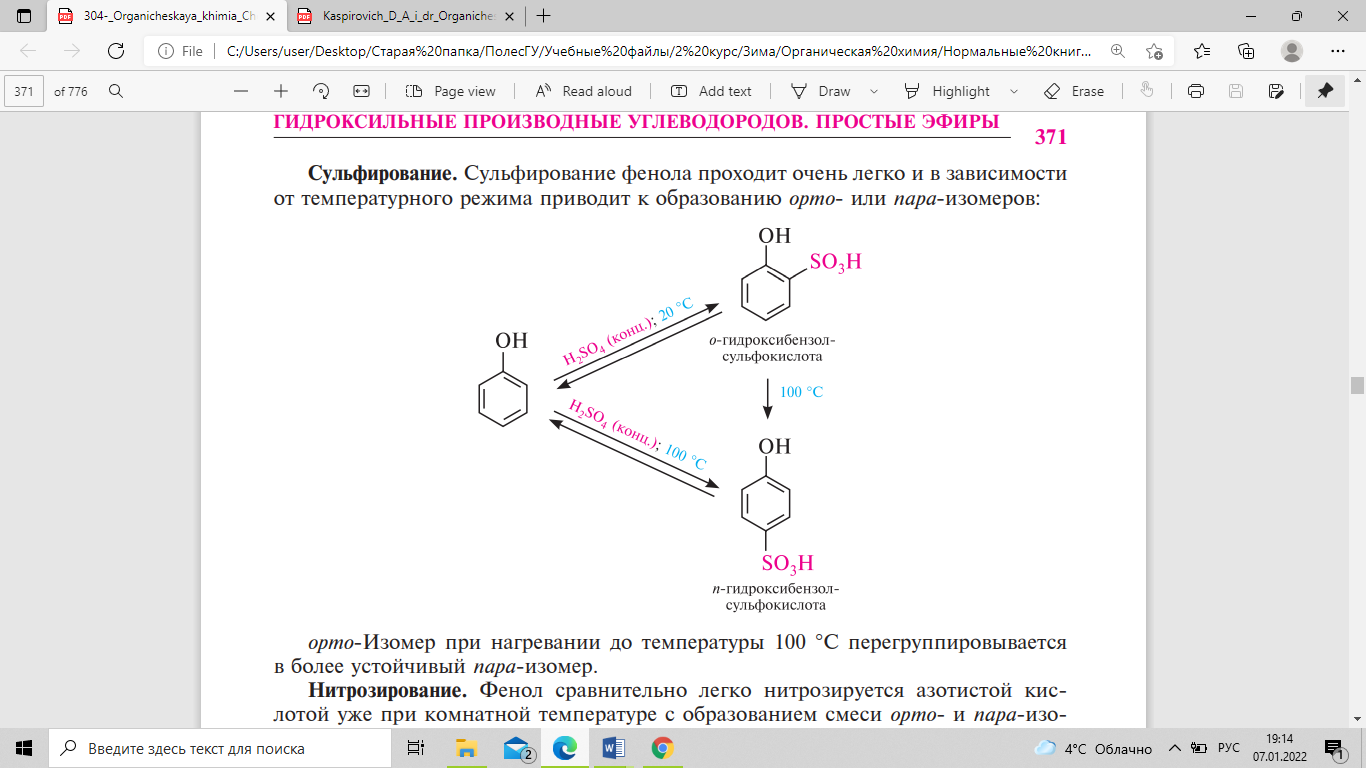 Орто-изомер
при нагревании до температуры 100°с
перегруппировывается в более устойчивый
пара-изомер. Алкилирование
фенолов можно проводить по реакции
фриделя—крафтса (с-алкилирование).
Однако выходы в этой реакции, как правило,
невысокие. Наиболее часто для алкилирования
используют спирты и алкены в присутствии
кислот (H2SO4, H3PO4 или BF3):
Орто-изомер
при нагревании до температуры 100°с
перегруппировывается в более устойчивый
пара-изомер. Алкилирование
фенолов можно проводить по реакции
фриделя—крафтса (с-алкилирование).
Однако выходы в этой реакции, как правило,
невысокие. Наиболее часто для алкилирования
используют спирты и алкены в присутствии
кислот (H2SO4, H3PO4 или BF3):

49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
Ответ.
Карбоксилирование.
При нагревании натрия фенолята в токе
углерода (IV) оксида образуется натрия
салицилат (реакция Кольбе— Шмитта, 1860
г.), который под действием минеральных
кислот превращается в салициловую
кислоту:
 СО2
— очень слабый электрофил, поэтому
реакцию проводят с натрия фенолятом,
как более активным субстратом. Окисление
фенолов протекает сложно. в зависимости
от природы окислителя образуются разные
продукты. хрома (VI) оксид в кислой среде
окисляет фенол до n-бензохинона:
СО2
— очень слабый электрофил, поэтому
реакцию проводят с натрия фенолятом,
как более активным субстратом. Окисление
фенолов протекает сложно. в зависимости
от природы окислителя образуются разные
продукты. хрома (VI) оксид в кислой среде
окисляет фенол до n-бензохинона:
 При
окислении фенола калия персульфатом в
щелочной среде образуется гидрохинон
(реакция Эльбса):
При
окислении фенола калия персульфатом в
щелочной среде образуется гидрохинон
(реакция Эльбса):

