
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
Ответ.
Фенолами (аренолами) называют производные
ароматических углеводородов, содержащие
одну или несколько гидроксильных групп,
непосредственно связанных с атомами
углерода ароматического цикла. Название
класса произошло от простейшего
представителя — фенола с6н5он. Фенолы
— устойчивые соединения и существуют
исключительно в енольной форме:
 Большая
стабильность енольной формы обусловливается
ароматическим строением углеводородного
радикала и высокой степенью сопряжения
он-группы с бензольным ядром. Фенолы
существенно отличаются по своим
физическим и химическим свойствам и от
спиртов. Главной причиной этих отличий
является различный характер электронных
взаимодействий гидроксильной группы
с углеводородным радикалом. В спиртах
гидроксильная группа связана с атомом
углерода в sp3-гибридизации. за счет
–I-эффекта гидроксильной группы
происходит смещение электронной
плотности по s-связи и образование на
атоме кислорода частичного отрицательного
заряда, а на атоме углерода — частичного
положительного заряда. В фенолах
кислородный атом гидроксильной группы
связан с атомом углерода ароматической
системы и поэтому наряду с отрицательным
индуктивным эффектом имеет место и
положительный мезомерный эффект. В
результате мезомерного эффекта происходит
смещение неподеленной пары электронов
атома кислорода к бензольному кольцу
и на кислороде возникает частичный
положительный заряд. такой же по величине
отрицательный заряд переходит на
ароматическое ядро. Так как для
гидроксильной группы мезомерный эффект
по силе превосходит индуктивный, то
суммарный частичный заряд на атоме
кислорода фенольного гидроксила
положителен, тогда как кислородный атом
спиртового гидроксила имеет частичный
отрицательный заряд. По заместительной
номенклатуре
IUPAC названия фенолов образуют от названий
соответствующих аренов с добавлением
префикса гидрокси-. Для многих фенолов
используют тривиальные названия. В
качестве основы названий гомологов
фенола чаще всего используют слово
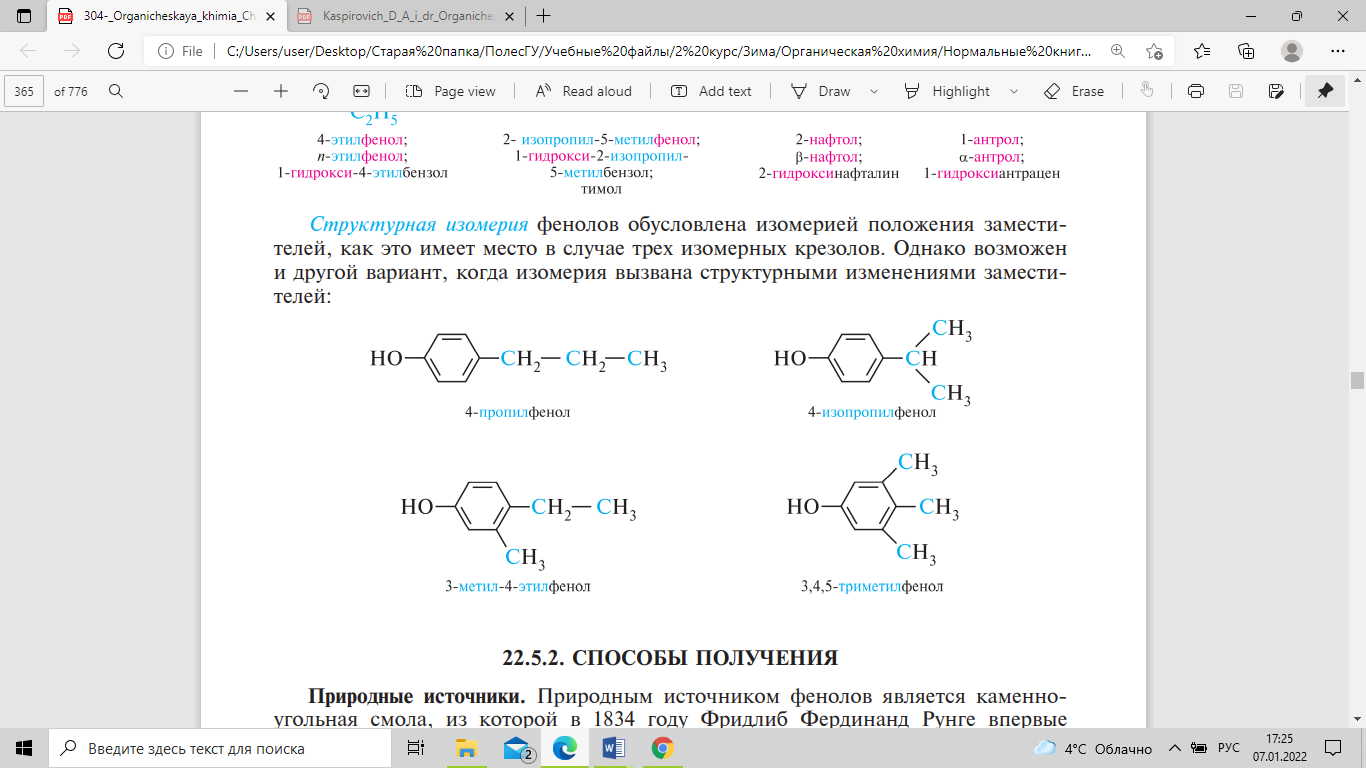
«фенол». Структурная изомерия фенолов
обусловлена изомерией положения
заместителей, как это имеет место в
случае трех изомерных крезолов. Однако
возможен и другой вариант, когда изомерия
вызвана структурными изменениями
заместителей:
Большая
стабильность енольной формы обусловливается
ароматическим строением углеводородного
радикала и высокой степенью сопряжения
он-группы с бензольным ядром. Фенолы
существенно отличаются по своим
физическим и химическим свойствам и от
спиртов. Главной причиной этих отличий
является различный характер электронных
взаимодействий гидроксильной группы
с углеводородным радикалом. В спиртах
гидроксильная группа связана с атомом
углерода в sp3-гибридизации. за счет
–I-эффекта гидроксильной группы
происходит смещение электронной
плотности по s-связи и образование на
атоме кислорода частичного отрицательного
заряда, а на атоме углерода — частичного
положительного заряда. В фенолах
кислородный атом гидроксильной группы
связан с атомом углерода ароматической
системы и поэтому наряду с отрицательным
индуктивным эффектом имеет место и
положительный мезомерный эффект. В
результате мезомерного эффекта происходит
смещение неподеленной пары электронов
атома кислорода к бензольному кольцу
и на кислороде возникает частичный
положительный заряд. такой же по величине
отрицательный заряд переходит на
ароматическое ядро. Так как для
гидроксильной группы мезомерный эффект
по силе превосходит индуктивный, то
суммарный частичный заряд на атоме
кислорода фенольного гидроксила
положителен, тогда как кислородный атом
спиртового гидроксила имеет частичный
отрицательный заряд. По заместительной
номенклатуре
IUPAC названия фенолов образуют от названий
соответствующих аренов с добавлением
префикса гидрокси-. Для многих фенолов
используют тривиальные названия. В
качестве основы названий гомологов
фенола чаще всего используют слово
«фенол». Структурная изомерия фенолов
обусловлена изомерией положения
заместителей, как это имеет место в
случае трех изомерных крезолов. Однако
возможен и другой вариант, когда изомерия
вызвана структурными изменениями
заместителей:
Фенол
с6н5он. бесцветные, розовеющие на воздухе
вследствие окисления кристаллы (т. пл.
43 °с, т. кип. 182 °с). Растворяется в воде
(при 15 °с — около 8 %). Обладает
антисептическими свойствами. В виде 5
%-ного водного раствора (карболовая
кислота) используется в качестве
дезинфицирующего средства. Нашел широкое
применение в производстве пластмасс,
красителей, взрывчатых веществ,
лекарственных средств. Фенол токсичен,
может вызвать ожоги кожи. Крезолы
(о-, м-, п-метилфенолы). Применяются для
получения пластмасс, красителей и др.
смесь изомерных крезолов с мылами
используется как дезинфицирующее
средство в ветеринарной практике (лизол,
креолин). Пирокатехин
(1,2-дигидроксибензол) — органическое
соединение, двухатомный фенол, имеющий
химическую формулу С6Н4(ОН)2. Один из трёх
возможных изомеров дигидроксибензола,
два других — гидрохинон и резорцин.
Выглядит как бесцветные кристаллы с
запахом фенола. Сильный восстановитель.
Применяют в фотографии как проявитель,
в производстве красителей, лекарственных
веществ (например, адреналина).
Этерифицированием из пирокатехина
получают гваякол, — исходное вещество
для синтеза ванилина. Гидрохинон
(пара-дигидроксибензол, бензол-1,4-диол,
хинол) — ароматическое органическое
соединение, представитель двуатомных
фенолов с химической формулой C6H4(OH)2,
изомер пирокатехина и резорцина. Название
«гидрохинон» дано соединению Ф. Вёлером
из-за схожести свойств с хиноном, из
которого Вёлер его синтезировал. Сильный
восстановитель, используется как
проявитель в фотографии, антиоксидант
в химической промышленности, реагент
для определения ниобия, вольфрама,
золота и цезия в аналитической химии.
Обладает слабым дезинфекционным
действием, аналогичным тому, который
оказывает фенол. Флороглюцин
(1,3,5-тригидроксибензол) — трёхатомный
фенол. Представляет собой бесцветные
кристаллы, сладкие на вкус. Растворим
в этиловом спирте, эфире, ацетоне,
трихлорметане, пиридине. В воде растворим
слабо (1,13 г/100 мл при 35 °C). Образует
дигидрат с температурой плавления
116—117 °C. Безводный флороглюцин плавится
при 223 °C, при дальнейшем повышении
температуры возгоняется с разложением.
Проявляет кето-енольную таутомерию.
Водным раствором карбоната (или
гидрокарбоната) натрия при комнатной
температуре карбоксилируется до
2,4,6-тригидроксибензойной
(флороглюцинкарбоновой) кислоты.
Применяют для качественного и
количественного определения пентоз и
пентозанов. Используется в фотоэмульсиях,
как вулканизирующий реагент для каучуков,
в синтезе лекарственных препаратов.
Пирогаллол
(пирогалловая кислота, 1,2,3-тригидроксибензол)
— органическое соединение, трехатомный
фенол с химической формулой C6H6O3,
бесцветные кристаллы, темнеющие на
воздухе. Применяется в органическом
синтезе как восстановитель, также
используется в промышленности как
полупродукт в производстве красителей,
в фотографии как проявляющее вещество.
Фенолы — более сильные он-кислоты, чем
спирты. Это вызвано тем, что неподеленная
пара электронов атома кислорода в
молекуле фенола смещена к ядру (+М-эффект
он-группы), что приводит к образованию
частичного положительного заряда на
атоме кислорода и увеличению поляризации
связи о—н по сравнению со спиртами.
кроме того, образующийся фенолят-ион
(феноксид-ион) имеет повышенную
стабильность за счет делокализации
отрицательного заряда по ароматическому
радикалу. Доказательством более сильных
кислотных свойств фенолов по сравнению
со спиртами может служить их реакция с
водными растворами щелочей с образованием
солей — фенолятов (феноксидов):
![]() В
отличие от фенолов, спирты, как более
слабые кислоты, способны образовывать
алкоголяты только при взаимодействии
со щелочными металлами. В водном растворе
феноляты щелочных металлов частично
гидролизованы (как соли слабых кислот
и сильных оснований), и поэтому их
растворы обладают щелочной реакцией.
На кислотность фенола значительное
влияние оказывают заместители в
ароматическом ядре. Так, введение в
n-положение бензольного ядра молекулы
фенола электроноакцепторных заместителей
(—NO2, —CN, —Hal и др.) усиливает кислотные
свойства фенола. введение же в n-положение
электронодонорных заместителей (—NH2,
—OCH3 и др.) приводит к понижению кислотности,
поскольку при этом уменьшается смещение
электронов связи O—H к атому кислорода,
что затрудняет отрыв протона.
В
отличие от фенолов, спирты, как более
слабые кислоты, способны образовывать
алкоголяты только при взаимодействии
со щелочными металлами. В водном растворе
феноляты щелочных металлов частично
гидролизованы (как соли слабых кислот
и сильных оснований), и поэтому их
растворы обладают щелочной реакцией.
На кислотность фенола значительное
влияние оказывают заместители в
ароматическом ядре. Так, введение в
n-положение бензольного ядра молекулы
фенола электроноакцепторных заместителей
(—NO2, —CN, —Hal и др.) усиливает кислотные
свойства фенола. введение же в n-положение
электронодонорных заместителей (—NH2,
—OCH3 и др.) приводит к понижению кислотности,
поскольку при этом уменьшается смещение
электронов связи O—H к атому кислорода,
что затрудняет отрыв протона.
