
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
Ответ.
При нагревании спиртов в присутствии
концентрированной серной кислоты,
безводной фосфорной кислоты или при
пропускании паров спирта над катализатором
алюминия оксидом Al2O3 спирты отщепляют
воду, то есть подвергаются дегидратации.
в зависимости от природы спирта и условий
проведения реакции дегидратация может
протекать межмолекулярно и внутримолекулярно.
При межмолекулярной
дегидратации
спиртов образуются простые эфиры:
![]() В
результате внутримолекулярной
дегидратации образуются алкены:
В
результате внутримолекулярной
дегидратации образуются алкены:
![]() Внутримолекулярная
дегидратация в ряду вторичных и третичных
спиртов протекает согласно правилу
Зайцева: протон отщепляется от соседнего,
менее гидрогенизированного атома
углерода. Межмолекулярная и
внутримолекулярная дегидратации спиртов
представляют собой два конкурирующих
процесса, из которых каждый в определенных
условиях может стать доминирующим.
отщепление воды от двух молекул спирта
с образованием простых эфиров —
межмолекулярная дегидратация — становится
преобладающим процессом при нагревании
спиртов в присутствии каталитических
количеств минеральной кислоты (спирт
в избытке) при температуре 140—160 °С.
Внутримолекулярная дегидратация, то
есть превращение спирта в алкен,
становится доминирующей при нагревании
спиртов с избытком минеральной кислоты
при температуре выше 170 °С. особенно
легко она протекает в ряду третичных
спиртов. В случае пропускания паров
спирта над Al2O3 при температуре 200—250 °с
происходит межмолекулярная дегидратация
с образованием простых эфиров, а при
более высокой температуре (300—400 °с)
протекает внутримолекулярная дегидратация,
то есть образуются алкены. Межмолекулярная
дегидратация спиртов протекает по
механизму SN2 или SN1. При этом вначале
молекула спирта под действием минеральной
кислоты протонируется с образованием
оксониевого катиона, а затем происходит
замещение группы —OH. Механизм SN2 включает
образование переходного состояния,
которое формируется в процессе
нуклеофильной атаки электрофильного
атома углерода оксониевого катиона
второй молекулой спирта. Внутримолекулярная
дегидратация спиртов в зависимости от
их строения может протекать по механизму
E1 и E2. Первичные спирты реагируют в
большинстве случаев по механизму е2, а
вторичные и особенно третичные — по
механизму е1. Элиминирование завершается
быстрым отщеплением β-протона от
карбокатиона под действием слабого
основания (молекулы воды, спирта и др.)
с образованием алкена. Первичные и
вторичные спирты по-разному относятся
к действию окислителей. Первичные спирты
при окислении первоначально образуют
альдегиды, которые могут окисляться
далее, превращаясь при этом в карбоновые
кислоты:
Внутримолекулярная
дегидратация в ряду вторичных и третичных
спиртов протекает согласно правилу
Зайцева: протон отщепляется от соседнего,
менее гидрогенизированного атома
углерода. Межмолекулярная и
внутримолекулярная дегидратации спиртов
представляют собой два конкурирующих
процесса, из которых каждый в определенных
условиях может стать доминирующим.
отщепление воды от двух молекул спирта
с образованием простых эфиров —
межмолекулярная дегидратация — становится
преобладающим процессом при нагревании
спиртов в присутствии каталитических
количеств минеральной кислоты (спирт
в избытке) при температуре 140—160 °С.
Внутримолекулярная дегидратация, то
есть превращение спирта в алкен,
становится доминирующей при нагревании
спиртов с избытком минеральной кислоты
при температуре выше 170 °С. особенно
легко она протекает в ряду третичных
спиртов. В случае пропускания паров
спирта над Al2O3 при температуре 200—250 °с
происходит межмолекулярная дегидратация
с образованием простых эфиров, а при
более высокой температуре (300—400 °с)
протекает внутримолекулярная дегидратация,
то есть образуются алкены. Межмолекулярная
дегидратация спиртов протекает по
механизму SN2 или SN1. При этом вначале
молекула спирта под действием минеральной
кислоты протонируется с образованием
оксониевого катиона, а затем происходит
замещение группы —OH. Механизм SN2 включает
образование переходного состояния,
которое формируется в процессе
нуклеофильной атаки электрофильного
атома углерода оксониевого катиона
второй молекулой спирта. Внутримолекулярная
дегидратация спиртов в зависимости от
их строения может протекать по механизму
E1 и E2. Первичные спирты реагируют в
большинстве случаев по механизму е2, а
вторичные и особенно третичные — по
механизму е1. Элиминирование завершается
быстрым отщеплением β-протона от
карбокатиона под действием слабого
основания (молекулы воды, спирта и др.)
с образованием алкена. Первичные и
вторичные спирты по-разному относятся
к действию окислителей. Первичные спирты
при окислении первоначально образуют
альдегиды, которые могут окисляться
далее, превращаясь при этом в карбоновые
кислоты:
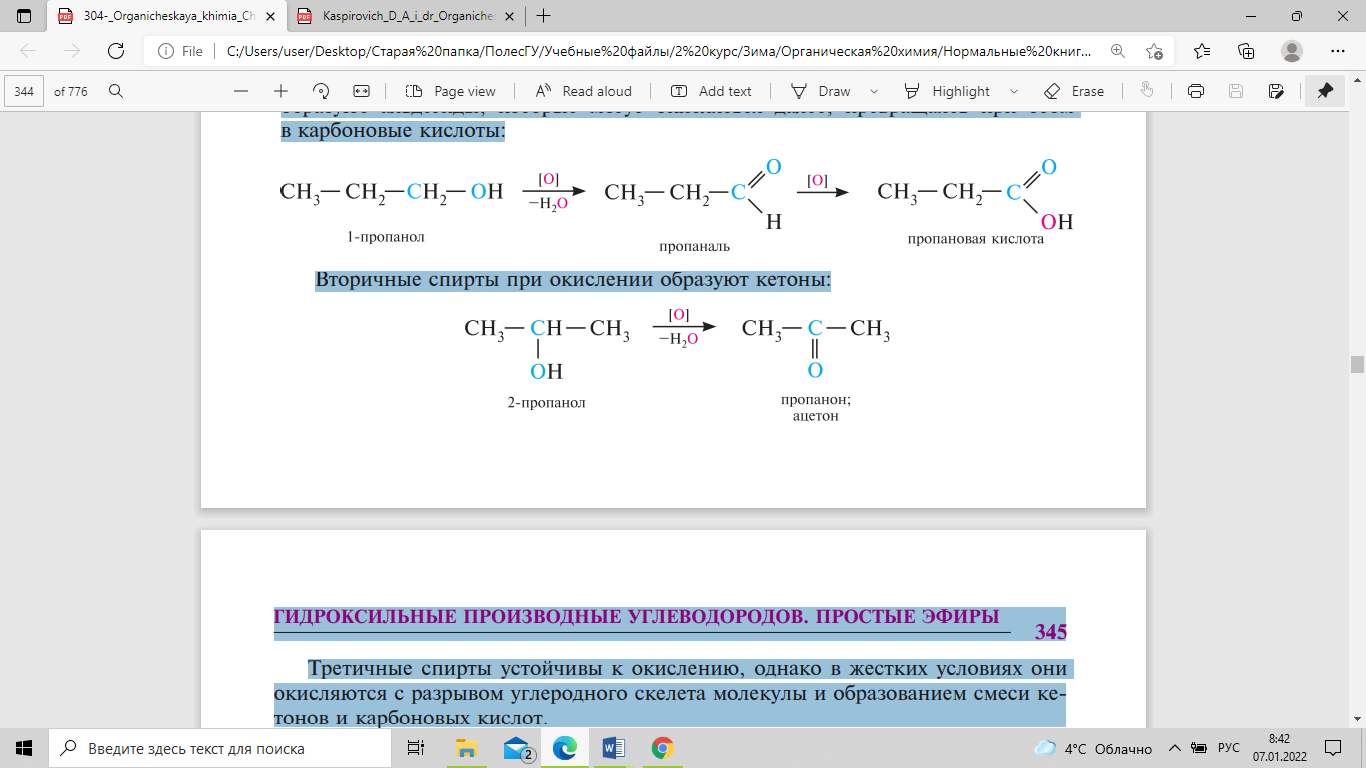 Вторичные
спирты при окислении образуют кетоны:
В
качестве окислителей для окисления
спиртов используют хрома (VI) оксид, калия
дихромат в серной кислоте (хромовая
смесь), калия перманганат в серной
кислоте и др. В промышленности для
окисления первичных спиртов в альдегиды
используют метод каталитического
дегидрирования. сущность метода состоит
в пропускании паров спирта над
катализатором (мелкораздробленная
медь) при 280—300 °с. Происходит отщепление
молекулы водорода от молекулы спирта
и образуется альдегид. Преимуществом
каталитического дегидрирования является
то, что предотвращается более глубокое
окисление альдегида до кислоты:
Вторичные
спирты при окислении образуют кетоны:
В
качестве окислителей для окисления
спиртов используют хрома (VI) оксид, калия
дихромат в серной кислоте (хромовая
смесь), калия перманганат в серной
кислоте и др. В промышленности для
окисления первичных спиртов в альдегиды
используют метод каталитического
дегидрирования. сущность метода состоит
в пропускании паров спирта над
катализатором (мелкораздробленная
медь) при 280—300 °с. Происходит отщепление
молекулы водорода от молекулы спирта
и образуется альдегид. Преимуществом
каталитического дегидрирования является
то, что предотвращается более глубокое
окисление альдегида до кислоты:
![]() в
условиях данной реакции из вторичных
спиртов синтезируют и многие кетоны.
в
условиях данной реакции из вторичных
спиртов синтезируют и многие кетоны.
46. Многоатомные спирты. Этиленгликоль, глицерин, пентаэритрит, инозит. Химические свойства 1,2-диолов: кислотность, образование хелатных комплексов, окислительное расщепление 1,2-диолов (йодной кислотой), образование циклических простых и сложных эфиров азотной кислоты.
Ответ.
Двухатомные спирты
(содержат две гидроксильные группы)
называют диолами или гликолями. По
систематической номенклатуре IUPAC
названия гликолей образуют, исходя из
названия соответствующего углеводорода,
добавляя суффикс -диол и цифровые
локанты, указывающие положение
гидроксильных групп в углеродной цепи.
Трехатомные спирты (содержат три
гидроксильные группы) называют
триолами,или глицеринами. По заместительной
номенклатуре названия трехатомных
спиртов образуют путем добавления к
названию соответствующего углеводорода
суффикса –триол. Многоатомные спирты
содержат более трех гидроксильных групп
и их называют полиолами. Так, четырехатомные
спирты имеют общее название «эритриты»,
пятиатомные — «пентиты», шестиатомные
— «гекситы» и т. д. Низшие члены
гомологического ряда диолов представляют
собой вязкие жидкости, высшие —
кристаллические вещества. Жидкие гликоли
имеют большую плотность и более высокие
температуры плавления и кипения, чем
одноатомные спирты; хорошо растворяются
в воде. трехатомные спирты — вязкие
жидкости или трудно кристаллизующиеся
твердые вещества. Вязкость, растворимость
в воде, температуры плавления и кипения
гидроксильных производных алифатических
углеводородов увеличиваются в ряду:
одноатомные спирты < гликоли <
глицерины. Такая зависимость является
следствием усиления ассоциации молекул
за счет образования межмолекулярных
водородных связей. Отличительной
особенностью гидроксильных производных
углеводородов с несколькими он-группами
является их сладковатый вкус, как
правило, усиливающийся с увеличением
числа гидроксильных групп в молекуле.
Этиленгликоль
(1,2-этандиол) но–сн2–сн2–он. бесцветная
вязкая жидкость, т. кип. 197,6 °с, т. пл.
–11,5 °с. Гигроскопичен, смешивается с
водой и этанолом, сильно понижает
температуру замерзания воды и используется
для приготовления антифриза. очень
токсичен. широко используется для
получения синтетических волокон.
Глицерин (1,2,3-пропантриол).
бесцветная сиропообразная жидкость
без запаха, со сладким вкусом, т. пл. 18
°с, т. кип. 290 °с (с разложением).
Гигроскопичен, смешивается с водой и
этанолом в любых соотношениях. Применяется
в качестве основы для мазей и паст,
добавки к мылам. в больших количествах
глицерин используется для получения
нитроглицерина. Пентаэритрит
(2,2-бис(гидроксиметил)пропан-1,3-диол)
C(CH2OH)4 — четырёхатомный спирт с углеродным
скелетом неопентана. Белый кристаллический
порошок со сладким вкусом. Пентаэритрит
проявляет свойства спиртов: алкилируется,
ацилируется, реагирует с азотной кислотой
с образованием моно-, ди-, три- и
тетрапроизводных; образует алкоголяты
и комплексы с металлами. Отличительной
чертой пентаэритрита является способность
образовывать циклические производные.
Так, при реакции с тионилхлоридом, в
зависимости от условий, образует моно-,
ди-, трихлорпроизводное или
пентаэритритдисульфит. Пентаэритрит
применяется в производстве алкидных
смол, пентафталевых лаков и эмалей,
синтетических смазочных масел,
пентапласта, пластификаторов и
антиоксидантов для полимеров,
термостабилизаторов, для синтеза ПАВ,
взрывчатого вещества тетранитропентаэритрита
(ТЭНа). Инозитол
(циклогексан-1,2,3,4,5,6-гексол) — шестиатомный
спирт циклогексана. Более точное название
— мио-инозитол. Представляет собой
карбоциклический сахар, который
содержится в большом количестве в мозге
и других тканях млекопитающих, опосредует
передачу клеточного сигнала в ответ на
различные гормоны, нейротрансмиттеры
и факторы роста и участвует в осморегуляции.
Инозитол существует в девяти стереоизомерах,
из которых наиболее часто встречающимся
в живых организмах является
цис-1,2,3,5-транс-4,6-циклогексангексаол.
Несмотря на сходную с сахаридами
брутто-формулу Cx(H2O)y, инозитол по
химической природе не является углеводом,
он практически безвкусный, слегка
сладкий. Инозитол называли «витамином
В8», однако было показано, что около 3/4
суточной потребности инозитола
вырабатывается самим организмом, поэтому
инозитол относят к витаминоподобным
веществам. Не существует данных о том,
что недостаток инозитола в пище может
вызывать болезненные проявления.
Двухатомные спирты вступают в те же
реакции, что и одноатомные, с той лишь
разницей, что они могут протекать с
участием одной или двух гидроксильных
групп. еще большее разнообразие продуктов
возможно для реакций с участием трех-
и полиатомных спиртов. При взаимодействии
гликолей со спиртами, минеральными или
органическими кислотами образуется
два ряда производных: а) неполные и
полные простые эфиры; б) неполные и
полные сложные эфиры. При взаимодействии
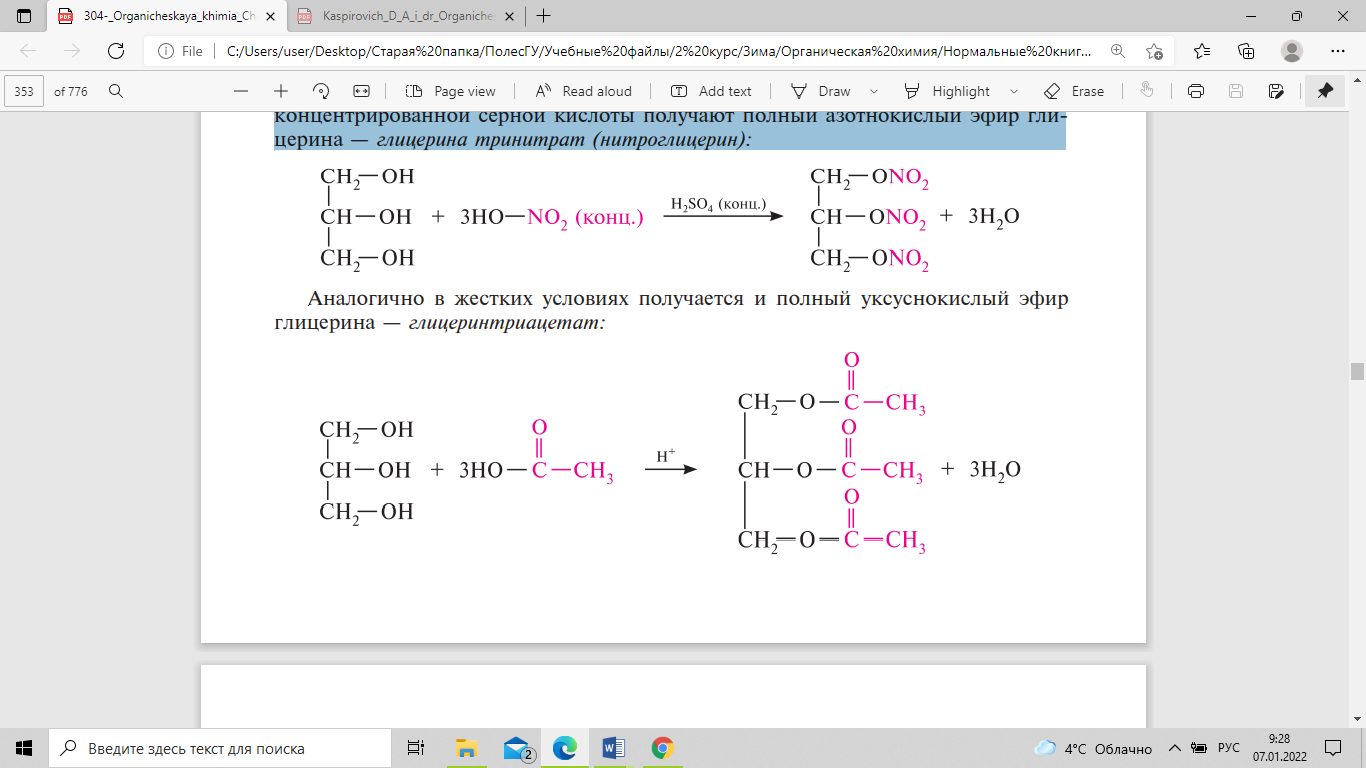
глицерина с концентрированной азотной
кислотой в присутствии концентрированной
серной кислоты получают полный
азотнокислый эфир глицерина — глицерина
тринитрат (нитроглицерин):
 При
окислении
гликолей образуется смесь продуктов
окисления:
При
окислении
гликолей образуется смесь продуктов
окисления:
 Некоторые
из промежуточных продуктов можно
выделить, проводя окисление этиленгликоля
в специально подобранных условиях.
Окисление глицерина проходит сложно,
многоступенчато. В зависимости от
природы окислителя могут преобладать
те или иные продукты окисления.
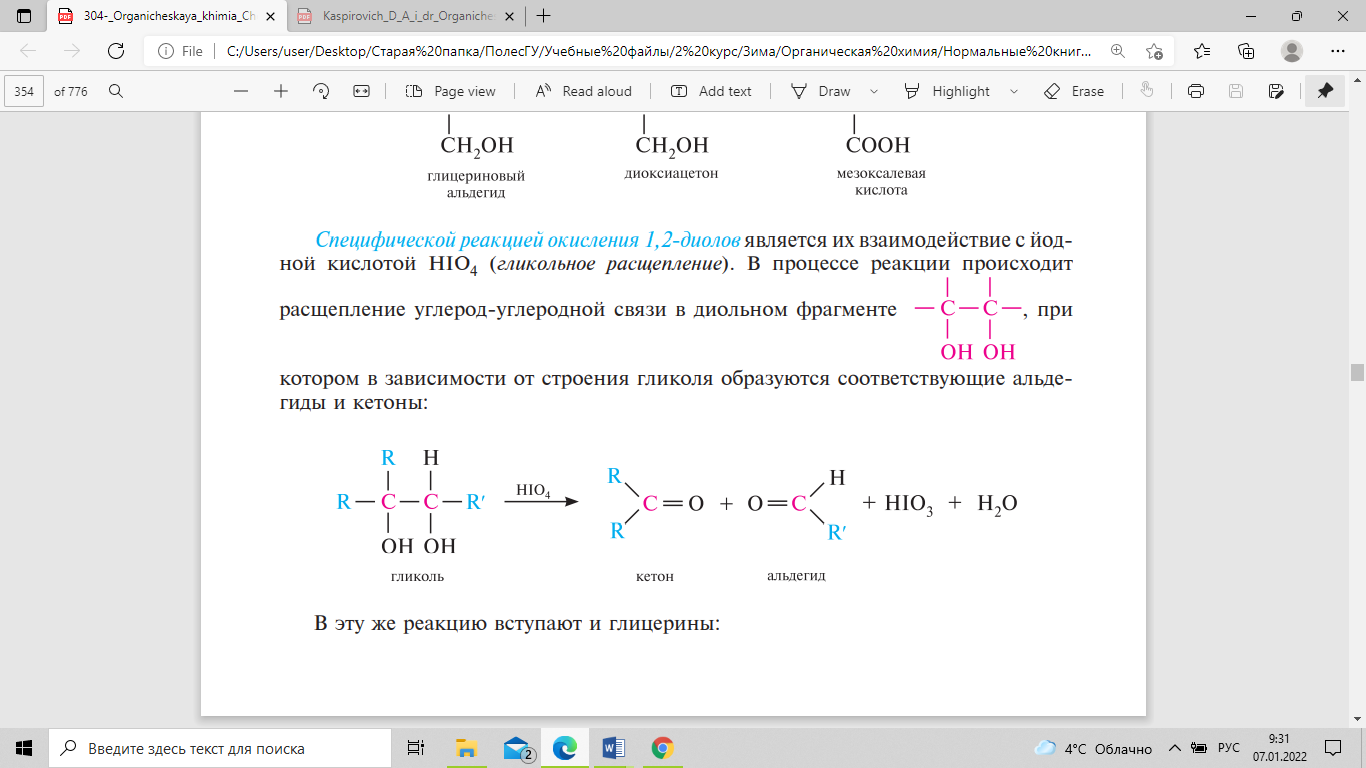
Специфической реакцией окисления
1,2-диолов
является их взаимодействие с йодной
кислотой НIO4 (гликольное расщепление).
В процессе реакции происходит расщепление
углерод-углеродной связи в диольном
фрагменте, при котором в зависимости
от строения гликоля образуются
соответствующие альдегиды и кетоны:
Некоторые
из промежуточных продуктов можно
выделить, проводя окисление этиленгликоля
в специально подобранных условиях.
Окисление глицерина проходит сложно,
многоступенчато. В зависимости от
природы окислителя могут преобладать
те или иные продукты окисления.
Специфической реакцией окисления
1,2-диолов
является их взаимодействие с йодной
кислотой НIO4 (гликольное расщепление).
В процессе реакции происходит расщепление
углерод-углеродной связи в диольном
фрагменте, при котором в зависимости
от строения гликоля образуются
соответствующие альдегиды и кетоны:
 В
эту же реакцию вступают и глицерины.
Многоатомные
спирты, содержащие гидроксильные группы
у соседних атомов углерода, при
взаимодействии с гидроксидами тяжелых
металлов, например гидроксидом меди
(II) в щелочной среде, образуют
внутрикомплексные, так называемые хелатные,
соединения. Такие
соединения обычно хорошо растворимы в
воде и интенсивно окрашены, поэтому
реакция используется как качественная.
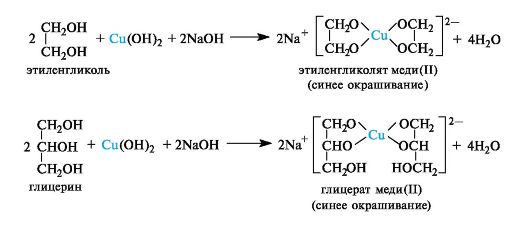
При взаимодействии этиленгликоля или
глицерина с гидроксидом меди (II) возникает
интенсивно синее окрашивание в результате
образования гликолята меди (II) или
глицерата меди (II).
В
эту же реакцию вступают и глицерины.
Многоатомные
спирты, содержащие гидроксильные группы
у соседних атомов углерода, при
взаимодействии с гидроксидами тяжелых
металлов, например гидроксидом меди
(II) в щелочной среде, образуют
внутрикомплексные, так называемые хелатные,
соединения. Такие
соединения обычно хорошо растворимы в
воде и интенсивно окрашены, поэтому
реакция используется как качественная.
При взаимодействии этиленгликоля или
глицерина с гидроксидом меди (II) возникает
интенсивно синее окрашивание в результате
образования гликолята меди (II) или
глицерата меди (II).
 Эта
качественная реакция характерна для
многоатомных спиртов с открытой цепью
и некоторых циклических спиртов, в
которых гидроксильные группы достаточно
сближены.
Эта
качественная реакция характерна для
многоатомных спиртов с открытой цепью
и некоторых циклических спиртов, в
которых гидроксильные группы достаточно
сближены.
