
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
Ответ.
Полимеризацией называют процесс
соединения друг с другом молекул
низкомолекулярных веществ (мономеров)
с образованием высокомолекулярных
соединений (полимеров). В реакцию
полимеризации могут вступать молекулы
одного и того же мономера, а также
молекулы двух и более разных мономеров.
Полимер, состоящий из одинаковых
мономеров, называется гомополимером,
а полимер, в состав которого входят два
и более разных мономеров,— сополимером.
Реакция получения сополимеров называется
реакцией сополимеризации. Полимеризация
алкенов представляет собой последовательное
соединение молекул алкена друг с другом
вследствие разрыва двойной связи. В
общем виде полимеризацию алкенов можно
представить следующей схемой:
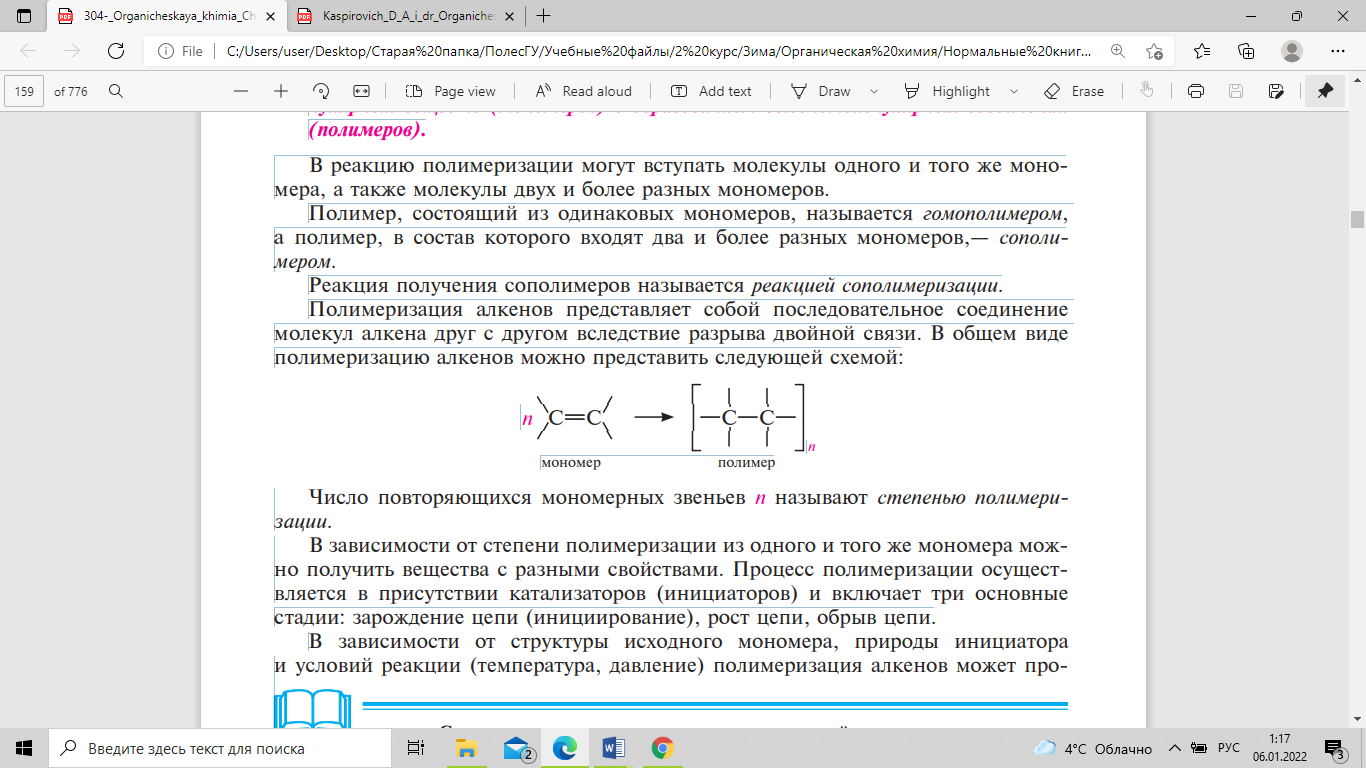 Число
повторяющихся мономерных звеньев п
называют степенью полимеризации.
Число
повторяющихся мономерных звеньев п
называют степенью полимеризации.
В
зависимости от степени полимеризации
из одного и того же мономера можно
получить вещества с разными свойствами.
Процесс полимеризации осуществляется
в присутствии катализаторов (инициаторов)
и включает три основные стадии: зарождение
цепи (инициирование), рост цепи, обрыв
цепи. В зависимости от структуры исходного
мономера, природы инициатора и условий
реакции (температура, давление)
полимеризация алкенов может происходить
по радикальному и ионному (катионному)
механизмам. Особым типом полимеризации
является полимеризация в присутствии
металлорганических соединений, получившая
название «координационная полимеризация».
По радикальному механизму алкены
полимеризуются в присутствии пероксидных
соединений, таких, как ацетила пероксид,
бензоила пероксид и других, способных
при высоком давлении и температуре
распадаться на свободные радикалы. Эти
свободные радикалы затем присоединяются
к алкену с образованием новых радикалов.
Далее происходит последовательное
присоединение других молекул алкена.
Растущая активированная цепь при
радикальной полимеризации представляет
собой свободный радикал. Обрыв цепи
осуществляется чаще всего путем
димеризации свободных радикалов.
Механизм радикальной полимеризации
этилена в присутствии ацетила пероксида
можно представить следующим образом:
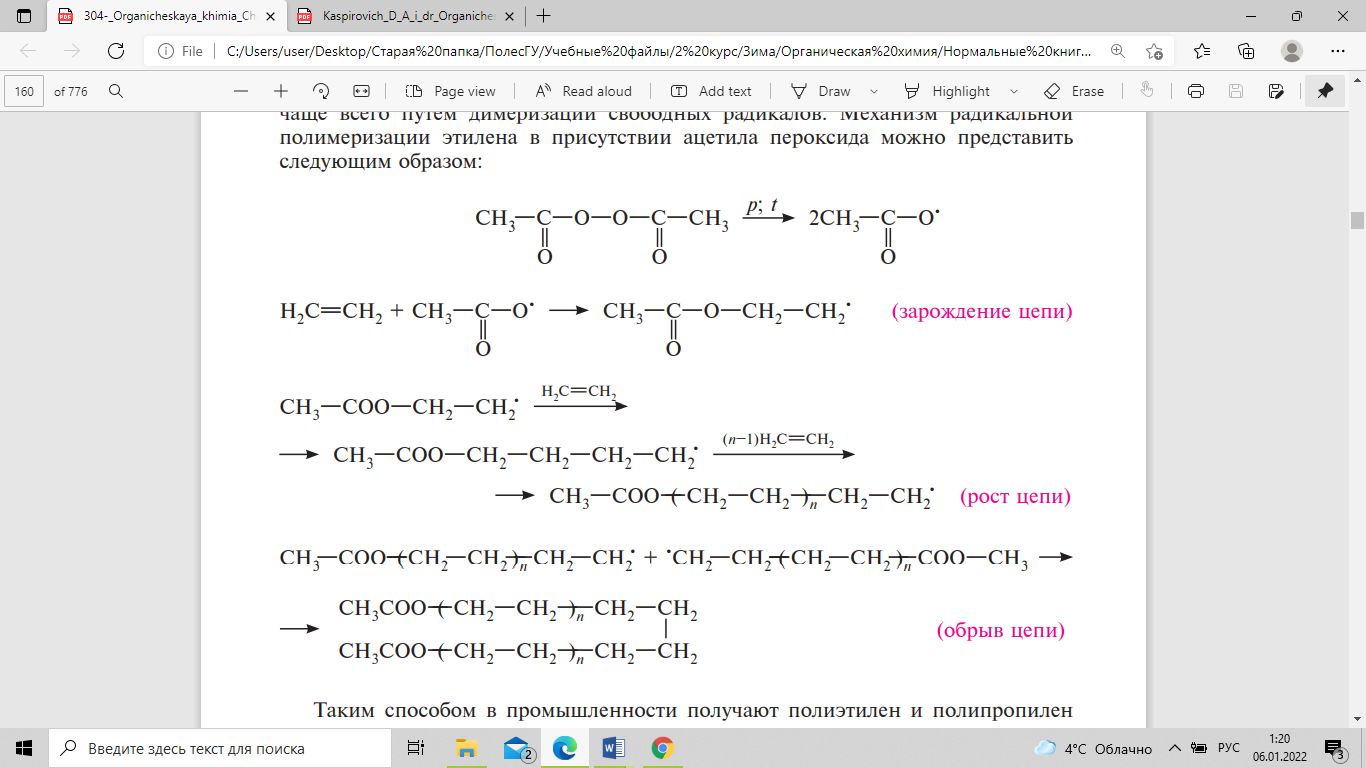 .
Таким способом в промышленности получают
полиэтилен и полипропилен высокого
давления. Катионная полимеризация
алкенов инициируется протонными
кислотами или кислотами Льюиса (АlС13,
BF3 и др.). Реакционным центром растущей
полимерной цепи является карбокатион.
По ионному катионному механизму наиболее
легко полимеризуются несимметрично
построенные алкены общей формулы
.
Таким способом в промышленности получают
полиэтилен и полипропилен высокого
давления. Катионная полимеризация
алкенов инициируется протонными
кислотами или кислотами Льюиса (АlС13,
BF3 и др.). Реакционным центром растущей
полимерной цепи является карбокатион.
По ионному катионному механизму наиболее
легко полимеризуются несимметрично
построенные алкены общей формулы
![]() ,
из которых образуются относительно
стабильные промежуточные карбокатионы.
В промышленности этот метод применяют
для полимеризации изобутилена.
Координационная полимеризация алкенов
представляет собой довольно сложный
процесс, протекающий в присутствии
комплексных металлорганических
катализаторов Циглера—Натты. Наиболее
распространенным из них является
комплекс триэтилалюминия с титана
хлоридом Аl(С2Н5)3 · ТiСl4. Механизм
координационной полимеризации пока
точно не известен, однако установлено,
что образование полимера происходит
путем внедрения молекул алкена по связи
металл-углерод растущей полимерной
цепи. Полимеризация алкенов в присутствии
катализаторов Циглера—Натты позволяет
получать высокомолекулярные полимеры
при относительно низких давлении и
температуре. Этот метод широко используют
в промышленности для производства
полиэтилена и полипропилена низкого
давления. При свободнорадикальной и
катионной полимеризации образуется
полимер нерегулярного строения, то есть
с произвольной стереохимической
конфигурацией. Такой полимер называют
атактическим. Полимеризация алкенов с
использованием катализатора Циглера—Натты
приводит к образованию стереорегулярного
полимера, получившего название
«изотактический». Пространственное
строение атактического и изотактического
полипропиленов:
,
из которых образуются относительно
стабильные промежуточные карбокатионы.
В промышленности этот метод применяют
для полимеризации изобутилена.
Координационная полимеризация алкенов
представляет собой довольно сложный
процесс, протекающий в присутствии
комплексных металлорганических
катализаторов Циглера—Натты. Наиболее
распространенным из них является
комплекс триэтилалюминия с титана
хлоридом Аl(С2Н5)3 · ТiСl4. Механизм
координационной полимеризации пока
точно не известен, однако установлено,
что образование полимера происходит
путем внедрения молекул алкена по связи
металл-углерод растущей полимерной
цепи. Полимеризация алкенов в присутствии
катализаторов Циглера—Натты позволяет
получать высокомолекулярные полимеры
при относительно низких давлении и
температуре. Этот метод широко используют
в промышленности для производства
полиэтилена и полипропилена низкого
давления. При свободнорадикальной и
катионной полимеризации образуется
полимер нерегулярного строения, то есть
с произвольной стереохимической
конфигурацией. Такой полимер называют
атактическим. Полимеризация алкенов с
использованием катализатора Циглера—Натты
приводит к образованию стереорегулярного
полимера, получившего название
«изотактический». Пространственное
строение атактического и изотактического
полипропиленов:
 Изотактическим
полимерам по сравнению с атактическими
свойственны большая прочность и более
высокие температуры плавления. Полиэтилен
представляет собой массу белого цвета
(тонкие листы прозрачны и бесцветны).
Химически стоек, диэлектрик, не
чувствителен к удару (амортизатор), при
нагревании размягчается (80—120 °С),
адгезия — чрезвычайно низкая. Применение.
Полиэтиленовая плёнка (особенно
упаковочная, например, пузырчатая
упаковка или скотч), тара (бутылки, ящики,
канистры, садовые лейки, горшки для
рассады), полимерные трубы для канализации,
дренажа, водо-, газоснабжения,
электроизоляционный материал,
полиэтиленовый порошок используется
как термоклей. Полипропилен
- материал для производства плёнок
(особенно упаковочных), мешков, тары,
труб, деталей технической аппаратуры,
пластиковых стаканчиков, предметов
домашнего обихода, нетканых материалов,
электроизоляционный материал, в
строительстве для вибро- и шумоизоляции
межэтажных перекрытий в системах
«плавающий пол». При сополимеризации
пропилена с этиленом получают
некристаллизующиеся сополимеры, которые
проявляют свойства каучука, отличающиеся
повышенной химической стойкостью и
сопротивлением старению.
Изотактическим
полимерам по сравнению с атактическими
свойственны большая прочность и более
высокие температуры плавления. Полиэтилен
представляет собой массу белого цвета
(тонкие листы прозрачны и бесцветны).
Химически стоек, диэлектрик, не
чувствителен к удару (амортизатор), при
нагревании размягчается (80—120 °С),
адгезия — чрезвычайно низкая. Применение.
Полиэтиленовая плёнка (особенно
упаковочная, например, пузырчатая
упаковка или скотч), тара (бутылки, ящики,
канистры, садовые лейки, горшки для
рассады), полимерные трубы для канализации,
дренажа, водо-, газоснабжения,
электроизоляционный материал,
полиэтиленовый порошок используется
как термоклей. Полипропилен
- материал для производства плёнок
(особенно упаковочных), мешков, тары,
труб, деталей технической аппаратуры,
пластиковых стаканчиков, предметов
домашнего обихода, нетканых материалов,
электроизоляционный материал, в
строительстве для вибро- и шумоизоляции
межэтажных перекрытий в системах
«плавающий пол». При сополимеризации
пропилена с этиленом получают
некристаллизующиеся сополимеры, которые
проявляют свойства каучука, отличающиеся
повышенной химической стойкостью и
сопротивлением старению.
