
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
Ответ.
Алкены довольно легко присоединяют по
двойной связи хлор и бром, труднее —
йод. В результате взаимодействия
образуются дигалогенопроизводные
алканов, содержащие атомы галогена
у соседних атомов углерода (вицинальные
дигалогенопроизводные углеводородов).
Механизм этой реакции включает
электрофильную атаку молекулы галогена
на π-электроны двойной связи. Под влиянием
π-электронного облака двойной связи
молекула галогена поляризуется и
приобретает способность выступать в
качестве электрофильного реагента. На
стадии I реакции атом галогена, несущий
частичный положительный заряд, вступает
во взаимодействие с π-электронами
двойной связи, в результате чего
образуется π-комплекс. Затем в π-комплексе
постепенно происходит гетероциклический
разрыв связи между атомами галогена с
образованием продукта присоединения,
строение которого может быть представлено
равновесием между ионом карбония и
циклическим ионом галогенония. Положение
равновесия в большинстве случаев смещено
в сторону циклического иона галогенония.
Но если двойная связь алкена сопряжена
с бензольным ядром, способным делокализовать
положительный заряд, продукт присоединения
существует преимущественно в виде иона
карбония. На стадии II реакции циклический
ион галогенония подвергается атаке
отрицательным ионом галогена по атому
углерода со стороны, противоположной
расположению уже имеющегося галогена,
с образованием продукта транс-присоединения.
Следовательно, присоединение галогенов
к алкенам происходит, как правило,
стереоселективно, то есть пространственно
избирательно. В целом механизм реакции
галогенирования алкенов можно представить
следующим образом:
 Эта
реакция широко используется в
фармацевтическом анализе для качественного
и количественного определения соединений,
содержащих двойную углерод-углеродную
связь. Присоединение галогеноводородов
(гидрогалогенирование). Алкены присоединяют
по месту разрыва двойной связи
галогеноводороды, образуя галогеналканы.
Реакция с НI, НВг, НF протекает при
комнатной температуре, взаимодействие
с НСl требует нагревания. Присоединение
галогеноводородов к алкенам, как и
присоединение галогенов, происходит
по гетеролитическому электрофильному
механизму. Вначале электронодефицитный
атом водорода молекулы галогеноводорода
атакует π-электроны двойной связи алкена
с образованием карбокатиона, который
затем реагирует с отрицательно заряженным
ионом галогена, образуя конечный продукт
присоединения. Реакционная способность
галогеноводородов с алкенами возрастает
в ряду: HF < HCl < HBr < HI. Присоединение
галогеноводородов к несимметричным
алкенам проходит региоселективно, то
есть образуется преимущественно один
из двух возможных продуктов реакции.
Так, в результате присоединения НВr к
пропену образуется преимущественно
2-бромпропан, но не 1-бромпропан. В 1869
году русский химик Марковников
установил закономерность, определяющую
направление присоединения галогеноводородов
и родственных им соединений (серной
кислоты, воды в присутствии минеральных
кислот) по месту двойной связи алкенов,
которая получила название «правила
Марковникова». Сущность этого правила
может быть сформулирована следующим
образом. При взаимодействии галогеноводородов
и родственных им соединений с
несимметричными алкенами атом водорода
присоединяется по месту разрыва двойной
связи к более гидрогенизованному атому
углерода, то есть атому углерода,
содержащему большее число атомов
водорода. Такая направленность
присоединения определяется поляризацией
молекулы несимметричного алкена в
нереагирующем состоянии (статический
фактор) и относительной устойчивостью
образующихся на первой стадии реакции
карбокатионов (динамический фактор).
Влияние статического фактора состоит
в том, что в нереагирующей молекуле
несимметричного алкена вследствие
+I-эффекта и σ,π-сопряжения со стороны
алкильных групп π-электронная плотность
двойной связи смещена к более
гидрогенизованному ненасыщенному атому
углерода. Это определяет наиболее
вероятное место присоединения протона.
Влияние динамического фактора обусловлено
тем, что из двух возможных вариантов
присоединения протона к несимметричному
алкену преимущественно реализуется
тот, при котором в качестве промежуточного
продукта присоединения образуется
более устойчивый карбокатион. Более
устойчивому карбокатиону отвечает
переходное состояние с меньшей энергией,
а это обеспечивает бóльшую скорость
реакции. Делокализация положительного
заряда, а следовательно, и устойчивость
карбокатиона возрастают с увеличением
числа алкильных групп, поэтому третичные
карбокатионы устойчивее вторичных, а
те, в свою очередь, устойчивее первичных.
Поэтому не трудно заметить, что
присоединение НВr к 2-метилпропену будет
протекать преимущественно по направлению
а:
Эта
реакция широко используется в
фармацевтическом анализе для качественного
и количественного определения соединений,
содержащих двойную углерод-углеродную
связь. Присоединение галогеноводородов
(гидрогалогенирование). Алкены присоединяют
по месту разрыва двойной связи
галогеноводороды, образуя галогеналканы.
Реакция с НI, НВг, НF протекает при
комнатной температуре, взаимодействие
с НСl требует нагревания. Присоединение
галогеноводородов к алкенам, как и
присоединение галогенов, происходит
по гетеролитическому электрофильному
механизму. Вначале электронодефицитный
атом водорода молекулы галогеноводорода
атакует π-электроны двойной связи алкена
с образованием карбокатиона, который
затем реагирует с отрицательно заряженным
ионом галогена, образуя конечный продукт
присоединения. Реакционная способность
галогеноводородов с алкенами возрастает
в ряду: HF < HCl < HBr < HI. Присоединение
галогеноводородов к несимметричным
алкенам проходит региоселективно, то
есть образуется преимущественно один
из двух возможных продуктов реакции.
Так, в результате присоединения НВr к
пропену образуется преимущественно
2-бромпропан, но не 1-бромпропан. В 1869
году русский химик Марковников
установил закономерность, определяющую
направление присоединения галогеноводородов
и родственных им соединений (серной
кислоты, воды в присутствии минеральных
кислот) по месту двойной связи алкенов,
которая получила название «правила
Марковникова». Сущность этого правила
может быть сформулирована следующим
образом. При взаимодействии галогеноводородов
и родственных им соединений с
несимметричными алкенами атом водорода
присоединяется по месту разрыва двойной
связи к более гидрогенизованному атому
углерода, то есть атому углерода,
содержащему большее число атомов
водорода. Такая направленность
присоединения определяется поляризацией
молекулы несимметричного алкена в
нереагирующем состоянии (статический
фактор) и относительной устойчивостью
образующихся на первой стадии реакции
карбокатионов (динамический фактор).
Влияние статического фактора состоит
в том, что в нереагирующей молекуле
несимметричного алкена вследствие
+I-эффекта и σ,π-сопряжения со стороны
алкильных групп π-электронная плотность
двойной связи смещена к более
гидрогенизованному ненасыщенному атому
углерода. Это определяет наиболее
вероятное место присоединения протона.
Влияние динамического фактора обусловлено
тем, что из двух возможных вариантов
присоединения протона к несимметричному
алкену преимущественно реализуется
тот, при котором в качестве промежуточного
продукта присоединения образуется
более устойчивый карбокатион. Более
устойчивому карбокатиону отвечает
переходное состояние с меньшей энергией,
а это обеспечивает бóльшую скорость
реакции. Делокализация положительного
заряда, а следовательно, и устойчивость
карбокатиона возрастают с увеличением
числа алкильных групп, поэтому третичные
карбокатионы устойчивее вторичных, а
те, в свою очередь, устойчивее первичных.
Поэтому не трудно заметить, что
присоединение НВr к 2-метилпропену будет
протекать преимущественно по направлению
а:
 .
Следует отметить, что правило Марковникова
соблюдается не всегда. Так, в присутствии
пероксидов присоединение бромоводорода
к несимметричным алкенам происходит
по свободнорадикальному механизму с
ориентацией против правила Марковникова:
.
Следует отметить, что правило Марковникова
соблюдается не всегда. Так, в присутствии
пероксидов присоединение бромоводорода
к несимметричным алкенам происходит
по свободнорадикальному механизму с
ориентацией против правила Марковникова:
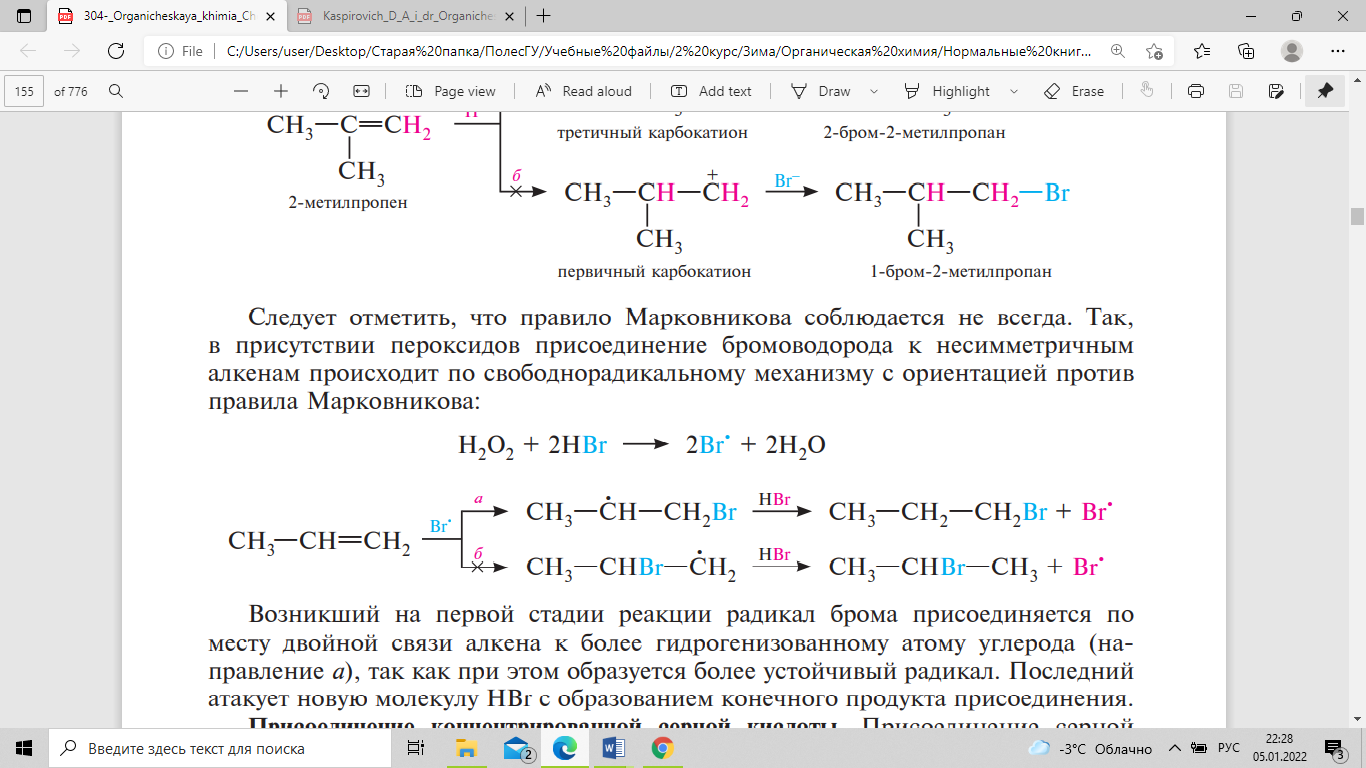 Возникший
на первой стадии реакции радикал брома
присоединяется по месту двойной связи
алкена к более гидрогенизованному атому
углерода (направление а), так как при
этом образуется более устойчивый
радикал. Последний атакует новую молекулу
НВr с образованием конечного продукта
присоединения. В присутствии минеральных
кислот — серной, азотной, хлорной и
других — алкены присоединяют по месту
разрыва двойной связи воду.
Реакция протекает в соответствии с
правилом Марковникова и приводит к
образованию спиртов. Аналогично
присоединению галогеноводородов
гидратация алкенов протекает по ионному
электрофильному механизму с первоначальной
атакой протона. Реакция используется
в промышленном синтезе спиртов.
Возникший
на первой стадии реакции радикал брома
присоединяется по месту двойной связи
алкена к более гидрогенизованному атому
углерода (направление а), так как при
этом образуется более устойчивый
радикал. Последний атакует новую молекулу
НВr с образованием конечного продукта
присоединения. В присутствии минеральных
кислот — серной, азотной, хлорной и
других — алкены присоединяют по месту
разрыва двойной связи воду.
Реакция протекает в соответствии с
правилом Марковникова и приводит к
образованию спиртов. Аналогично
присоединению галогеноводородов
гидратация алкенов протекает по ионному
электрофильному механизму с первоначальной
атакой протона. Реакция используется
в промышленном синтезе спиртов.
