
ФИЗическая химия
.docxПоказатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения, получаем:
![]()
![]()
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lga, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации
![]()
37.
Хроматогра́фия (от др.-греч. χρῶμα — цвет) — динамический сорбционный метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной (газовая или жидкая фаза, элюент). Название метода связано с первыми экспериментами по хроматографии, в ходе которых разработчик метода Михаил Цвет разделял ярко окрашенные растительные пигменты.
Ионный обмен — это обратимая химическая реакция, при которой происходит обмен ионами между твердым веществом (ионитом) и раствором электролита. Ионный обмен может происходить как в гомогенной среде (истинный раствор нескольких электролитов), так и в гетерогенной, в которой один из электролитов является твёрдым (при контакте раствора электролита с осадком, ионитом и др.).
катионит (катионообменная смола)
анионит (анионообменная смола)
Катиониты Катиониты представляют собой специально синтезированные полимерные нерастворимые в воде вещества, содержащие в своей структуре ионогенные группы кислотного характера, например, SO3Na (сильнокислотный катионит).
Аниониты Аниониты представляют собой специально синтезированные полимерные нерастворимые в воде вещества, содержащие в своей структуре ионогенные группы основного характера (сильноосновной анионит).
Ионообменные смолы бывают гетеропористые, макропористые и изопористые.
Гетеропористые ионообменные смолы В качестве основы используется дивинилбензол, и характеризуются гетерогенным характером гелевидной структуры и небольшими размерами пор.
Макропористые ионообменные смолы имеют губчатую структуру и поры свыше молекулярного размера.
Изопористые ионообменные смолы имеют однородную структуру и полностью состоят из смолы, поэтому их обменная способность выше, чем у предыдущих смол.
Качество катионитов характеризуется их физическими свойствами, химической и термической стойкостью, рабочей обменной емкостью и др. Физические свойства катионитов зависят от их фракционного состава, механической прочности и насыпной плотности (набухаемости). Фракционный (или зерновой) состав характеризует эксплуатационные свойства катионитов. Он определяется ситовым анализом. При этом учитываются средний размер зерен, степень однородности и количество пылевидных частиц, непригодных к использованию.
Мелкозернистые катиониты и аниониты, обладая более развитой поверхностью, имеет несколько большую обменную емкость, чем крупно-зернистый. Однако с уменьшением зерен катионита гидравлическое сопротивление и расход электроэнергии на фильтрование воды увеличиваются. Оптимальные размеры зерен катионита, исходя из этих соображений, принимают в пределах 0,3...1,5 мм. Рекомендуется применять катиониты с коэффициентом неоднородности Кн = 2.
38.
Экстра́кция (от лат. extraho — извлекаю) — метод извлечения вещества из раствора или сухой смеси с помощью подходящего растворителя (экстраге́нта). Для извлечения из раствора применяются растворители, не смешивающиеся с этим раствором, но в которых вещество растворяется лучше, чем в первом растворителе.
Нернста закон распределения определяет относительное содержание в двух несмешивающихся или ограниченно смешивающихся жидкостях растворимого в них компонента; является одним из законов идеальных разбавленных растворов. Открыт в 1890 В. Нернстом. Согласно Н. з. р., при равновесии отношение концентраций третьего компонента в двух жидких фазах является постоянной величиной. Н. з. р. может быть записан в виде c1/c2 = k, где c1 и c2 — равновесные молярные концентрации третьего компонента в первой и второй фазах; постоянная k — коэффициент распределения, зависящий от температуры. Н. з. р. позволяет определить более выгодные условия экстрагирования веществ из растворов.
39.
Экстра́кция (от лат. extraho — извлекаю) — метод извлечения вещества из раствора или сухой смеси с помощью подходящего растворителя (экстраге́нта). Для извлечения из раствора применяются растворители, не смешивающиеся с этим раствором, но в которых вещество растворяется лучше, чем в первом растворителе.
Экстракция может быть разовой (однократной или многократной) или непрерывной (перколя́ция).
Простейший способ экстракции из раствора — однократная или многократная промывка экстрагентом в делительной воронке. Делительная воронка представляет собой сосуд с пробкой и краном для слива нижнего слоя жидкости. Для непрерывной экстракции используются специальные аппараты — экстракторы, или перколяторы.
Для извлечения индивидуального вещества или определённой смеси (экстракта) из сухих продуктов в лабораториях широко применяется непрерывная экстракция по Сокслету.
В лабораторной практике химического синтеза экстракция может применяться для выделения чистого вещества из реакционной смеси или для непрерывного удаления одного из продуктов реакции из реакционной смеси в ходе синтеза.
Экстракция применяется в химической, нефтеперерабатывающей, пищевой, металлургической, фармацевтической и других отраслях, в аналитической химии и химическом синтезе.
40.
При неограниченной растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента.
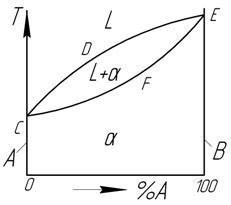
Рисунок 1 – Диаграмма состояний сплавов
с неограниченной растворимостью компонентов
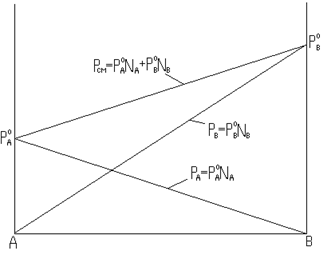
Зависимость
парциального и общего давления паров
смеси от ее состава показана на рис.
8.3, где на оси ординат отложено давление
насыщенных паров, а на оси абсцисс –
состав раствора в мольных долях. При
этом по оси абсцисс содержание одного
вещества (А) убывает слева направо от
1,0 до 0 мольных долей, а содержание
второго компонента (В) одновременно в
том же направлении увеличивается от 0
до 1,0. При каждом определенном составе
общее давление насыщенного пара
равняется сумме парциальных давлений.
Общее давление смеси изменяется от
давления насыщенного пара одной
индивидуальной жидкости
![]() до
давления насыщенного пара второй чистой
жидкости
до
давления насыщенного пара второй чистой
жидкости![]() .
Законы
Рауля и Дальтона часто используются
для оценки пожарной опасности смесей
жидкостей.
.
Законы
Рауля и Дальтона часто используются
для оценки пожарной опасности смесей
жидкостей.
Эвте́ктика (греч. éutektos — легкоплавящийся) — нонвариантная (при постоянном давлении) точка в системе из n компонентов, в которой находятся в равновесии n твердых фаз и жидкая фаза. Эвтектическая композиция представляет собой жидкий раствор, кристаллизующийся при наиболее низкой температуре для сплавов данной системы. Соответственно, температура плавления сплава эвтектического состава — также самая низкая, по сравнению со сплавами другого состава для данной системы компонентов. Это явление как раз и отражает этимологию термина.
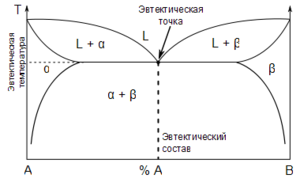
Бинарная фазовая диаграмма с эвтектическим превращением
Добавляя или отводя тепло, можно изменить пропорцию между кристаллическими фазами и расплавом в эвтектической точке без изменения температуры. После кристаллизации эвтектика становится смесью кристаллитов фаз. Одновременное образование нескольких кристаллических фаз в ходе эвтектической кристаллизации обуславливет возможность их кооперативного роста. В результате последнего образуются эвтектические бикристаллы — разветвлённые взаимновложенные дендриты эвтектических фаз, лишь выглядящие в сечении как мелкодисперсная смесь.
Эвтектика является пересечением поверхностей насыщения расплава с фазами, с которыми он находится в равновесии. Если отводится соответствующее количество тепла, то расплав эвтектического состава при кристаллизации в условиях близких к равновесным даст все кристаллические фазы, участвующие в равновесии. Если же при сохранении эвтектической температуры подводится тепло в достаточном количестве, то смесь фаз, отвечающая эвтектическому составу, в равновесных условиях полностью расплавится.
41.
Сегрегация — изменение физического состояния неоднородной среды
Поверхностная сегрегация — явление изменения состава, структуры и свойств поверхностных слоёв атомов вещества в конденсированном, то есть в твёрдом или жидком состояниях.
Причина поверхностной сегрегации — резкое изменение атомной структуры (уменьшение числа соседних атомов) в поверхности по сравнению с объёмом. Вместе с тем у поверхностных атомов остается стремление к достижению минимума свободной энергии. Поэтому явление поверхностной сегрегации охватывает и ряд других явлений: поверхностные реконструкции, релаксации, поверхностные фазы.
Поверхностные реконструкции — явления, происходящие в одном атомном слое. Обычно связаны с увеличением числа соседних атомов в приповерхностных слоях. Например, вместо 4-х ближайших соседних атомов — шесть.
Если эффективный коэффициент распределения примеси близок к единице и процесс очистки требует больших затрат времени и энергии, прибегают к различным приемам. Например, в расплавленную зону добавляют третий компонент, который не смешивается с очищаемым веществом, но растворяет примеси. Иногда добавляют третий компонент, образующий с основным компонентом эвтектическую смесь, в результате чего отделение примеси производится не от самого вещества, а от образующейся эвтектики. После такой очистки от примеси добавленный компонент удаляется отгонкой или другим каким-либо методом.
42.
Пра́вило фаз (или правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе.
Уравнение Гиббса
Правило фаз записывается следующим образом:
![]()
где j
— число фаз (например, агрегатных состояний вещества);
v — число степеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз;
k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы.
n — число переменных, характеризующих влияние внешних условий на равновесие системы.
При переменных давлении и температуре правило фаз сводится к выражению:
![]()
В случае однокомпонентной системы оно упрощается до:
![]() ,
,
Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия.
Иногда правило фаз записывают следующим образом:
![]()
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2.
Тройна́я то́чка воды́ — строго определенные значения температуры и давления, при которых вода может одновременно и равновесно существовать в виде трёх фаз — в твердом, жидком и газообразном состояниях. Тройная точка воды — температура 273,16 К и давление 611,657 Па[1].
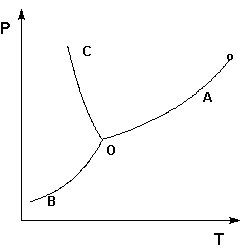 Фазовые
переходы первого рода — фазовые
переходы, при которых скачком
изменяются первые производные
термодинамических
потенциалов по интенсивным
параметрам системы (температуре или
давлению). Переходы первого рода
реализуются как при переходе системы
из одного агрегатного состояния в
другое, так и при в пределах одного
агрегатного состояния (в отличие от
фазовых
переходов второго рода, которые
происходят в пределах одного агрегатного
состояния).
Фазовые
переходы первого рода — фазовые
переходы, при которых скачком
изменяются первые производные
термодинамических
потенциалов по интенсивным
параметрам системы (температуре или
давлению). Переходы первого рода
реализуются как при переходе системы
из одного агрегатного состояния в
другое, так и при в пределах одного
агрегатного состояния (в отличие от
фазовых
переходов второго рода, которые
происходят в пределах одного агрегатного
состояния).
Фазовые переходы второго рода — фазовые переходы, при которых первые производные термодинамических потенциалов по давлению и температуре изменяются непрерывно, тогда как их вторые производные испытывают скачок. Отсюда следует, в частности, что энергия и объём вещества при фазовом переходе второго рода не изменяются, но изменяются его теплоёмкость, сжимаемость, различные восприимчивости и т. д.
43.
Процессы перегонки через газовую фазу лежат в основе очистки простых веществ (элементов) и химических соединений, обладающих высокой упругостью паров, например фосфора, сурьмы, серы, магния, кальция, цинка, жидких хлоридов элементов, промежуточных продуктов в производстве полупроводниковых и диэлектрических материалов в форме летучих соединений, например низших галогенидов, и т.д.
Разделение и очистка веществ сублимацией н дистилляцией. Сублимация (или возгонка) представляет собой процесс непосредственного перехода вещества из твердого состояния в парообразное. Сублимация как метод разделения и очистки возможна для тех веществ, которые, будучи нагреты до температуры ниже точки плавления, характеризуются достаточно высокими давлениями паров. При наличии в веществе набора примесей более летучие по сравнению с основным веществом примеси могут быть отогнаны при низкой температуре, а примеси, менее летучие, сосредоточены в остатке после возгонки основного компонента.
Дистилляция представляет собой процесс разделения жидкого раствора на его составные части, характеризующиеся различием в давлениях паров, путем их испарения с последующей конденсацией образовавшихся паров.
Рассмотрим основы разделения и очистки веществ испарением и конденсацией на примере двойной системы, состоящей из компонентов А и В, образующих непрерывный ряд твердых и жидких растворов.
Если компоненты А и В очень близки между собой по составу, размеру и строению молекул, а следовательно, и по свойствам и, кроме того, не образуют между собой соединений и не ассоциированы, то парциальное давление насыщенного пара каждого компонента над раствором при постоянной температуре будет пропорционально мольной доле его в растворе, т.е.
P = N*P°, (2.17)
P=N*P°, (2.18)
где Ра и Р% — парциальные давления паров компонентов А и В над раствором; N и N— их мольные доли в растворе; Р и Р — давления паров чистых компонентов Aw В. Общее давление Рдв. пара, равновесного с раствором.
44.
Диаграмма равновесия жидкость-пар
При р = const каждому составу жидкой смеси отвечает определенная температура равновесия с паром и определенный состав пара, отличающийся, как правило, от состава жидкой смеси. На диаграмме состояния (рис. 8, а) кривые кипения и конденсации изображают зависимости температур начала кипения и конденсации от состава и отделяют поля жидкости L и пара V от поля (L + V) гетерогенных состояний жидкость-пар. На кривой кипения может быть экстремум: максимум (рис. 8, б) или минимум (рис. 8, в); в этих точках кривая кипения касается кривой конденсации, т.е. составы равновесных жидкости и пара совпадают. Жидкие смеси такого состава полностью выкипают, подобно чистым жидкостям, при постоянной температуре без изменения состава (см. Азеотропные смеси). Диаграммы состояния, описывающие равновесия двухкомпонентных твердых растворов с жидкими растворами и жидких растворов с паром, подобны.
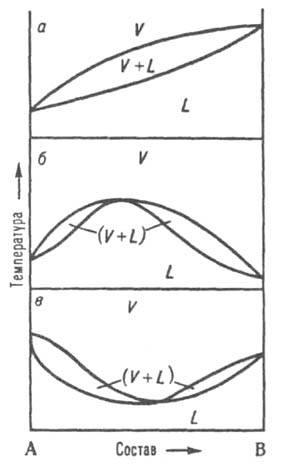
Рис. 8. Диаграммы состояния, двойной системы, описывающие равновесие жидкость - пар. L и V - области существования жидкости и пара соответственно. (L + V) - область сосуществования жидкой и паровой фаз; а - система без азеотропной точки; б и в - два типа азеотропных смесей.
Тройные системы.
Состояния тройных систем однозначно определяются четырьмя независимыми параметрами: Т, р и молярными (массовыми) долями двух компонентов (доля третьего компонента определяется из условия равенства единице суммы долей всех компонентов). Поэтому при построении диаграммы состояния тройных систем один из независимых параметров (р или Т) или два (р и T) фиксируют и рассматривают пространственные изобарные или изотермические диаграммы или плоские изобарно-изотермические диаграммы, соответствующие одному из сечений пространственной диаграммы состояния. Каждому составу тройной смеси отвечает определенная точка на плоскости составов. Область возможных составов тройных систем называется композиционным треугольником или треугольником составов. В системе прямоугольных координат он представляет собой прямоугольный равнобедренный треугольник, вершины которого отвечают компонентам А, В и С, а стороны - двойным смесям АВ, ВС и СА. Более распространено использование равностороннего композиционного треугольника. В этом случае все компоненты равноправны, а за начало координат можно с равным основанием принять любую из его вершин (см. Многокомпонентные системы).
Азеотропные смеси (азеотропы) (от греч. а--приставка, означающая отрицание или отсутствие какого-либо свойства, изменение), жидкие смеси , характеризующиеся равенством составов равновесных жидкой и паровой фаз. При их перегонке образуется конденсат того же состава, что и исходный раствор; поэтому азеотропные смеси называют также нераздельнокипящими. Наличие азеотропных смесей существенно затрудняет разделение жидких смесей и требует применения специальных методов ректификации.
Азеотропные смеси встречаются как в двойных, так и в многокомпонентных системах. Некоторые вещества особенно склонны к образованию азеотропных смесей, особенно с представителями какого-либо одного гомологического ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из различных рядов могут образовывать между собой большое число двух- и многокомпонентных азеотропных смесей, охватывающих широкий концентрационный интервал.
Известно ок. 10 000 систем с азеотропных смесей, что составляет примерно половину всех изученных смесей. Поэтому изучение свойств систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и критическом состоянии. Такие сведения особенно важны для химической и нефтехимической отраслей промышленности, поскольку в их исходных материалах, промежуточных или конечных продуктах почти всегда имеются системы с азеотропными смесями, а технологические процессы часто проводятся при повышенных температурах и давлениях. т.е. вблизи критических параметров и в закритической области.
45.
Ректификация (от лат. rectus — прямой и facio — делаю) — это процесс разделения бинарных или многокомпонентных смесей за счет противоточного массо- и теплообмена между паром и жидкостью. Ректификацию можно проводить периодически или непрерывно. Ректификацию проводят в башенных колонных аппаратах, снабженных контактными устройствами (тарелками или насадкой) ректификационных колоннах.
Ректификация (от позднелатинского rectification – выпрямление, исправление), разделение жидких смесей на практически чистые компоненты, отличающиеся температурами кипения, путем многократных испарения жидкости и конденсации паров. В этом основное отличие ректификации от дистилляции, при которой в результате однократного цикла частичное испарение – конденсация достигается лишь предварительное (грубое) разделение жидких смесей.
Коэффициент разделения зависит только от отношения коэффициентов распределения двух растворенных веществ между растворителем и газом-носителем, и величину его можно подобрать, выбирая неподвижную жидкую фазу или изменяя температуру колонки. Коэффициенты разделения для членов гомологического ряда, как правило, уменьшаются с повышением температуры, но это правило не является универсальным.
46.
ХИМИЧЕСКИЕ ТРАНСПОРТНЫЕ РЕАКЦИИ - обратимые химические реакции, сопровождающиеся переносом исходного твердого или жидкого вещества из одной температурной зоны в другую в результате образования и разложения промежуточных газообразных соединений. Применяют для очистки цветных, редких и рассеянных металлов, при получении полупроводников, монокристаллов, эпитаксиальных и монокристаллических пленок и др.
47.
Кристаллизация, переход вещества из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое, а также из одного кристаллического состояния в другое (рекристаллизация, или вторичная кристаллизация); фазовый переход первого рода. Кристаллизация из жидкой или газовой фазы - экзотермический процесс, при котором выделяется теплота фазового перехода, или теплота кристаллизация; при этом изменение энтропии в большинстве случаев составляет [в Дж/(моль.К)]: для простых веществ 5-12, для неорганических соединений 20 - 30, для органических соединений 40-60. Рекристаллизация может протекать с выделением либо поглощением теплоты. В промышленности и лаб. практике кристаллизация используют для получения продуктов с заданными составом, содержанием примесей, размерами, формой и дефектностью кристаллов (см. Дефекты. Кристаллическая структура. Кристаллы), а также для фракционного разделения смесей, выращивания монокристаллов и др.
48.
Легирование объемных кристаллов из жидкой фазы
Рассмотрим особенности легирования кристаллов в процессе их выращивания из жидкой фазы. Широко применяемым методом получения легированных монокристаллов полупроводников является выращивание их из расплава, к которому добавлена нужная примесь.
Общие принципы такого легирования заключаются в следующем. Навеска примеси pi, подлежащая введению в расплав или жидкую зону для получения в твердом кристалле концентрации Ni, рассчитывается по формуле, определяющей коэффициент разделения примеси.
K0 = CS/CL = NiMiVL/NApi,
pi = NiMiVL/K0NA, (1)
где Mi — атомный вес примесного элемента, NA — число Авогадро, VL — объем расплава.
При выборе примесей для легирования необходимо учитывать величину коэффициента разделения и ее изменение при изменении условий выращивания. Эти факторы являются чрезвычайно важными для получения монокристаллов с равномерным распределением примесей из-за принципиальной однократности процесса легирования и невозможности исправления ошибок в дозировании примеси.
Пусть, для определенности, K0 < 1. Тогда если скорость роста кристалла V больше, чем скорость выравнивания состава в жидкой фазе, то из-за оттеснения примеси из твердой фазы в жидкую и замедленности диффузионных процессов установления равновесия в жидкой фазе концентрация примеси в расплаве у границы раздела будет возрастать.
Накопление избытка примеси приведет к образованию перед движущимся фронтом кристаллизации диффузионного слоя δ, из которого примесь путем диффузии переходит в объем расплава. Если K0 > 1, то вблизи поверхности роста ощущается недостаток примеси. Таким образом, от равновесного коэффициента разделения K0 мы переходим к эффективному K и учитываем влияние условий выращивания на процессы легирования:
K(f,D, δ) = K0/[K0 + (1 − K0) exp(−Vδ/D)], (2)
где D — коэффициент диффузии примеси в расплаве
В некоторых случаях, если характер перемешивания расплава задан, определение значения δ возможно аналитически. Так, если при получении легированных кристаллов методом Чохральского перемешивание расплава осуществляется вращением кристалла и тигля вокруг своих осей во встречных направлениях с угловыми скоростями ωк и ωт, то значение δ при невысоких скоростях роста V может быть определено по формуле
δ = AD1/3ν1/6(ωк + ωт)−1/2, (3)
где A — постоянная, принимающая значение от 1.3 до 1.6, а ν — кинематическая вязкость расплава.
Зависимость K от V показана на рис.1 для двух скоростей вращения и трех значений равновесного коэффициента разделения K0. Видно, что только при скоростях V < 4 · 10−3 см/с можно говорить о совпадении K и K0. Из рисунка также видно, сколь важно вращение расплава и (или) кристалла для выравнивания концентрации примеси в расплаве.
Особенно это важно в условиях зонной плавки: без перемешивания расплава δ может достигать размеров зоны. При δ = 1 см K и K0 становятся сопоставимы по величине только при V < 10−4 см/с. Именно поэтому скорости выращивания кристаллов в методе зонной плавки значительно меньше, чем при вытягивании кристалла из расплава.
При выборе примеси чрезвычайно важным является учет ее чистоты, так как попадание в растущий кристалл вместе с легирующей примесью неконтролируемых сопутствующих примесей даже в очень малых количествах может приводить к существенному ухудшению параметров выращиваемых кристаллов (например, существенно снижать время жизни неосновных носителей заряда). Поэтому перед легированием оценивают требуемую чистоту легирующего элемента с учетом особенностей используемого метода легирования и допустимого содержания в легируемом кристалле посторонних примесей.

Рис. 1. Зависимость K от скорости кристаллизации V при разных скоростях вращения расплава и кристалла.
 твердой
фазы
твердой
фазы
49.
Леги́рование (нем. legieren — «сплавлять», от лат. ligare — «связывать») — добавление в состав материалов примесей для изменения (улучшения) физических и химических свойств основного материала. Легирование является обобщающим понятием ряда технологических процедур, различают объёмное (металлургическое) и поверхностное (ионное, диффузное и др.) легирование.
