
ФИЗическая химия
.docx3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
|
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
19. ГИББСА - ГЕЛЬМГОЛЬЦА УРАВНЕНИЯ - термо-динамич. соотношения, устанавливающие связь между внутренней энергией U и Гелъмголъца энергией (свободной энергией) F или между энтальпией H и Гиббса энергией (свободной энтальпией) G:
где T - темп-pa, V - объём, P - давление. Установлены в 1875 Дж. У. Гиббсом, ур-ние (1) использовал Г. Гельмгольц (H. Helmholtz). Ур-ние
(1) следует из определения энергии
Гельмгольца F=U-TS
и выражения для энтропии
Макс.
работа, к-рую может совершить система
в тепловом контакте с окружающей
средой
Эта
макс. работа за вычетом работы против
сил давления P(V2-
V1)(максимальная
полезная работа)
20.
где L — удельная теплота фазового перехода, Δv — изменение удельного объёма тела при фазовом переходе. Между
температурой фазового перехода и
внешним давлением существует
функциональная связь, причём при
фазовом переходе производная
δA = dp(V2 − V1) Сообщённая теплота равна δQ = Lm где L — удельная теплота фазового перехода, m — масса тела. Согласно теореме Карно,
Отсюда
|
21.
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Теорема Нернста (тепловая теорема Нернста) - утверждение, являющееся одной из формулировок третьего начала термодинамики, сформулированное Вальтером Нернстом в 1906 году как обобщение экспериментальных данных по термодинамике гальванических элементов.
Теорема
Нернста утверждает, что всякий
термодинамический процесс, протекающий
при фиксированной температуре T в сколь
угодно близкой к нулю,
![]() ,
не должен сопровождаться изменением
энтропии S, то есть изотерма T
= 0
совпадает с предельной адиабатой S0.
,
не должен сопровождаться изменением
энтропии S, то есть изотерма T
= 0
совпадает с предельной адиабатой S0.
В 1911 г. Макс Планк предложил следующий постулат: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю . Этот постулат может быть объяснен статистической термодинамикой , согласно которой энтропия есть мера беспорядочности системы на микроуровне .
![]()
22.
Существование абсолютно чистых веществ невозможно – всякое вещество обязательно содержит примеси, или, иными словами, всякая гомогенная система многокомпонентна. Если имеющиеся в веществе примеси в пределах точности описания системы не оказывают влияния на изучаемые свойства, можно считать систему однокомпонентной; в противном случае гомогенную систему считают раствором.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми смесями). Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве либо компонент, кристаллизующийся первым при охлаждении раствора; если одним из компонентов раствора является жидкое в чистом виде вещество, а остальными – твердые вещества либо газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит поэтому условный характер.
Одной из важнейших характеристик раствора является его состав, описываемый с помощью понятия концентрация раствора. Ниже дается определение наиболее распространенных способов выражения концентрации и формулы для пересчета одних концентраций в другие, где индексы А и В относятся соответственно к растворителю и растворенному веществу.
Молярная концентрация С – число молей νВ растворенного вещества в одном литре раствора.
Нормальная концентрация N – число молей эквивалентов растворенного вещества (равное числу молей νВ, умноженному на фактор эквивалентности f) в одном литре раствора.
Моляльная концентрация m – число молей растворенного вещества в одном килограмме растворителя.
Процентная концентрация ω – число граммов растворенного вещества в 100 граммах раствора.
![]() (III.1)
(III.1)
![]() (III.2)
(III.2)
![]() (III.3)
(III.3)
Еще одним способом выражения концентрации является мольная доля X – отношение числа молей данного компонента к общему числу молей всех компонентов в системе.
![]() (III.4)
(III.4)
Истинный (молекулярный) раствор - это разновидность растворов в котором размеры частиц растворенного вещества предельно малы и сопоставимы с размером частиц растворителя. Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более составных частей. Относительные количества компонентов раствора могут изменяться в широких пределах. Наиболее важный вид растворов в жизни человека - жидкие растворы. Такими растворами являются все жидкости организма. С жидкими растворами усваиваются в системе пищеварения питательные вещества. Всякий раствор состоит из дисперсной фазы, или растворенных веществ и дисперсионной (непрерывной) фазы, или растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде частиц, молекул или ионов. Растворяемые вещества, в зависимости от их способности проходить через частично проницаемую (полупроницаемую, пергаментную) мембрану, разделяют на два типа: кристаллоиды и коллоиды (1861 г., Т. Грэм, Thomas Graham, 1805 ¸ 1869, британский химик, основатель коллоидной химии). Растворителем большинства жидких растворов организма является вода. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве. Свойства любого водного раствора зависят от размера частиц растворенного вещества и от их реакции на действие силы тяжести. По этим признакам различают три типа растворов: истинные растворы, коллоидные растворы и суспензии или эмульсии. В истинных растворах размеры частиц растворенного вещества малы. Они сравнимы с размерами молекул растворителя (воды). Истинный раствор является гомогенной (однородной) системой, практически состоящей из одной фазы. Частицы истинного раствора не разделяются под действием силы тяжести. Истинными растворами организма являются, например, растворы солей, моносахаридов. Однородность истинных растворов делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. Насыщенные растворы существуют и применяются сравнительно редко. В большинстве случаев существуют и пользуются ненасыщенные растворы, содержащие меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор. При этом растворы с низким содержанием растворенного вещества называются разбавленными, с высоким - концентрированными. Состав раствора, содержание в нем растворенных веществ может выражаться как с помощью безразмерных единиц (долей или процентов), так и через размерные величины - концентрации. Наиболее употребительны следующие величины, выражающие содержание растворенного вещества в растворе: массовая доля, молярная доля, молярная концентрация, моляльная концентрация, эквивалентная, или нормальная концентрация.
Растворитель (от латинского solvere, "ослабить") - жидкое, твёрдое или газообразное вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, которые растворяются в определённом объёме растворителя при заданной температуре. Обычно используются как органические растворители в химчистках (например, тетрахлорэтилен), как растворители (например, толуол, скипидар), для удаления лаков и клея (ацетон, метиловый, этилацетат), в моющих средствах (цитрусовые терпены), в парфюмерии (этанол) и в химическом синтезе.
ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ВЕЛИЧИНЫ, термодинамич. величины, к-рые используют для описания концентрац. зависимостей св-в р-ров. Пусть М -нек-рая экстенсивная ф-ция состояния системы из h компонентов, т. е. св-во, зависящее от массы системы (объем, внутр. энергия, энтальпия, энтропия, энергия Гиббса, энергия Гельмгольца, теплоемкость и т.п.). Для i-го компонента парциальная молярная величина Mi- определяется соотношением:
![]()
т.е.
равна производной от величины M по числу
молей
mi
компонента
i при постоянных т-ре T, давлении
p и числах молей
![]() всех
остальных компонентов. Так, парциальный
молярный объем
всех
остальных компонентов. Так, парциальный
молярный объем
![]()
где V-объем системы; парциальная молярная энергия Гиббса (химический потенциал)
![]()
где G-энергия Гиббса системы.
Парциальная молярная величина характеризует изменение величины M при добавлении к бесконечно большому кол-ву р-ра 1 моля компонента i в условиях постоянства T, p и чисел молей всех остальных компонентов. Если молярная доля xi компонента равна единице, то парциальная молярная величина Mi обращается в молярную величину Mm для индивидуального в-ва (напр., парциальный молярный объем компонента - в молярный объем). Значение Mi определяется не только природой i-го компонента, но и св-вами системы в целом, поскольку молекулы i-го компонента взаимод. со всеми др. молекулами; в неявном виде эта величина учитывает все изменения св-в системы при внесении i-го компонента.
23.
РАСЧЕТ ПАРЦИАЛЬНЫХ МОЛЯРНЫХ ВЕЛИЧИН
Для определения экстенсивного свойства однокомпонентной системы необходимо знать молярное, то есть рассчитанное на один моль компонента значение этого свойства. Зная молярное свойство и количество системы, можно получить общее значение этого свойства для всего количества системы.
Для характеристики отдельных компонентов в многокомпонентных растворах используют парциальные величины, определяющие некоторое свойство каждого компонента. Для определения парциальной молярной величины воспользуемся уравнением, определяющим функциональную зависимость некоторого экстенсивного параметра L состояния системы:
![]() (1)
(1)
где
Т, Р – температура и давление и
![]() -
число молей i
– го компонента.
-
число молей i
– го компонента.
Например, для объема V:
![]()
Таким образом, многокомпонентная система может быть полностью характеризована числом молей всех ее компонентов, температурой и давлением.
Отметим,
что экстенсивное свойство является
функцией состояния, то есть ее бесконечно
малое приращение есть полный дифференциал.
Тогда из уравнения (1) следует:![]()
![]()
Хими́ческий потенциа́л μ — один из термодинамических параметров системы, а именно энергия добавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
![]()
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
Эта формула определяет, кроме химического потенциала μ, также давление P и температуру T.
Можно доказать, что химический потенциал задаётся формулой
![]() ,
,
где G — потенциал Гиббса.
Если энергия системы зависит не от объёма, а от других термодинамических параметров A1,A2..., исходная формула принимает вид
![]()
Если в системе имеется несколько разных типов частиц, есть столько же разных химических потенциалов.
24.
ГИББСА-ДЮГЕМА
УРАВНЕНИЕ,
связывает изменения т-ры Т, давления
р и хим. потенциалов![]() компонентов равновесных термодинамич.
систем. В общем виде записывается в
форме:
компонентов равновесных термодинамич.
систем. В общем виде записывается в
форме:

![]()
где
5 и К-энтропия и объем системы соотв.,
ni-число
молей
i-того компонента. Для процессов,
происходящих при постоянных Т и р,
Гиббса - Дюгема уравнение устанавливает
связь между изменениями хим. потенциалов
компонентов и Наиб. широко используется
в термодинамике
р-ров. Для р-ров неэлектролитов
употребительны след. формы ур-ния:
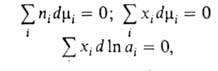
где![]() -молярная доля i-того компонента, аi-его
активность,
связанная с
-молярная доля i-того компонента, аi-его
активность,
связанная с![]() соотношением:
соотношением:
![]()
![]() -хим.
потенциал компонента в стандартном
состоянии,
R-газовая постоянная). Форма записи
Гиббса - Дюгема уравнения для коэффициентов
активности
-хим.
потенциал компонента в стандартном
состоянии,
R-газовая постоянная). Форма записи
Гиббса - Дюгема уравнения для коэффициентов
активности![]() зависит
от способа выражения концентрации
(в молярных долях, молярности
или моляльности).
При выражении концентрации
в молярных долях для р-ров неэлектролитов
зависит
от способа выражения концентрации
(в молярных долях, молярности
или моляльности).
При выражении концентрации
в молярных долях для р-ров неэлектролитов![]() и Гиббса - Дюгема уравнение имеет вид:
Для р-ров электролитов
разработаны спец. формы
и Гиббса - Дюгема уравнение имеет вид:
Для р-ров электролитов
разработаны спец. формы![]() записи Гиббса - Дюгема уравнения.
записи Гиббса - Дюгема уравнения.
Гиббса - Дюгема уравнение позволяет определять зависимость от состава хим. потенциала, активности или коэф. активности одного из компонентов бинарного р-ра, если подобная зависимость известна для др. компонента (в случае многокомпонентных р-ров-для всех остальных компонентов). Гиббса - Дюгема уравнение применяют также для определения активности компонентов бинарного р-ра по данным о равновесном общем давлении пара над р-ром при данной Т.; с его помощью проверяют термодинамич. согласованность экспериментально определенных значений активности в-в (см. Активность термодинамическая).
25.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Реальные растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций.
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]()
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
![]()
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Предельно разбавленный раствор получают путем последовательного разбавления исследуемого раствора чистым растворителем.
Неидеальные растворы
Все жидкие смеси обладают свойствами, которые в большей или меньшей степени отклоняются от свойств идеальных растворов. Однако лишь те смеси, которые мало отличаются от идеальных, могут быть разделены фракционной перегонкой. Такие смеси называются зеотропными. Зеотропную смесь образуют, например, бензол и метилбензол.
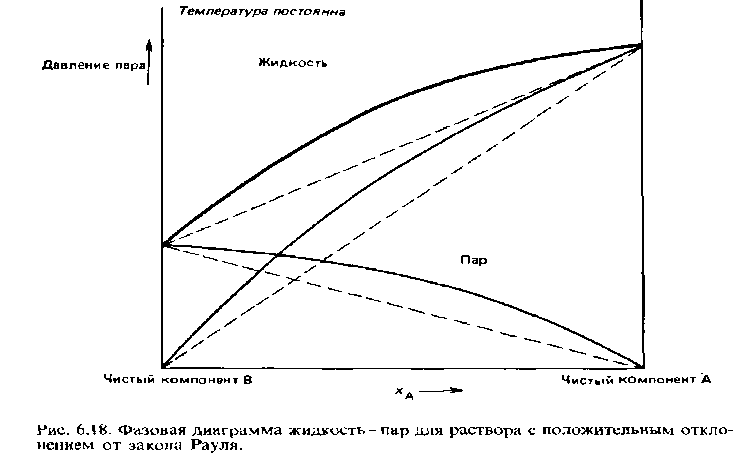
Отклонения от идеальных свойств могут быть положительными и отрицательными. Считается, что смесь, у которой давление пара больше предсказываемого законом Рауля, обнаруживает положительное отклонение от идеальных свойств. На рис. 6.18 приведена типичная фазовая диаграмма, показывающая зависимость давления пара жидкой смеси от состава для неидеального раствора с положительным отклонением от идеальных свойств. Положительные отклонения видны при сравнении кривых температур кипения со штриховыми прямыми линиями, соответствующими идеальным свойствам.
На рис. 6.19 представлена аналогичная диаграмма для неидеального раствора, который обнаруживает отрицательное отклонение от закона Рауля. Примеры двух-компонентных жидких смесей с положительными и отрицательными отклонениями от закона Рауля приведены в табл. 6.4.
Положительные отклонения могут возникать по двум причинам:
1) силы притяжения между молекулами компонентов А и В, которые можно рассматривать как связи А... В, оказываются слабее сил взаимодействия (связей) А...А и В...В;
2) при смешивании двух компонентов происходит разрыв связей А... А и В... В, которые часто являются водородными связями.
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон Генри записывается обычно следующим образом:
![]()
где:
![]() —
парциальное
давление
газа
над раствором,
—
парциальное
давление
газа
над раствором,
![]() —
концентрация
газа в растворе в долях моля,
—
концентрация
газа в растворе в долях моля,
![]() —
коэффициент
Генри.
—
коэффициент
Генри.
26.

Фугитивность – функция, характеризующая состояние данного вещества в чистом виде или в смеси с другими веществами при заданных температуре и давлении. По-другому она называется термодинамическая летучесть; является величиной, количественно характеризующей способность вещества к выходу из данной фазы, но выражающей эту характеристику в единицах давления. Для жидкостей и твердых тел она связана с давлением насыщенного пара и становится равной ему, когда к пару применимы законы идеальных газов. Для идеального газа, чтобы найти, например, изменение энергий Гиббса при изотермическом процессе, надо просто решить задачу в соответствии с уравнением Менделеева – Клапейрона:

Активность термодинамическая, величина, позволяющая представлять в удобной для практич. использования форме концентрац. зависимость химических потенциалов компонентов реального раствора. С помощью этой величины можно применять к реальному раствору термодинамич. соотношения, относящиеся к идеальному раствору, если заменить в них концентрации активностями. Отношение активности компонента к его концентрации называют коэффициентом активности.
Хим.
потенциал
![]() и
активность а,- i-того
компонента раствора по определению
связаны соотношением:
и
активность а,- i-того
компонента раствора по определению
связаны соотношением:
![]()
где
R-газовая постоянная, T - температура,
![]() -хим.потенциал
компонента в определенным образом
выбранном стандартном состоянии.
Значения
-хим.потенциал
компонента в определенным образом
выбранном стандартном состоянии.
Значения
![]() зависят
только от T и давления
р; ai
- ф-ция Т,
р и
состава р-ра, Т. обр., введение понятия
активность позволяет разделить выражение
для химического потенциала на две
части: постоянную при данных Т и р
зависят
только от T и давления
р; ai
- ф-ция Т,
р и
состава р-ра, Т. обр., введение понятия
активность позволяет разделить выражение
для химического потенциала на две
части: постоянную при данных Т и р
![]() и
зависящую от состава (RTlnai).
Это разделение условно, поскольку
численное значение ai
зависит от выбора стандартного состояния.
В стандартном
состоянии
ai
= 1.
и
зависящую от состава (RTlnai).
Это разделение условно, поскольку
численное значение ai
зависит от выбора стандартного состояния.
В стандартном
состоянии
ai
= 1.
Для
компонентов жидких растворов
неэлектролитов чаще всего в кач-ве
стандартного выбирают состояние чистой
жидкости
при температуре и давлении раствора с
хим. потенциалом
![]() (Т,
р).
Тогда
(Т,
р).
Тогда
![]() =
=
![]() при
мольной доле Ni
=
1, активность ai
и коэф. активности
при
мольной доле Ni
=
1, активность ai
и коэф. активности
![]() =ai/Ni
равны единице. В растворе
=ai/Ni
равны единице. В растворе
