
ФИЗическая химия
.docx![]()
![]() коэффициентом
активности
коэффициентом
активности
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
27.
Гетерогенные реакции, хим. реакции с участием веществ, находящихся в различных фазах и составляющих в совокупности гетерогенную систему. Типичные гетерогенные реакции: термическое разложение солей с образованием газообразных и твердых продуктов (например, СаСО3 -> СаО + СО2), восстановление оксидов металлов водородом или углеродом (например, РbО + С -> Рb + СО), растворение металлов в кислотах (например, Zn + H2SO4 -> ZnSO4 + Н2), взаимодействие твердых реагентов (Аl2О3 + NiO -> NiAl2O4). В особый класс выделяют гетерогенно-каталитические реакции, протекающие на поверхности катализатора, при этом реагенты и продукты могут и не находиться в разных фазах. Например, при реакции N2 + + ЗН2 -> 2NH3, протекающей на поверхности железного катализатора, реагенты и продукт реакции находятся в газовой фазе и образуют гомогенную систему.
Особенности гетерогенных реакций обусловлены участием в них конденсированных фаз. Это затрудняет перемешивание и транспорт реагентов и продуктов; возможна активация молекул реагентов на поверхности раздела фаз. Кинетика любой гетерогенные реакции определяется как скоростью самого химического превращения, так и процессами переноса (диффузией), необходимыми для восполнения расхода реагирующих веществ и удаления из реакционной зоны продуктов реакции. В отсутствие диффузионных затруднений скорость гетерогенной реакции пропорциональна размерам реакционной зоны; так называемая удельная скорость реакции, рассчитанная на единицу поверхности (или объема) реакционной зоны, не изменяется во времени; для простых (одностадийных) реакций она может быть определена на основе действующих масс закона. Этот закон не выполняется, если диффузия веществ протекает медленнее, чем химическая реакция; в этом случае наблюдаемая скорость гетерогенные реакции описывается уравнениями диффузионной кинетики.
Лимитирующая стадия процесса. При стационарном процессе, когда все стадии протекают с одинаковой скоростью, одна из них — наиболее медленная — имеет максимальную в данных условиях скорость. В зависимости оттого, какая из стадий ограничивает скорость протекания процесса, различают диффузионную и электрохимическую кинетику. При изучении процесса важно выявить, какая из стадий ограничивает его скорость. Тагё^ например, если процесс протекает с концентрационной поляризацией, то эффективной мерой, позволяющей ускорить процесс, является перемешивание. Если же лимитирующей является химйческая поляризация, то перемешивание почти не сказывается на скорости процесса. В последнем случае повышение температуры способствует росту скорости реакции. Для определения лимитирующей стадии электродного процесса разработаны методы температурной зависимости дифференциальной полярографии [68] и метод быстрого снятия поляризационных кривых
Диффузия — это обусловленный хаотическим тепловым движением перенос атомов, он может стать направленным под действием градиента концентрации или температуры. Диффундировать могут как собственные атомы решетки (самодиффузия или гомодиффузия), так и атомы других химических элементов, растворенных в полупроводнике (примесная или гетеродиффузия), а также точечные дефекты структуры кристалла — междоузельные атомы и вакансии.
Для создания в полупроводнике слоев с различным типом проводимости и p-n-переходов в настоящее время используются три метода введения примеси: термическая диффузия, нейтронно-трансмутационное легирование и ионная имплантация (ионное легирование). С уменьшением размеров элементов ИМС и толщин легируемых слоев второй метод стал преимущественным. Однако и диффузионный процесс не теряет своего значения, тем более, что при отжиге полупроводника после ионного легирования распределение примеси подчиняется общим законам диффузии.
Конве́кция (от лат. convectio — принесение, доставка) — явление переноса теплоты в жидкостях или газах путем перемешивания самого вещества (как вынужденно, так и самопроизвольно). Существует т. н. естественная конвекция, которая возникает в веществе самопроизвольно при его неравномерном нагревании в поле тяготения. При такой конвекции нижние слои вещества нагреваются, становятся легче и всплывают, а верхние слои, наоборот, остывают, становятся тяжелее и опускаются вниз, после чего процесс повторяется снова и снова. При некоторых условиях процесс перемешивания самоорганизуется в структуру отдельных вихрей и получается более или менее правильная решётка из конвекционных ячеек.
28.
С точки зрения термодинамики движущим потенциалом любого выравнивающего процесса является рост энтропии. При постоянных давлении и температуре в роли такого потенциала выступает химический потенциал µ, обуславливающий поддержание потоков вещества. Поток частиц вещества пропорционален при этом градиенту потенциала
J
~
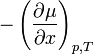
В большинстве практических случаев вместо химического потенциала применяется концентрация C. Прямая замена µ на C становится некорректной в случае больших концентраций, так как химический потенциал связан с концентрацией по логарифмическому закону. Если не рассматривать такие случаи, то вышеприведённую формулу можно заменить на следующую:
![]()
которая показывает, что плотность потока вещества J [cm − 2s − 1] пропорциональна коэффициенту диффузии D [(cm2s − 1)] и градиенту концентрации. Это уравнение выражает первый закон Фика
29.
Второй закон Фика связывает пространственное и временное изменения концентрации (уравнение диффузии):
![]()
Коэффициент диффузии D зависит от температуры. В ряде случаев в широком интервале температур эта зависимость представляет собой уравнение Аррениуса.
Дополнительное поле, наложенное параллельно градиенту химического потенциала, нарушает стационарное состояние. В этом случае диффузионные процессы описываются нелинейным уравнением Фоккера—Планка. Процессы диффузии имеют большое значение в природе:
Питание, дыхание животных и растений;
Проникновение кислорода из крови в ткани человека.
30.
Конвективная
диффузия. Перенос вещества в движущейся
среде обусловлен двумя различные
механизмами. Наличие разности концентраций
в жидкости (газе) вызывает мол. диффузию;
кроме того, частицы вещества, растворенного
в жидкости, увлекаются последней при
ее движении и переносятся вместе с ней.
Совокупность обоих процессов называют
конвективной диффузией. Для мат. описания
конвективной диффузии в ламинарном
потоке несжимаемой жидкости используют
уравение:
![]() где
СА - концентрация диффундирующего
компонента А, в моль/м3, t - время, в с, u -
вектор скорости макроскопич. течения,
в м/с, С - набла (оператор Гамильтона),
div jA - дивергенция, jA - вектор плотности
диффузионного потока (количество
вещества, переносимого путем диффузии
в единицу времени через единицу площади
поверхности), в моль/(м2* с).
Величину
jA
находят из уравения:
где
СА - концентрация диффундирующего
компонента А, в моль/м3, t - время, в с, u -
вектор скорости макроскопич. течения,
в м/с, С - набла (оператор Гамильтона),
div jA - дивергенция, jA - вектор плотности
диффузионного потока (количество
вещества, переносимого путем диффузии
в единицу времени через единицу площади
поверхности), в моль/(м2* с).
Величину
jA
находят из уравения:
jA= - DABgrad CA, (2)
где
DAB
-
коэффициент мол. диффузии компонента
A, в м2/с,
grad СА
-градиент
поля концентрации. В случае турбулентного
потока в уравении (1) СА
и и
заменяют на усредненные по времени
величины
![]() и
и
![]() ,
а правую часть уравения дополняют
выражением для дивергенции плотности
турбулентного потока распределяемого
компонента А (см. Турбулентная диффузия).
Поскольку можно принять, что турбулентная
и мол. диффузия независимы, то в этом
случае
,
а правую часть уравения дополняют
выражением для дивергенции плотности
турбулентного потока распределяемого
компонента А (см. Турбулентная диффузия).
Поскольку можно принять, что турбулентная
и мол. диффузия независимы, то в этом
случае
![]() где
EM
-
коэффициент турбулентной диффузии, в
м2/с.
Решение уравения конвективной диффузии
кроме начальных и граничных условий
для СА
требует знания поля скоростей. Последнее
требование в реальных условиях редко
выполняется и поэтому строгие решения
уравения (1) получены только для отдельных
простых случаев.
где
EM
-
коэффициент турбулентной диффузии, в
м2/с.
Решение уравения конвективной диффузии
кроме начальных и граничных условий
для СА
требует знания поля скоростей. Последнее
требование в реальных условиях редко
выполняется и поэтому строгие решения
уравения (1) получены только для отдельных
простых случаев.
Гомогенной называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Отношение количества вещества к единице объема называется концентрацией с, моль/л.
Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
 ,
,
где с2и с1 – концентрации исходного вещества в момент времени t2 и t1.
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции, равна:
![]()
Скорость реакции принимается всегда положительной, поэтому производная исходных концентраций берется со знаком минус, а продуктов реакции – со знаком плюс.
Скорость реакции имеет единицу измерения [моль м-3 с-1], [моль л-1с-1].
Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции протекают со взрывом, другие могут идти годами. На скорость реакции влияют такие факторы как концентрация веществ, температура, катализаторы.
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации. Образование активированного комплекса определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. Доля таких молекул зависит от температуры. При высоких температурах доля активных молекул, энергия которых равна или выше энергии активации, велика и, соответственно, растет доля молекул способных к активным столкновениям с образованием активированного комплекса, т.е. реакции идут быстро. Чем выше энергия активации, тем меньше доля частиц, способных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокая энергия активации (высокий энергетический барьер) является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя термодинамически возможны (ΔG < 0).
Итак, энергия активации – это энергия, необходимая для перехода частиц в состояние активированного комплекса. Частицы, энергия которых равна или выше энергии активации, называются активными. С ростом температуры растет доля этих частиц и соответственно скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции.
31.
Химическая кинетика1 – учение о скоростях и механизмах химических реакций.
Таким образом, скорость химической реакции можно описать уравнением
![]()
где
r
– скорость реакции (от англ. rate
— скорость
процесса, в отличие от ранее используемого
обозначения для скорости реакции
![]() –
velocity
– скорость перемещения),
–
velocity
– скорость перемещения),
![]() (прописная
греч. дельта)
– синоним слов «конечное2
изменение»,
(прописная
греч. дельта)
– синоним слов «конечное2
изменение»,
![]() (греч.
ню)
– количество (моль) вещества-реагента
или вещества-продукта,
(греч.
ню)
– количество (моль) вещества-реагента
или вещества-продукта,
![]()
![]() (греч.
тау)
– время (с), за которое произошло данное
изменение.
(греч.
тау)
– время (с), за которое произошло данное
изменение.
При таком определении скорость реакции зависит от того, количество какого из участников реакции мы наблюдаем и измеряем. Очевидно, что для реакции, например:
2H2 + O2 = 2H2O,
количество вещества превращающегося водорода в два раза больше, чем кислорода. Поэтому
r(H2) = 2r(O2) = r(H2O).
Уравнение реакции связывает величины скоростей, определенных по любому из веществ. Поэтому выбор последнего зависит от удобства и легкости экспериментального измерения его количества в реакционной системе.
На качественном уровне реакции могут быть классифицированы на быстрые, для измерения скорости которых необходимы специальные методы, например взрыв гремучего газа, реакции в растворах электролитов; медленные, для измерения скорости которых нужны большие промежутки времени, например коррозия железа; и реакции, за течением которых мы можем наблюдать непосредственно, например взаимодействие цинка с соляной кислотой.
Описываемая уравнением (1) скорость реакции зависит от количеств взятых веществ-реагентов. Если мы проводим одну и ту же реакцию с разными объемами или поверхностями соприкосновения реагентов, то для одной и той же реакции мы получим разные значения скорости, тем большие, чем больше вещества взято или чем лучше оно измельчено. О каком определении скорости тогда может идти речь? Поэтому используют другое определение скорости реакции.
Скорость химической реакции — это изменение количества вещества какого-либо участника реакции в единицу времени в единице реакционного пространства.
32.
Коэффицие́нт диффу́зии — количественная характеристика скорости диффузии, равная количеству вещества (в массовых единицах), проходящего в единицу времени через участок единичной площади (например, 1 м²) при градиенте концентрации, равном единице (соответствующем изменению 1 моль/л → 0 моль/л на единицу длины). Коэффициент диффузии определяется свойствами среды и типом диффундирующих частиц.
Зависимость коэффициента диффузии от температуры в простейшем случае выражается законом Арениуса:
D = D0exp( − Ea / kT),
где D — коэффициент диффузии [ {м²}/{сек} ]; Ea — энергия активации [Дж]; k — постоянная Больцмана; T — температура [K].
33.
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]() (II.14)
(II.14)
либо
![]() (II.15)
(II.15)
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
![]()
34.
Хаотический обмен местами между атомами, находящимися на поверхности твердого тела и внутри него, протекает при обычных температурах слишком медленно, чтобы можно было легко обнаружить последствия этого процесса. Однако при высоких температурах скорость диффузии такова, что, например, серебряное или хромовое покрытия «впитываются» в сталь в течение нескольких недель. Другим примером применения диффузии для получения слоистой структуры может служить кристаллический триод (транзистор). Требуемые слои примесей можно получить в течение нескольких минут за счет их диффузии при температуре, близкой к точке плавления германия. Однако при комнатной температуре строение такого кристаллического триода остается неизменным практически неограниченно долгое время. Особое значение процессы диффузии имеют в тонкопленочных структурах, которые состоят из нескольких слоев материалов, различных по своей природе. Такие структуры являются основой практически всех микроэлектронных устройств. Если локальные изменения состава массивных материалов, происходящие вследствие взаимной диффузии в слоях толщиной несколько микрометров и более, слабо влияют на свойства этих материалов, то в тонкопленочных композициях такие процессы диффузии могут привести к коренному изменению состава и структуры отдельных слоев и, как следствие, к деградации параметров приборов и интегральных схем и даже выходу их из строя [52].
Движущей силой диффузии являются градиенты концентрации dC/dx и температуры dT/dx. Наиболее распространена свободная диффузия − диффузия, вызываемая градиентом концентрации. Она всегда направлена в сторону выравнивания концентрации. Различают два случая свободной диффузии − гетеродиффузия и самодиффузия. Гетеродиффузия − это диффузия чужеродных атомов при наличии градиента их концентрации, а самодиффузия − это случай диффузии в чистом веществе атомов этого же вещества под влиянием градиента изотопного состава. Искусственным путем такой градиент создают нанесением на поверхность образца слоя того же вещества, но обогащенного одним из изотопов. Этот градиент используется для экспериментального определения коэффициентов самодиффузии.
Кроме свободной, различают еще и вынужденную диффузию. Она возникает под действием направленных внешних сил. Этот вид диффузии, как правило, приводит не к выравниванию, а к увеличению градиента концентрации. В зависимости от природы внешних сил, различают следующие основные виды вынужденной диффузии: термо-, электро-, баро- и восходящую диффузию.
Термодиффузия происходит под действием градиента температуры dT/dx. Поток при этом направлен в сторону более низких температур, например диффузия носителей заряда от горячего спая к холодному в термоэлектрических преобразователях энергии.
Электродиффузия протекает под действием градиента электрического поля dE/dx. В этом процессе заряженные частицы диффундируют в сторону полюса противоположного знака, например диффузия в полупроводниках под влиянием внутренних электрических полей, электролитические процессы.
Бародиффузия идет под действием поля тяжести или давления dP/dx.
Восходящая диффузия возникает под действием градиента упругих напряжений d/dx. Поток атомов больших размеров при этом направлен в сторону, испытывающую напряжения растяжения, а поток атомов малых размеров − в сжатую область, например процесс образования примесных атмосфер вокруг дислокаций.
35.
Вакуумная гигиена
Окружающая среда существенным образом влияет на качество изготовления электронных приборов. Для изготовления приборов необходимо соблюдать чистоту, влажность, микроклимат, минимальное присутствие персонала. Важным является срок хранения материалов и полуфабрикатов. Но степени чистоты и контролируемости атмосферы здания делят на категории:
1 категория. К этой категории относятся сборочные цеха. В их состав входят белые залы и боксы с отсосом пыли ш вентиляционных решеток, встроенных в пол. Запыленность таких залов не должна превышать 10-20 пылинок на 1 литр воздуха (10000 на 1 м3). (Помещения категории 10000). Обязательным является переодевание и переобувание персонала.
2 категория. К этой категории относятся подготовительные к сборке цеха. Запыленность таких цехов не должна превышать 300 пылинок на I литр воздуха. Кратность обмена воздуха в таких помешениях должна быть не менее 10.
3 категория - это заготовительные цеха.
Для очистки воздуха нашли широкое применение полимерные, слоистые фильтры, устанавливаемые на входах в помещения. Внутри помещений применяются электростатические фильтры и фильтры на основе коронного разряда. В последнее время находят применение кондиционеры с добавками фрагментов газовой среды, управляемые от ЭВМ.
Следует отметить, что в случае квазипериодической работы вакуумных установок, при разгерметизации вакуумная камера работает подобно пылесосу. Для систем пневмоавтоматики, робототехники и вакуумных систем воздух осушают от влаги, пропуская его через компрессор до 10 атм и сопла. Перед вакуумной камерой может помещаться камера с сорбентом или электрической дугой.
36.
Сорбция (от лат. sorbeo — поглощаю) — поглощение твердым телом либо жидкостью различных веществ из окружающей среды. Поглощаемое вещество, находящееся в среде, называют сорбатом (сорбтивом), поглощающее твердое тело или жидкость - сорбентом.
По характеру поглощения сорбата сорбционные явления делятся на два типа: адсорбцию - концентрирование сорбата на поверхности раздела фаз или его поглощение поверхностным слоем сорбента и абсорбцию - объемное поглощение, при котором сорбат распределяется по всему объему сорбента.
В свою очередь, различают два типа адсорбции - физическую адсорбцию, в при которой повышение концентрации сорбата на поверхности раздела фаз обусловлено неспецифическими (то есть не зависящие от природы вещества) силами Ван-дер-Ваальса и химическую адсорбцию (хемосорбцию), обусловленную протеканием химических реакций сорбента с веществом поверхности сорбата. Физическая адсорбция слабоспецифична, обратима и ее тепловой эффект невелик (единицы кДж/моль). Хемосорбция избирательна, обычно необратима и ее теплота составляет от десятков до сотен (хемосорбция кислорода на металлах) кДж/моль.
изотерма адсорбции (англ. adsorption isotherm) — зависимость количества адсорбированного вещества (величины адсорбции) от парциального давления этого вещества в газовой фазе (или концентрации раствора) при постоянной температуре.
Описание
Экспериментальные изотермы адсорбции являются наиболее распространенным способом описания адсорбционных явлений. Методы получения адсорбционных данных для построения изотерм адсорбции основаны на измерении количества газа (жидкости), удаленного из газовой (жидкой) фазы при адсорбции, а также на различных способах определения количества адсорбата (адсорбированное вещество) на поверхности адсорбента (адсорбирующее вещество), например, волюметрический метод, гравиметрический метод и др.
Различают шесть основных типов изотерм адсорбции (см. рис.). Тип I характерен для микропористых твердых тел с относительно малой долей внешней поверхности. Тип II указывает на полимолекулярную адсорбцию на непористых или макропористых адсорбентах. Тип III характерен для непористых сорбентов с малой энергией взаимодействия адсорбент-адсорбат. Типы IV и V аналогичны типам II и III, но для пористых адсорбентов. Изотермы типа VI характерны для непористых адсорбентов с однородной поверхностью.
Изотермы адсорбции используются для расчета удельной поверхности материалов, среднего размера пор или среднего размера нанесенных частиц, распределения пор или частиц по размерам.
Существует несколько методов математического выражения изотерм адсорбции, различающихся моделями, использованными для описания процесса адсорбции. При малых степенях покрытия поверхности адсорбатом для однородной поверхности уравнение изотермы адсорбции имеет вид уравнения Генри: a = Kp, где a — величина адсорбции, p — давление газа, K — константа. При средних степенях покрытия может быть применено эмпирическое уравнение Фрейндлиха: a = kpn, где k и n — константы.
Строгая теория изотермы адсорбции была предложена И. Ленгмюром для модели монослойной адсорбции на однородной поверхности, в которой можно пренебречь силами притяжения между молекулами адсорбата и их подвижностью вдоль поверхности. Уравнение изотермы Ленгмюра имеет вид: a = ambp/(1 + bp), где b — адсорбционный коэффициент, зависящий от энергии адсорбции и температуры; am — емкость монослоя.
Дальнейшее развитие теории состояло в исключении того или иного допущения, использованного Ленгмюром. Так, С. Брунауэром, П. Эмметом и Э. Теллером была предложена теория полимолекулярной адсорбции (метод БЭТ); Т. Хилл и Я. де Бур разработали теорию, учитывающую взаимодействие между адсорбированными молекулами (изотерма Хилла–де-Бура), и т. д.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра:
![]() ,
,
где θ — доля площади поверхности адсорбента, занятая адсорбатом, α — адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
Поскольку [S − P] = θ и, соответственно, [S * ] = 1 − θ, уравнение адсорбционного равновесия может быть записано следующим образом:
![]()
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции (чаще применяют сокращённый термин — изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
