
хим синтез / 27_28_29_obshy_vid
.docx27.реакции SN1
Механизм реакции SN1 или реакции мономолекулярного нуклеофильного замещения включает следующие стадии:
1. Ионизация субстрата с образованием карбкатиона (медленная стадия): R−X → R+ + X−
2. Нуклеофильная атака карбкатиона (быстрая стадия):R+ + Y− → R−Y или (если в качестве нуклеофила выступает нейтральная частица): R+ + Y−Z → R−Y+−Z
3. Отщепление катиона (быстрая стадия): R−Y+−Z → R−Y + Z+
Примером реакции SN1 является гидролиз трет-бутилбромида:
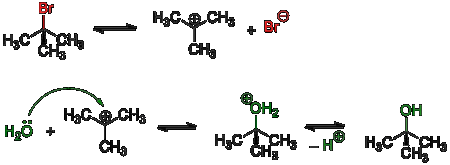
Условный энергетический профиль реакции SN1Скорость реакции SN1 (в упрощённом виде) не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата
Так как в процессе реакции образуется карбкатион, его атака (в идеальных условиях без учёта фактора влияния заместителей) нуклеофилом может происходить с обеих сторон, что приводит к рацемизации образующегося продукта.
Важноно иметь в виду, что SN1 механизм реализуется только в случае относительной устойчивости промежуточного карбкатиона, поэтому по такому пути, обычно, реагируют только третичные и вторичные алкилпроизводные.
Реакции SN2
Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
R−X + Y− → [Y⋯R⋯X]− → R−Y + X−
Примером реакции SN2 является гидролиз этилбромида:
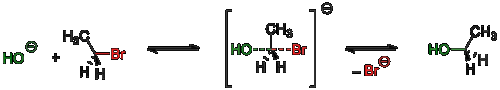
Стереохимическое SN2 правило: В реакциях бимолекулярного нуклеофильного замещения атакующий нуклеофил стереохимически инвертирует молекулу, в которой он замещает уходящую группу.
28 Этерификация— реакция образования сложных эфиров при взаимодействии кислот и спиртов:RCOOH + R’OH ⇔ RCOOR' + Н2О
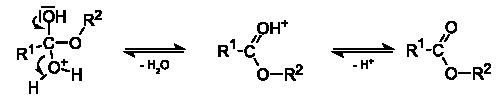
Механизм реакции: Реакция протекает в условиях кислотного катализа и проходит по механизму нуклеофильного замещения. На первой стадии происходит протонирование атома кислорода карбонильной группы карбоновой кислоты с образованием резонансно стабилизированого карбокатиона:
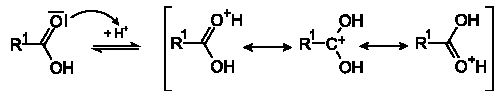
после чего происходит нуклеофильная атака атома кислорода гидроксильной группы спирта на карбониевый центр с образованием алкилоксониевого иона, эта стадия является лимитирующей. Затем в алкилоксониевом ионе происходит миграция протона на один из гидроксилов с образованием уходящей группы —O+H2:
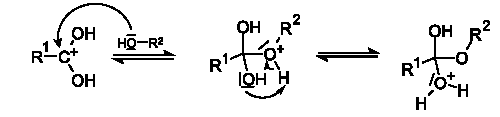
Завершающей стадией является отщепление промежуточного продукта присоединения воды и протона — катализатора с образованием сложного эфира:
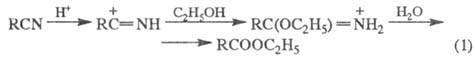
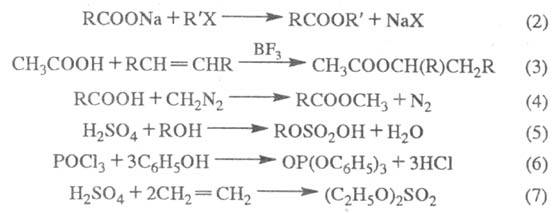
Получение: образуются также кислотным алкоголизмом нитрилов (катализатор- H2SO4, HCl, n-толуолсульфокислота; реакция 1); алкилированием карбоксилат-анионов (кислот или их солей) алкилгалогенидами, алкенами в присутствии катализаторов (2,3); из альдегидов по Тищенко реакции; метиловые эфиры - реакцией кислот с диазометаном (4); эфиры минеральных кислот - взаимодействие последних, а также их галогенангадридов со спиртами или фенолами (5,6) либо минеральных кислот с олефинами (7):
29.Электрофильное замещение (SE) – механизм реакции взаимодействия ароматических углеводородов с молекулами, содержащими электрофильные частицы.
Примеры электрофильных частиц: Cl+, Br+, NO2+, CH3+, CH3CH2+ и т.п.
Катионы типа CH3+, Cl+ существуют в составе комплексов CH3+[AlCl4]- и Cl+[FeCl3]-.

I стадия: образование p-комплекса, в котором электрофильная частица Х+ притягивается к p-электронному облаку бензольного кольца.
II стадия (лимитирующая): образование s-комплекса. Два электрона из p-системы идут на образование s-связи С–Х. При этом ароматичность кольца нарушается. Атом углерода, соединившись с электрофилом Х, переходит из sp2- в sp3-гибридизованное состояние и выходит из системы сопряжения. В системе сопряжения остаются 4 p-электрона, которые делокализованы на 5-ти углеродных атомах кольца (заряд +1).
III стадия: отщепление протона Н+ и восстановление ароматичности кольца,
Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:
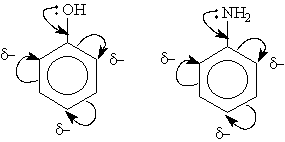
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
