
хим синтез / 22 23 24
.docx23. Сульфохлорирование
Сульфохлорирование осуществляют действием смеси хлора и диоксида серы или хлористого сульфурила (SO2Cl2) под действием УФ-света. В результате этого промышленного процесса получают алкансульфохлориды и далее – соли алкансульфокислот, которые широко используются как синтетические моющие вещества.
Реакциея сульфохлорирования является типично радикально-цепной.
![]()
При взаимодействии сульфохлорида со щелочью образуется алкилсульфонат:
![]()
Механизм реакции:
I стадия. Инициирование.
![]()
II. Стадия. Рост цепи.
![]()
![]()
![]()
III. Обрыв цепи.
![]()
![]()
![]()
Устойчивость свободных радикалов
Энергии диссоциации связей водородов с различными группами. Это значения ∆Н [ккал (4,187·103 Дж)] следующих реакций:
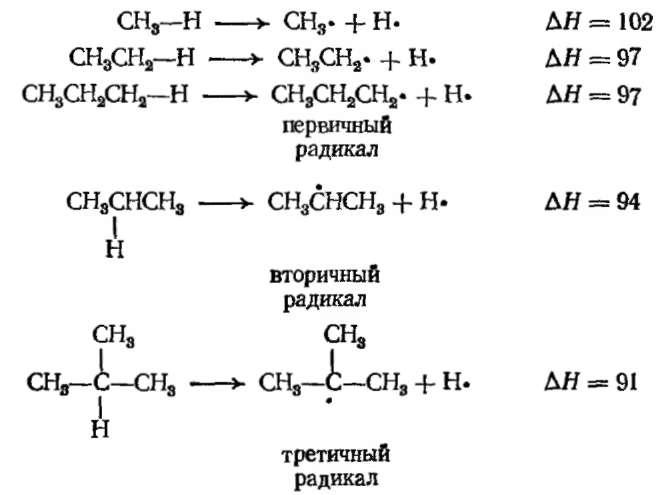
По определению энергия диссоциации связи — это энергия, необходимая для превращения 1 моля алкана в радикал и атом водорода. Энергия, необходимая для образования различных типов радикалов, уменьшается в следующем порядке: СН3 > первичный > вторичный > третичный.
24. Галогенирование: хлорирование
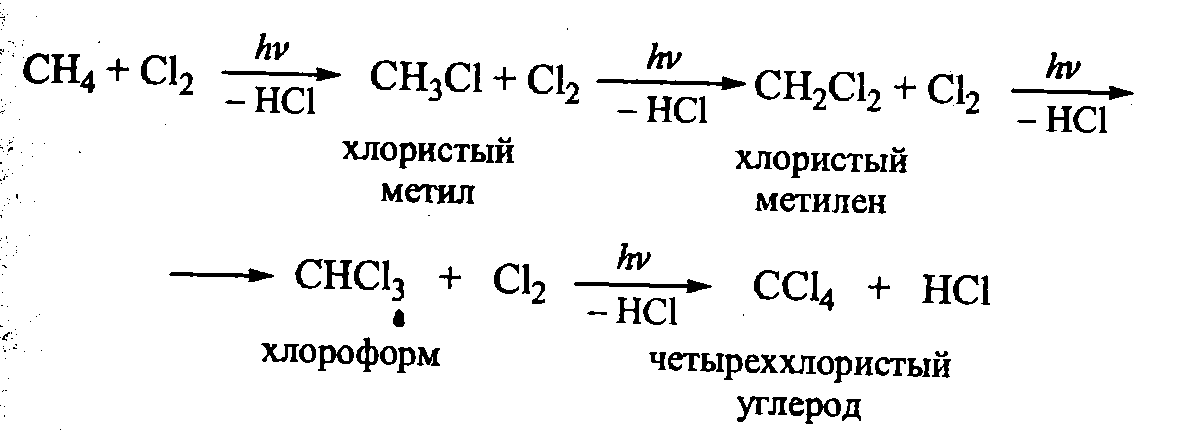
Стадия 1 – зарождение цепи - появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) ·Cl:
![]()
Стадия 2 – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
![]()
(Реакция
Cl· + CH4 ![]() CH3Cl
+ H· не идет, т.к. энергия атомарного
водорода
H· значительно выше, чем метильного
радикала ·СН3).
CH3Cl
+ H· не идет, т.к. энергия атомарного
водорода
H· значительно выше, чем метильного
радикала ·СН3).
![]()
Стадия 3 – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
![]()
Бромирование алканов протекает значительно хуже чем хлорирование, по тому же радикакльно-цепному механизму. Соотношение скоростей реакции бромирования при 127 С по третичному, вторичному, первичному атома углерода равно 1600:86:1. Можно утверждать, что бромирование нацело идет по третичному атому углерода.
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
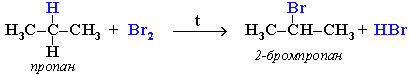
Иодирование являя-ся практически неосуществимой реакцией. Хотя стадия инициирования протекает легче, чем хлорирования и бромирования, однако первая стадия роста цепи эндотермична, и именно она препятствует реакции иодирования.
Фторирование алканов осуществить прямым действием F2, невозможно, т.к. выделяющейся энергии достаточно для разрыва связей С-С и С-Н и поэтому процесс идет со взрывом, его невозможно проконтролировать. Обычно фторироване алканов осуществляют более мягкими фторирующими агентами (смесь CoF2 и F2).
22. Нитрование алканов
Важной реакцией, имеющей промышленное применение, явл-ся нитрование алканов. Реакцию проводят или в жидкой, или в газовой фазе. В первом случае в качестве нитрирующего агента используют разб. HNO3, (способ Коновалова) при темпер. 140-150С и давлении, в то время как конц. HNO3 в н.у. не действует на алканы, а при нагревании обычно действует как окислитель. Газофазное нитрование в промышленности осущ-ют тетраоксидом азота или парами азотной кислоты при темп. 450-475С. В рез-те обр-ся смесь нитроалканов, т.к. при высоких темп-ах одновременно идет разрыв С-С связей. Раздел-е осущ-ся фракционной перегонкой.
Схема реакции:
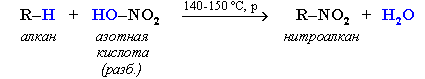
Так, нитрование алканов по Коновалову, которое осуществляют в разбавленной азотной кислоте (10–25 %) при температуре от 110 до 140 °С и небольшом избыточном давлении 1–2 атм (в запаянной стеклянной ампуле) приводит исключительно к замещению на нитрогруппу самого реакционноспособного водорода.
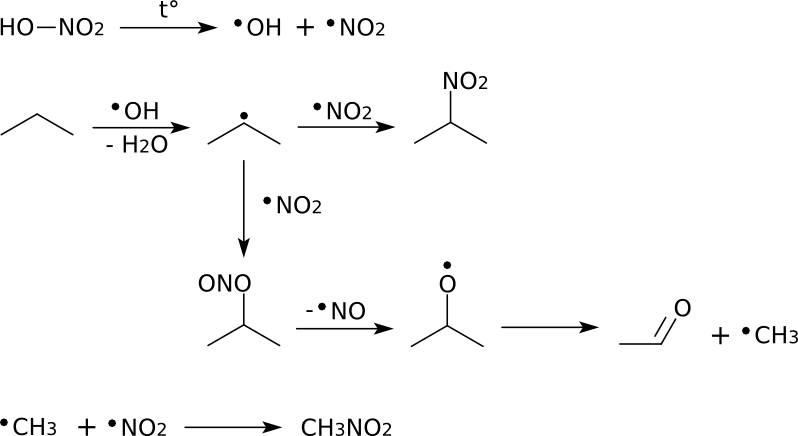
При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения:
Стрет.– Н > Свтор.– Н > Cперв.– Н
