
хим синтез / 30_33_34
.docx30. Механизм электрофильного замещения в бензольном кольце. Электроноакцепторные заместители, их влияние на перераспределение электронной плотности в кольце и устойчивости σ - комплекса.
Обладая подвижной шестеркой p -электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами.
Для бензола наиболее характерны реакции, протекающие по механизму электрофильного замещения (SE)

Механизм:
Электрофильный реагент Е+ атакует электронное облако, и за счет слабого электростатического взаимодействия образуется неустойчивый p -комплекс, в котором p -электронная система ароматического ядра - донор электронов, а электрофильный реагент (Е+) - акцептор. Ароматическая система при этом еще не нарушается. Эта стадия протекает быстро. На второй, более медленной стадии формируется ковалентная связь между электрофилом Е и одним из атомов углерода кольца за счет двух p -электронов кольца. Этот атом углерода переходит из sр2- в sр3-гибридное состояние. Ароматичность системы при этом нарушается. Четыре оставшиеся p -электрона распределяются между пятью другими атомами углерода, и молекула бензола образует карбокатион, или s -комплекс.
Нарушение ароматичности энергетически невыгодно, поэтому структура s -комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом (третья стадия). При этом два электрона возвращаются в p -систему и тем самым восстанавливается ароматичность.
В молекуле бензола p -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные. Электроноакцепторные заместители (второго рода) проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогруппа —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. И общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета-положениях:

Например, нитробензол, содержащий заместитель второго рода (NO2) бромируется в мета-положение:
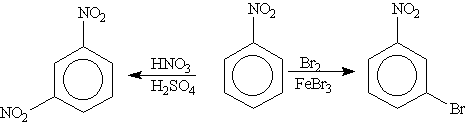
-
Тетраэдрическая гибридизация (sр3-гибридизация) атомов С, N, О, примеры соединений, σ - связь.
Гибридизация – метод математического комбинирования различных по форме и энергии орбиталей с образованием того же количества новых, но уже одинаковых по форме и энергии гибридных орбиталей.
sp3 – гибридизация: происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚. Образуются 4 ковалентные σ – связи.

Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями. Это тетроганальный атом и находится в первом валентном состоянии.
Состояние sp3 – гибридизации характерно для атомов С, N, O , соединенных с другими атомами одинарными связями (sp3-атомы выделены):
СH4, RCH3, NH3, RNH2, H2O, ROH, R2O.
Углерод в sp3-гибридном состоянии находится в простом веществе алмазе.
σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов.
σ-связь - осевое перекрывание

34.Тригональная гибридизация (sр2 -гибридизация) атомов С, N, О, примеры соединений, σ - и п- связи.
Гибридизация – метод математического комбинирования различных по форме и энергии орбиталей с образованием того же количества новых, но уже одинаковых по форме и энергии гибридных орбиталей.
sp2 – гибридизация: происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Поэтому электронная конфигурация атома называется плоской (копланарной). Образуются 3 ковалентные σ – связи.

sp2 – гибридизованный атом – тригональный атом и находится во втором валентном состоянии.
sp2-Гибридизация характерна для атомов С, N, O с двойной связью(sp2-атомы выделены):
H2C=CH2, H2C=CHR, R2C=NR,
R-N=N-R, R2C=O, R-N=O и для свободных радикалов R3C•
Атомы углерода в sp2-гибридном состоянии образуют такие аллотропные формы как графит, фуллерены
σ, π -связи —виды ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи.
σ-связь - осевое перекрывание π –связь – боковое перекрывание


