
- •6. Сложение скоростей, относительная скорость.
- •10. Третий закон Ньютона
- •11. Понятие состояния в классической физике. Границы применимости классического описания частиц.
- •12. Система взаимодействующих тел. Внешние и внутренние силы. Закон сохранения импульса для взаимодействующих между собой тел. Замкнутая система тел
- •13. Цен. Маcс. Тeop. O движ. Цен. Мacc.
- •14.Движение тел с переменной массой. Примеры.
- •15. Работа и мoщнocть.
- •17. Конс. И неконс. Сил. Пот. Энерг.
- •18. Зак. Сохр. Эн. В мех
- •19. Соударение тел.
- •23.Момент инерции твердого тела относительно оси и его расчет для стержня. Теорема Гюйгенса-Штейнера
- •24.Гармонические колебания . Амплитуда , круговая частота . Фаза гармонических колебаний. Векторные диаграммы . Комплексная форма представления колебаний .Сложение колебаний
- •Сложение гармонических колебаний
- •25.Уравнение гармонических колебаний и его решение . Примеры гармонических осцилляторов :
- •Уравнение гармонических колебаний
- •28)Равновесие жидкости. Гидростатика несжимаемой жидкости.
- •29.Стационарное движение идеальной жидкости, уравнение бернури,вязкость, Течение вязкой жидкости по трубке. Уравнение Пуазейля
- •30.Поверхностное натяженние. Коэфициент поверхностного натяжения. Кривые углы. Смачивание и несмачивание
- •31.Разность давлений по разные стороны изогнутой поверхности жидкости .Формула Лапласа . Капиллярные явления
- •32 Фазовые превращения.Испарение и конденсация.Плавление и кристаллизация
- •Средняя скорость
- •Среднеквадратичная скорость
- •37. Внутрення энергия. Мароскопическая работа. Количество тепла.
- •38.Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам.
- •39.Теплоёмкость и ее зависимость от термодинамического процесса. Основы классической теории теплоёмкости идеального газа.
- •40.Адиабатный процесс. Уравнение пуассона.
- •45)Теплопроводность и перенос энергии. Закон Фурье для теплопроводности
- •46)Вязкость и перенос импульса. Закон Ньютона для силы вязкого трения
- •1) Внутреннее трение (вязкость)
39.Теплоёмкость и ее зависимость от термодинамического процесса. Основы классической теории теплоёмкости идеального газа.
CV – молярная теплоемкость в изохорном процессе(V = const)
|
|
|
|
Cp – молярная теплоемкость в изобарном процессе (p = const).
Qp = ΔU + p (V2 – V1) = CV ΔT + pΔV,

Отношение
теплоемкостей в процессах с постоянным
давлением и постоянным объемом играет
важную роль в термодинамике. Оно
обозначается греческой буквой γ.
![]()
Термодинамические процессы, в которых теплоемкость газа остается неизменной, называютсяполитропическими.
ОСНОВЫ КЛАССИЧЕСКОЙ ТЕОРИИ ТЕПЛОЁМКОСТИ ИДЕАЛЬНОГО ГАЗА
теплоемкость идеальных газов согласно классической теории не зависит от температуры.
40.Адиабатный процесс. Уравнение пуассона.
АДИАБАТНЫЙ ПРОЦЕСС
Адиабатный процесс — процесс, при котором отсутствует теплообмен между системой и окружающей средой.
Из
первого начала термодинамики следует,
что работа газа при адиабатном процессе
совершается за счет его внутренней
энергии:
Таким образом, при адиабатном
процессе
![]() или
или ![]() —
уравнение Пуассона. (1).
—
уравнение Пуассона. (1).
Работа
газа при адиабатном процессе равна
убыли внутренней энергии:

График
адиабатного процесса — более крутая
кривая, чем гипербола при изотермическом
процессе. Это следует из выражения
производной ![]() ,
полученной из уравнения Пуассона.
,
полученной из уравнения Пуассона.

УРАВНЕНИЕ ПУАНСОНА
В декартовой системе координат

Таким
образом, при адиабатном процессе
![]() или
или ![]() —
уравнение Пуассона.
С учетом уравнения
Клапейрона-Менделеева (
—
уравнение Пуассона.
С учетом уравнения
Клапейрона-Менделеева (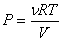 ,
, )
уравнение
Пуассона может быть представлено в
виде:
)
уравнение
Пуассона может быть представлено в
виде:
![]() или
или ![]()
 или
или  .
.
41.Тепловые машины. Цикл Карно. Максимальное КПД тепловой машины.
1)Тепловые маши́ны — устройство, преобразующее тепло в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно жидкость или газ.
При работе часть тепла Q1 передается от нагревателя к рабочему телу, а затем часть энергии Q2 передается холодильнику, который охлаждает машину. КПД идеальной тепловой машины считается по формуле n=((Q1-Q2)/Q1)х100%.
Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности.
2) В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником.
В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно

3) Если абсолютная температура горячего тела равна Т1, а холодного — Т2, то максимальный КПД машины равен:
![]()
Как видно из формулы, радикальный путь повышения КПД теплового двигателя — это повышение температуры газа при начале рабочего хода, т. е. до расширения, и снижение его температуры после окончания расширения.
ПРИЛОЖЕНИЕ: просто так для справок
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
![]()
Аналогично, при изотермическом сжатии рабочее тело отдаёт холодильнику
![]()
Отсюда коэффициент полезного действия тепловой машины Карно равен

ПРИМЕРЫ

![]()
![]()

42)Энтропия . 2 закон темодинамики
1) Энтропия(S = 1Дж/К)-функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии Энтропия мера хаотичности, неупорядоченности системы.. В термодинамике энтропия выражает кол-во тепловой энергии пригодной для совершения работы.Чем энергия меньше, тем энтропия выше
Изменение энтропии
термодинамической системы при обратимом
процессе- это отношение общего количества
тепла![]() к
величине абсолютной температурыT
:
к
величине абсолютной температурыT
:

2) . 2 закон темодинамики сформулировал Клаузиус теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.(все самопроизвольные процессы в природе идут с увеличением энтропии)
Связь между
термодинамической вероятностью состояния
системы и ее энтропией выражается
формулой Больцмана
![]() гдеk-постоянная
Больцмана (k=1,38*10^-23
Дж/К)
гдеk-постоянная
Больцмана (k=1,38*10^-23
Дж/К)
второе начало термодинамики (в формулировке Клаузиуса) основано на предположении о том, что вселенная является замкнутой системой,
Впервые его сформулировал Клаузиус теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении.
43) Эффективное сечение рассеяния. Средняя длина свободного пробега молекул
1)
![]()

2)
Длина свободного пробега молекулы —
это среднее расстояние (обозначаемое
![]() ),
которое частица пролетает за время
свободного пробега от одного столкновения
до следующего.
),
которое частица пролетает за время
свободного пробега от одного столкновения
до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (<λ>). Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры
Длину свободного пробега используют при расчётах различных процессов переноса, например вязкости, теплопроводности, диффузии, электропроводности и др.

44) Самодиффузия и перенос молекул . Закон Фика
1) Явление диффузии заключается в самопроизвольном перемешивании молекул различных газов или жидкостей. Явление диффузии наблюдается в твердых телах. В тех случаях, когда в химически чистом однородном газе концентрация молекул будет различной, наблюдается перенос молекул, приводящей к выравниванию плотностей (или концентраций) молекул. Это явление самодиффузии(коэф самодифузии это D).


2) Закон Фика первый:
плотность диффузионного потока вещества пропорционален градиенту изменения концентрации с коэффициентом пропорциональности D - кэфф. диффузии и направлен в другую от него сторону.

Закон Фика второй:
скорость изменения плотности диффузионного потока пропорциональна скорости изменения градиента концентрации с тем же коэффициентом D и так же напрвлена в другую сторону.

