
- •ЗАМЕЩЕННЫЕ КАРБОНОВЫЕ КИСЛОТЫ
- •КЛАССИФИКАЦИЯ. НОМЕНКЛАТУРА
- •В зависимости от положения дополнительной функциональной гр. по отношению к СООН-гр. замещенные карбоновые
- •ГАЛОГЕНОКАРБОНОВЫЕ КИСЛОТЫ
- •Способы получения α-галогензамещенные:
- •β-галогензамещенные:
- •Физические свойства
- •Реакции нуклеофильного замещения атомов галогенов
- •Реакции по карбоксильной группе:
- •ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ
- •Способы получения
- •Широко распространенные в природе α-гидроксикарбоновые к-ты могут быть
- •β-Гидроксикарбоновые кислоты получают:
- •γ- и -гидроксикарбоновые кислоты получают специальными методами.
- •Фенолкарбоновые кислоты синтезируют карбоксилированием фенолов.
- •Строение α-гидроксикарбоновые к-ты (кроме гликолевой НОСН2СООН) содержат асимметрический С-атом.
- •Физические свойства
- •Реакции по гидроксильной группе.
- •Реакции с участием ОН- и СООН- групп
- •γ- и δ-Гидроксикарбоновые к-ты при нагревании в кислой среде вступают в р-цию
- •α-гидроксикислоты при кипячении с разб. минеральными к-тами подвергаются расщеплению с образованием альдегидов и
- •Важнейшие представители
- •Гликозиды галловой кислоты – танины, содержатся в листьях чая, в кофейных зернах,
- •ОКСОКАРБОНОВЫЕ КИСЛОТЫ
- •Способы получения
- •– окислением α-гидроксикислот:
- •β-Оксокарбоновые к-ты могут быть получены гидролизом их сложных эфиров
- •Физические свойства
- •α-оксокислоты под действием разб. минеральных к-т декарбоксилируются с образованием альдегидов, а при действии
- •β-оксокислоты и их производные вследствие
- •β-оксокислоты и их соли термически нестабильные - легко распадаются при нагревании (декарбоксилируются).
- •Сложные эфиры β-оксокислот существуют в виде равновесной смеси двух таутомерных форм – оксо-формы
- •АУЭ является С-Н и О-Н кислотой средней силы, поэтому он реагирует с сильными
- •Соли АУЭ легко вступают в р-ции алкилирования и ацилирования,
- •Кетонное расщепление – осуществляют под действием кислот или разбавленных щелочей
- •Кислотное расщепление – осуществляется под действием конц. растворов щелочей и
- •Синтез кетонов и карбоновых кислот на основе АУЭ
- •Необходимо иметь ввиду:
- •Напр., рассмотрим схему синтеза пентан-2-она и бутановой кислоты.
- •Полная последовательность превращений:
- •кетонное расщепление
- •Важнейшие представители Пировиноградная кислота – бесцв. ж. с запахом уксусной кислоты.
Физические свойства
- бесцветные жидкости или кристаллические в-ва, растворимые в воде.
Химические свойства
Для оксокислот характерны химические св-ва как карбонильных соединений (альдегидов и кетонов), так и св-ва карбоновых кислот. При этом они существенно зависят от взаимного расположения двух функциональных гр.
Кислотность. Оксогруппа- сильная ЭА-гр.
усиливает кислотные св-ва оксокислот в сравнении с незамещенными кислотами.
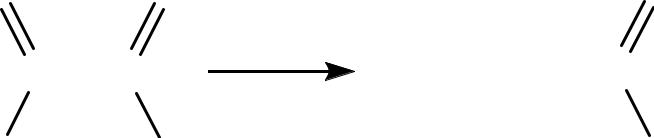
α-оксокислоты проявляют повышенную реакционную способность в реакциях нуклеофильного присоединения по С=О группе. Поэтому некоторые α-оксокислоты легко присоединяют слабый нуклеофил воду:
O |
|
|
O H O |
|
|
|
OH |
O |
|
|
|
|
|
|
|||||
|
|
|
2 |
|
|
|
|
|
|
C |
|
C |
HO |
|
C |
|
C |
||
|
|
|
|
||||||
|
|
|
|
||||||
|
|
|
|
||||||
H |
|
|
OH |
|
|
|
|
OH |
|
|
|
|
|
H |
|||||
глиоксиловая кислота |
моногидрат |
|
глиоксиловой кислоты |

α-оксокислоты под действием разб. минеральных к-т декарбоксилируются с образованием альдегидов, а при действии конц. серной к-ы они декарбонилируются и превращаются в карбоновые к-ты:
|
|
O |
H2SO4 |
разб. |
|
|
O |
||||
|
|
|
|
OH |
|
|
|
CO2 |
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
H2SO4 |
к., toC |
|
O H |
|||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||
O |
|
|
CO |
||||||||
|
|
|
|
|
|||||||
пировиноградная ислота |
|
|
|
|
|
|
|||||
OH

β-оксокислоты и их производные вследствие
β-расположения функциональных групп обладают сильным СН-кислотным центром:
O H O
R C C
C C
C
H
OH
β-оксокислоты и их соли термически нестабильные - легко распадаются при нагревании (декарбоксилируются).
Наиболее важное значение имеют их сложные эфиры, широко используемые в органическом синтезе для получения разл. карбоновых кислот и кетонов.
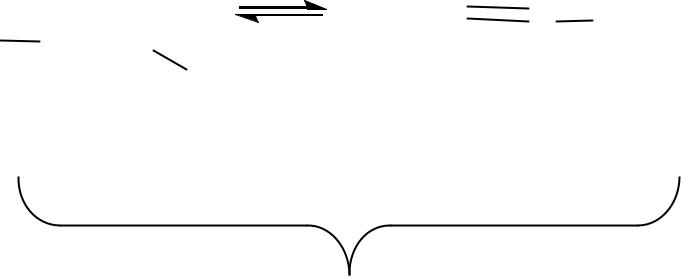
Сложные эфиры β-оксокислот существуют в виде равновесной смеси двух таутомерных форм – оксо-формы и енольной формы.
|
|
O |
|
|
O |
|
|
OH |
O |
|||||||||
|
|
H2 |
|
H3C |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
C |
C C |
|
OС2H5 |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
H3C C |
C |
C |
OС2H5 |
H |
||||||||||||||
|
оксо-форма |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
енольная форма |
||||||||||||
ацетоуксусный эфир (АУЭ)
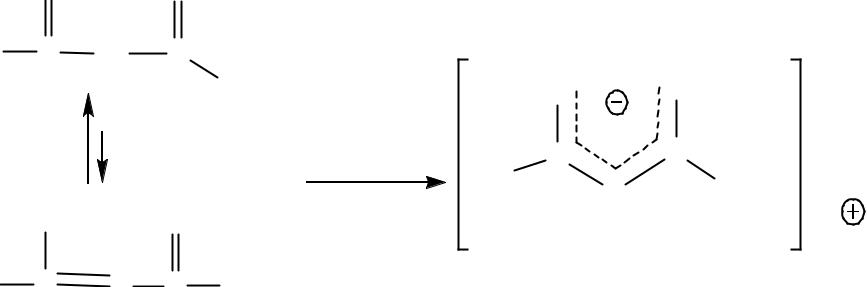
АУЭ является С-Н и О-Н кислотой средней силы, поэтому он реагирует с сильными основаниями с образованием амбидентного
аниона с несколькими реакционными центрами, стабилизированного с участием двух С=О групп:
|
O |
H |
O |
|
|
|
H3C |
C |
C |
|
|
|
|
C2 |
O |
|
O |
|||
|
|
|
OС2H5 |
|
||
|
|
|
С2H5ONa H C |
C |
C |
C |
|
OH |
|
3 |
|
OС2H5 |
|
|
|
O |
|
H |
Na |
|
|
|
|
|
|
|
|
H3C |
C |
C |
C OС2H5 |
|
|
|
|
|
H |
|
|
|
|
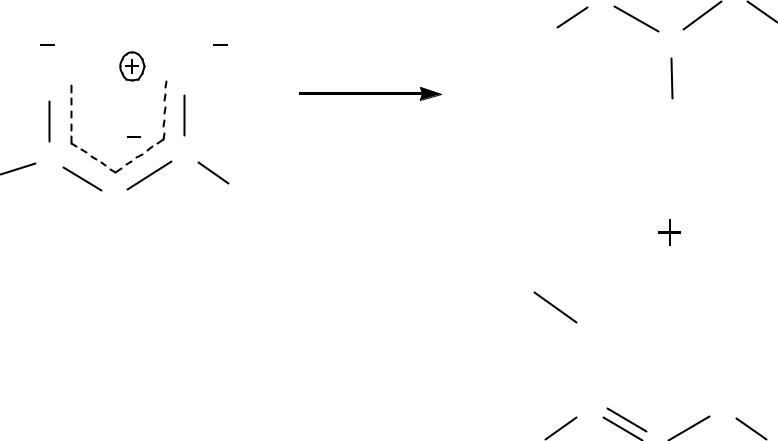
Соли АУЭ легко вступают в р-ции алкилирования и ацилирования,
как по С-атому так и по О-атому. Наибольший интерес представляет С- алкилирование.
С-алкилированные продукты служат исходными веществами для получения различных кетонов и карбоновых кислот путем их расщепления.
|
|
|
O |
Na |
|
H C C |
|
|
C |
||
3 |
||
|
H |
|
R |
|
X |
|
|||
O |
R = Alk или Ac |
||
|
|||
C
OС2H5
O |
|
O |
||||
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
C |
||
C |
H |
|||||
H3C |
C |
|
|
OС2H5 |
||
R
продукт С-алкилирования или С-ацилирования
R
O O
|
|
|
|
|
|
|
C |
C |
|||
H3C |
|
C |
|
|
OС2H5 |
|
|
H |
|
|
|
продукт О-алкилирования или О-ацилирования

Кетонное расщепление – осуществляют под действием кислот или разбавленных щелочей
и приводит к получению кетонов:
|
O |
|
|
O |
|
|
|
|
NaOH, H2O |
O |
|
O |
|
HOH, toC |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
C |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
C |
|
C |
|
|||||||||||||||||
CH3 |
CH |
|
|
|
OC2H5 |
|
|
CH3 CH |
|
|
|
ONa |
|
|
|
|
||||||||||
|
|
|
|
C2H5OH |
|
|
|
|
|
NaHCO3 |
||||||||||||||||
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
CH |
C CH R' |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кетон
