
Методические рекомендации и пособия / Патология шейки матки (2023)
.pdf
21
Мазок не следует брать:
ранее 48 часов после полового контакта;
во время менструации;
в период лечения генитальных инфекций;
ранее 48 часов после расширенной кольпоскопии с обработкой 3- 5% растворами уксусной кислоты или Люголя, после использования любрикантов, тампонов или спермицидов;
после вагинального исследования или спринцевания.
Для получения адекватного материала необходимо:
1.Использовать современные инструменты — комбинированные щетки с эндоцервикальным компонентом или 2-мя отдельными щетками. Следует исключить из употребления все шпатели (Эйра, деревянные и металлические), кюретажные ложечки, часто входящие в одноразовый гинекологический набор, как не позволяющие получить достойный скарификат из зоны трансформации и переходной зоны и разрушающие клеточные элементы при распределении материала на стекло; (Рис. 11)
2.Получать материал в виде скарификата до «кровавой росы», чтобы был получен образец максимально богатый клетками;
3.Ввиду того, что часть повреждений может находиться за пределами эктоцервикса, полноценный цервикальный образец должен быть получен из цервикального канала и крипт эндоцервикса;
Рис. 11 Вид рабочей части щеток для получения адекватного материала как с экто-, так и из эндоцервикса. Материал должен быть получен либо двумя щеткам, либо комбинированной щеткой с эндоцервикальным компонентом. (Источник: КР РФ «Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки»)
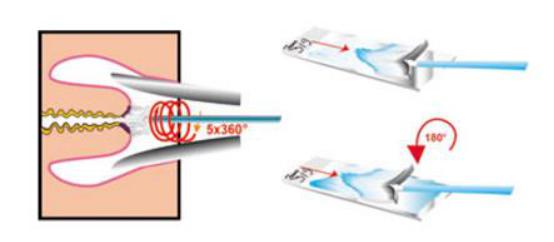
22
Правила забора традиционного мазка на онкоцитологию:
1.Шейку матки обнажают в зеркалах;
2.Материал берется с поверхности зоны трансформации и из эндоцервикальных крипт, то есть с экто- и из эндоцервикса. В связи с тем, что неопластический процесс изначально и наиболее активно развивается в месте стыка эпителиев и зоне трансформации, соскоб (мазок) обязательно должен включать эпителий этих зон. Из-за поражения эндоцервикальных крипт важно присутствие в материале эндоцервикального компонента;
3.Необходимо использование специального одноразового инструмента, гарантирующего взятие материала со всех указанных зон и обеспечивающего информативность препарата. Использование нестандартизованных инструментов недопустимо: это приводит к снижению эффективности цитологического исследования;
4.Мазок необходимо брать до проведения кольпоскопии и различных проб, бимануального исследования во избежание лизирования и деформации клеточных элементов;
5.Забор материала проводят после удаления слизи стерильным сухим мягким ватным тампоном, без грубого давления на шейку во избежание утраты эпителия;
6.Взятие материала для цитологического исследования проводится при помощи цитощётки (экзоцервикс) и эндоцервикальной щётки (эндоцервикс) и представляет собой получение соскоба-скарификата;
7.Рекомендуемая методика забора материала: цитощетку, расположенную преимущественно на экзоцервиксе, поверните 5 раз по часовой стрелке на 360°. Если забор материала осуществляется цитощёткой с эндоцервикальным штифтом, её рекомендуется повернуть не менее 3-х раз на
360°; (Рис. 12)
Рис. 12 Правила забора материала для цитологического исследования цитощеткой и техника приготовления мазка. (Источник: КР РФ «Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки»)
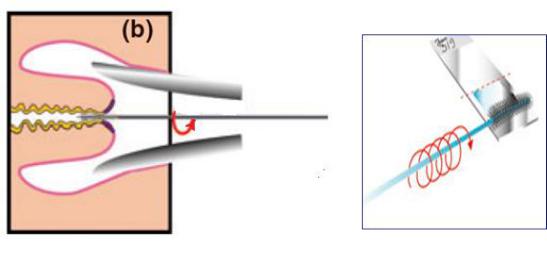
23
8. Для взятия материала с эндоцервикса эндоцервикальной щеткой после введения её следует повернуть не менее трех раз против часовой стрелки. (Рис. 13) Закономерно появление "кровавой росы", что свидетельствует о получении информативного цервикального образца, где, кроме слизи, присутствуют клетки практически всех слоев эпителиального пласта;
Рис. 13 Правила забора материала для цитологического исследования эндоцервикальной щеткой и техника приготовления мазка (обязательно: щетка совершает вращательные движения). (Источник: КР РФ «Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки»)
9.Адекватный мазок должен быть максимально тонким и не должен содержать "толстые участки", включающие "непросматриваемые" скопления или комплексы клеток;
10.Материал должен распределяться равномерно вдоль обезжиренного, сухого стекла (а не поперек или кругами) по всей поверхности стекла с равномерным распределением наибольшего количества полученного скарификата;
11.Во избежание высыхания клеток и их деформации препарат фиксируют специальным составом после забора;
12.Мазки должны быть маркированы: на обороте стекла препарата сбоку по короткому краю указывают фамилию пациентки, локализацию забора (экто-, эндоцервикс) и регистрационный номер исследования.
При проведении жидкостной цитологии собранный материал помещается в специальный контейнер с жидкостью, который называется виала. (Рис. 14)
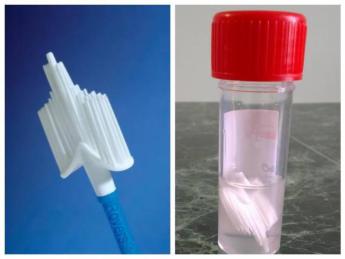
24
Рис. 14 Виала для жидкостной цитологии. (studfile.net)
Препараты окрашиваются по способу Папаниколау, так как данный способ считается классическим.
Интерпретация результатов ПАП-теста
Цитологически атипия проявляется как дискариоз (изменение ядерноцитоплазматического отношения, увеличение структуры и формы ядра). Койлоциты - измененные клетки эпителия, для которых характерно появление ободка просветления цитоплазмы вокруг ядра. Обнаружение койлоцитов является признаком инфицирования ВПЧ.
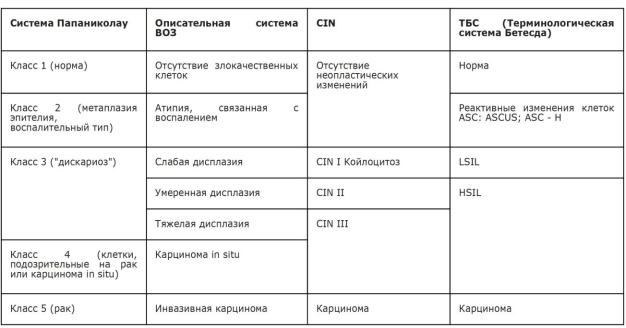
В 1988 году в городе Бетесда состоялась конференция, на которой была принята классификация изменений шейки матки. Данная классификация применяется во всем мире. (Таб. 1)
Таблица 1. Терминологическая система Бетесда (Terminology Bethesda System,TBS)
NILM |
Negative |
for |
Отсутствие |
|
|
intraepithelial lesion |
or |
изменений |
типа |
|
malignancy |
|
интраэпителиального |
|
|
|
|
поражения |
или |
|
|
|
злокачественности |
|
|
|
|
|
|
|
|
|
Атипичные |
железистые |
AGC |
Atypical glandular cells |
клетки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
25 |
|
|
|
|
|
|||
ASC-US |
|
Atypical |
squamous |
Атипичные клетки |
|||
|
cells |
of |
undetermined |
плоского |
|
эпителия |
|
|
significance |
|
|
неясного значения |
|||
|
|
|
|
|
|||
ASC-H |
|
Atypical |
squamous |
Атипичные клетки |
|||
|
cells cannot exclude HSIL |
плоского |
эпителия, не |
||||
|
|
|
|
|
позволяющие |
|
|
|
|
|
|
|
исключить HSIL |
||
|
|
|
|
|
|||
LSIL |
|
Low-grade |
Низкая |
степень |
|||
|
squamous |
intraepithelial |
плоскоклеточного |
||||
|
lesion |
|
|
|
интраэпителиального |
||
|
|
|
|
|
поражения |
|
|
|
|
|
|
|
|||
HSIL |
|
High-grade |
Высокая |
степень |
|||
|
squamous |
intraepithelial |
плоскоклеточного |
||||
|
lesion |
|
|
|
интраэпителиального |
||
|
|
|
|
|
поражения |
|
|
|
|
|
|
|
|||
CIN I |
|
Cervical |
|
Цервикальная |
|||
|
intraepithelial |
neoplasia |
интраэпителиальная |
||||
|
grade 1 |
|
|
неоплазия легкой |
|||
|
|
|
|
|
степени тяжести |
||
|
|
|
|
|
|||
CIN II |
|
Cervical |
|
Цервикальная |
|||
|
intraepithelial |
neoplasia |
интраэпителиальная |
||||
|
grade 2 |
|
|
неоплазия |
умеренной |
||
|
|
|
|
|
степени тяжести |
||
|
|
|
|
|
|||
CIN III |
|
Cervical |
|
Цервикальная |
|||
|
intraepithelial |
neoplasia |
интраэпителиальная |
||||
|
grade 3 |
|
|
неоплазия |
|
высокой |
|
|
|
|
|
|
степени тяжести |
||
|
|
|
|
|
|
|
|
|
|
|
26 |
|
|
|
|
CIS |
Carcinoma in situ |
Карцинома in situ |
|
|
|
|
(преинвазивная |
|
|
|
карцинома) |
|
|
|
|
NOS |
Not |
otherwise |
Не определенные |
|
specified |
|
иначе |
|
|
|
|
SIL |
Squamous |
|
Плоскоклеточное |
|
intraepithelial lesion |
интраэпителиальное |
|
|
|
|
поражение |
|
|
|
|
Заключение ASC-US формируется цитологом в том случае, когда эпителиальные клетки отличаются от нормальных клеток, но количественные
икачественные клеточные изменения недостаточны для постановки диагноза SIL. Заключение ASC-H занимает промежуточное положение между ASC-US
иHSIL.
Таблица 2. Соотношение классификаций предраковых поражений шейки матки
27
Диагноз и степень тяжести CIN устанавливаются только на основании патологоанатомического исследования. Результаты цитологического исследования не всегда совпадают с гистологическим диагнозом.
На основании данных цитологического исследования предложен следующий алгоритм дальнейшего обследования и ведения пациенток. (Таб. 3)
Таблица 3. Алгоритм обследования и ведения пациенток с патологией шейки матки, выявленной при скрининговом исследовании
(согласно КР РФ 2020 года)
|
При наличии ASC-US показано ВПЧ-тестирование; |
|
|||
|
При отсутствии ВПЧ – ко-тестирование через 3 года; |
||||
|
При обнаружении ВПЧ – кольпоскопия: при выявлении |
||||
|
аномальных картин – биопсия, при их отсутствии – ко-тестирование |
||||
ASC-US |
через год; |
|
|
|
|
|
При ASC-US с положительным ВПЧ-тестом может быть |
||||
|
целесообразна |
сортировка |
женщин |
с |
помощью |
|
иммунноцитохимического теста с окрашиванием на р16ink4a/ Ki-67. |
||||
|
|
||||
>ASCUS, |
ВПЧ-тестирование и кольпоскопия, по результатам которых |
||||
после |
определяется необходимость повторной эксцизии/конизации. |
||||
хирургического |
|
|
|
|
|
лечения СIN |
|
|
|
|
|
|
|
|
|
|
|
ASC-H |
ВПЧ-тестирование |
|
|
|
|
|
Кольпоскопия с последующей биопсией при АКК, в том |
||||
|
числе у женщин моложе 25 лет. |
|
|
|
|
|
|
||||
LSIL |
ВПЧ-тестирование, кольпоскопия при АКК-биопсия; |
||||
|
При отрицательном ВПЧ – повторное ко-тестирование через |
||||
|
1 год; |
|
|
|
|
|
При отрицательных результатах обоих тестов через год- |
||||
|
повторный скрининг через 3 года. |
|
|
|
|
|
|
|
|
|
|
Беременные |
ВПЧ-тестирование; |
|
|
|
|
с LSIL |
Кольпоскопия. |
|
|
|
|
|
28 |
|
|
|
При отсутствии подозрения на тяжелое поражение (HSIL) - |
|
повторное обследование после родов (8- 12нед). |
|
|
|
Показана немедленная кольпоскопия |
HSIL |
|
|
Сортировка на основании результатов повторный мазков или |
|
ВПЧ-статуса недопустима. |
|
При полной визуализации ЗТ проводят LLETZ. |
|
При неполной визуализации ЗТ показана LLETZ или |
|
конизация с диагностической и лечебной целью. |
|
Деструкции очагов поражения недопустимы. |
|
|
|
Показана немедленная кольпоскопия |
Беременные |
|
с HSIL |
При отсутствии подозрения на инвазию рекомендовано |
|
наблюдение с цитологическим и кольпоскопическим контролем |
|
каждые 3 месяца. |
|
При подозрении на инвазию - немедленная биопсия. |
|
При отсутствии отрицательной динамики обследование через |
|
8-12 недель после родов. |
|
|
AGC |
ВПЧ-тестирование; |
|
Кольпоскопия; |
|
Выскабливание цервикального канала, биопсия эндометрия у |
|
женщин старше 35 лет. |
|
|
AIS |
ВПЧ-тестирование; |
|
Кольпоскопия; |
|
Конизация шейки матки с последующим выскабливанием |
|
цервикального канала и биопсии эндометрия у женщин старше 35 |
|
лет. |
|
|
29
Молекулярно-биологические методы диагностики
Данные методы направлены на обнаружение частиц ДНК возбудителя ВПЧ в материале (мазок или биоптат) с помощью высокотехнологичных молекулярно-биологических методов.
Анализ на ВПЧ
Существует несколько видов тест-систем для определения ВПЧ, обладающие различной чувствительностью. При всех тестах выполняется молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (на всю группу ВПЧ ВКР).
Виды ВПЧ-тестов:
1.Полимеразная цепная реакция (ПЦР) – многократное копирование определенного участка вирусной ДНК типоспецифическими и видоспецифическими праймерами – качественное определение ВПЧ высокого канцерогенного риска (ВКР) с типированием вируса. Рекомендуется исследование 10-14 типов ВПЧ ВКР;
2.RT (real-time) PCR – ПЦР в реальном времени – оценивается вирусная нагрузка в логарифмах, дифференцируются клинически значимые количества ВПЧ с рисками присутствия неоплазии от малозначимых, соответствующих транзиторной и разрешившейся ВПЧ-инфекции;
3.Качественные ДНК ПЦР-тесты на 14 типов ВПЧ ВКР с частичным генотипированием особо «опасных» типов ВПЧ (16 и 18 типов и остальных);
4.Тест двойного гибридного захвата (Hybrid Capture II – HC2) = ВПЧ Digene-тест. Тест основан на гибридизации участков ДНК ВПЧ ВКР с РНКзондами, улавливаемых антителами с флюоресцентной меткой. При позитивном результате указывается клинически значимая концентрация 13 типов ВПЧ ВКР, в копиях ДНК ВПЧ на 1 мл образца. Отрицательный результат теста практически исключает присутствие CIN2- 3;
5.Тесты на основе обнаружения РНК ВПЧ: PreTect HPV-Proofer (амплификация мРНК Е6/Е7 пяти типов ВПЧ высокого риска (16, 18, 31, 33 и 45)) и Aptima (Gen-Probe) основан на целевом захвате и гибридизации мРНК Е7 для выявления экспрессии мРНК 14 типов ВПЧ ВКР с частичным генотипированием.
Методика получения материала для ВПЧ-исследования:
1. Щеточкой возьмите мазок-соскоб из зоны трансформации с переходной зоной и крипт цервикального канала - щеткой, вращательными
30
движениями обрабатывается сначала часть эктоцервикса, затем она вводится
внижнюю треть канала, где производится 3-5 оборотов;
2.Поместите щеточку в специальный контейнер с консервантом;
3.Промаркируйте контейнер: напишите имя женщины, номер амбулаторной карты или истории болезни и дату;
При самостоятельном приготовлении образца для ВПЧ-теста пациенткой необходимо следовать инструкции к прибору для самозабора материала.
Самым точным методом обнаружения ВПЧ, одобренным FDA, является Digene-тест. Преимущества данного метода заключаются в том, что он не только выявляет ВПЧ высокого онкогенного риска, но и определяет их клинически значимую концентрацию. Результат указывается в цифрах, обозначающих вирусную нагрузку.
Рекомендуется выполнять молекулярно-биологическое исследование отделяемого из цервикального канала на вирус папилломы человека (Papilloma virus) на всю группу ВПЧ ВКР (согласно КР РФ от 2020 г.):
Всем женщинам в возрасте от 30 до 65 лет с целью выявления группы риска предрака и рака шейки матки;
С целью выявления риска рака шейки матки в качестве скринингового метода у всех женщин старше 30 лет каждые 5 лет (у ВПЧ негативных женщин) и ежегодно у ВПЧ позитивных женщин. ВПЧтестирование целесообразно проводить всем женщинам в качестве скринингового метода с 30 лет в сочетании с цитологическим исследованием цервикального образца (co-test);
Пациенткам с цитологическим заключением ASCUS, ASC-H, LSIL, HSIL вне зависимости от возраста.
Целесообразно проведение генотипирования (частичного или полного)
иопределение вирусной нагрузки для оценки риска прогрессирования CIN до инвазии, а также для выбора тактики ведения и контроля эффективности лечения.
Аномальные результаты цитологии – ASCUS на фоне ВПЧ ВКР, ASC- H, LSIL, HSIL являются показанием для проведения кольпоскопии, по результатам которой определяется необходимость биопсии шейки матки. Кольпоскопия также показана всем инфицированным ВПЧ 16 и\или 18 типов, независимо от результатов цитологии.
КОЛЬПОСКОПИЯ
Кольпоскопия – визуальный метод исследования с применением оптической системы и диагностических проб (растворов уксуса и Люголя),
