
диссертации / 116
.pdfОдновременно с воспалительно-некротическими изменениями в костной ткани происходят репаративные процессы. Участки некроза замещаются молодой костной тканью. При ограниченных некрозах кости, своевременном и комплексном лечении, преимущественно у больных молодого возраста, заболевание может закончиться выздоровлением с восстановлением костной структуры, но
приблизительно у 1/3 больных острый остеомиелитический процесс переходит в хронический (Титаренко О.Т. с соавт., 2002).
Ни при одном из вышеперечисленных заболеваний рассасывание костей не
развивается в такой степени, как при лепрозном процессе. Клиническая картина острого неспецифического остеомиелита при лепре имеет свои особенности. Чаще
остеомиелит возникает на фоне выраженных нейротрофических |
изменений |
в |
||
костях |
стоп (Попова А.П., 1962; Торсуев |
Н.А., 1971; Walker |
S.L., Lockwood |
|
D.N., |
2008). В мелких трубчатых костях |
появляются краевые |
деструкции, |
с |
неровными нечеткими контурами за счет гнойного разрушения с включением одного или нескольких мелких секвестров, лишенных костной структуры и имеющих большую плотность, чем окружающая ткань. При острых неспецифических остеомиелитах у больных лепрой преобладают деструктивные процессы, поэтому не наблюдается образования секвестральной коробки и других гиперостозов (Евстратова В.А., 1957; Иванов В.М. и соавт., 2003). Если сопутствующий остеомиелит приобретает хронический характер, развиваются пролиферативные остифицирующие процессы в виде очагов остеосклероза,
воспалительных гиперостозов, оссифицирующих периоститов, остеофитов.
Поражение проксимальных отделов плюсневых костей и предплюсны протекают тяжело, имеет место как деструктивные, так и пролиферативные процессы,
секвестрации нередко подвергаются отдельные кости в целом. Изменения,
вызванные неспецифическим остеомиелитом, развиваются довольно стремительно,
в течение недели процесс может распространиться на несколько костей.
Таким образом, при заболевании лепрой клинико-рентгенологические исследования позволяют констатировать уже сформированные деформации костной ткани, что характерно для глубоких поражений. В связи с этим совершенствование методов диагностики, способствующих раннему выявлению
40
специфического процесса в опорно-двигательном аппарате у больных лепрой,
является одной из актуальных задач медицины.
41
Глава 2. Материалы и методы исследования
2.1. Общая характеристика клинического материала
Для решения поставленных задач было проведено динамическое наблюдение за
210 больными, получавшими амбулаторное лечение. Женщин было 126 (60%),
мужчин – 84 (40%). Возраст пациентов колебался от 38 до 76 лет, составляя в среднем 74,2±1,2 лет.
Больных лепроматозным типом лепры было 159 (71,4%), туберкулоидным – 19
(9%), недифференцированным – 32 (15,3 %). У всех пациентов заболевание находилось в стадии регресса.
Клинические симптомы поражения костной системы в подавляющем большинстве случаев выявлялись поздно – спустя 9-10 лет после постановки основного диагноза
(203 больных или 97%). Редко отмечались ранние изменения мелких костей
(фаланг) (7 больных или 3%): в течение первого года (3 или 1%) и спустя 4 года (2
или 1,2 %). Остеодеструктивные изменения в 1,56 раз преобладали у мужчин по сравнению с женщинами (61% против 39%). У женщин они диагностировались первично преимущественно в возрасте после 20 лет (100%), а у мужчин после 40
лет (95%).
Все пациенты были разделены на основные и группы сравнения. Основных групп было две.
I группа (83 или 39 %) – больные лепрой с остеодеструктивными нарушениями, в
том числе:
61 (73%) с лепроматозным типом,
9 (11%) с туберкулоидным типом,
13(16%) с недифференцированным типом.
II группа (127 или 60 %) – больные лепрой без остеодеструктивных поражений:
98 (77%) с лепроматозным типом,
42
19 (15%) с недифференцированным типом,
10 (8%) с туберкулоидным типом.
IIгруппа больных была разделена на две подгруппы:
IIa (43 или 34 %) – больные со специфическим полиневритом без развития инвалидизирующих осложнений,
IIв (84 или 66%) – больных лепрой со специфическим полиневритом и имеющие трофические язвы.
Группы сравнения были сформированы для оценки динамики лактоферрина
(ЛФ), α-2-макроглобулина (α-2-МГ), щелочной фосфатазы (ЩФ) и остеокальцина
(ОК). В целом они включали 96 человек. Возраст колебался от 35 до 60 лет,
составляя в среднем 54±4 лет. Женщины в 1,3 раза преобладали над мужчинами
(57% против 43%). Характеристика контингента больных групп сравнения:
III группа (23 или 24%) – больные ревматоидным артритом с рецидивирующим течением в стадии обострения заболевания;
IV группа (23 или 24%) – больные туберкулезом опорно-двигательного аппарата в стадии прогрессирования,
V группа (25 или 26%) – больные Астраханской риккетсиозной
лихорадкой (а был ли суставной синдром?)
VI группа (25 или 26%) – больные лихорадкой Ку с артралгическим синдромом в острой стадии.
Вкачестве контрольных значений были использованы данные, полученные О.В. Дегтяревым и соавт. (2005г.), при исследовании 100 здоровых доноров,
сопоставимых по полу и возрасту с исследуемыми группами больных.
Исследование крови у больных лепрой проводили 2 раза в год до начала специфической терапии и после нее, по показаниям – чаще. Кровь брали из локтевой вены, сыворотку отделяли общепринятыми методами. До постановки реакции образцы сыворотки хранили при –200С (Лозинская Т.М. с соавт., 1980).
Часть сывороток крови (образцы ранних лет) были взяты из музея сывороток НИИ по изучению лепры, хранившихся в специальных условиях.
43
2.2.Методы исследования.
Увсех наблюдаемых больных проводили сбор анамнеза заболевания,
оценивали состояние, осматривали кожные покровы. Из общеклинических исследований проводили общий анализ крови, ренгенографию конечностей.
Для определения количественной концентрации лактоферрина (ЛФ) в
сыворотке крови применяли иммуноферментный метод анализа (ИФА),
использовали иммуноферментный коммерческий набор с иммобилизированными антителами к ЛФ (ЗАО «Вектор-Бест», федеральная лицензия № 64/562/98).
Контрольные значения 1002,7+20,4 нг/мл. Аппаратура для ИФА: ASYS Hitech
Gmbh анализатор иммуноферментный планшетный EXPERT PLUS.
Активность щелочной фосфатазы (ЩФ) и остазы (ОС) оценивали по результатам ИФА тест - системой: MicroVue BAP EIA KIT An enzyme immunoassay for the quantization of bone-specific alkaline phosphatase (BAP) in human serum. Quidel
Corporation specialty products. Контрольные значения 40 -109 нг/мл.
Уровень остеокальцина (ОК) в сыворотке определяли методом ИФА с
помощью тест - систем «N-MID Osteocalcin ELISA. Immunodiagnostic systems».
Контрольные значения 1,5 -11 нг/мл.
Концентрацию α–2–макроглобулина (α-2-МГ) определяли методом иммунодиффузии в агаровом геле. Контрольные значения 320-640мг/л. Принцип метода: при двойной диффузии в агаре молекулы антигена и антител между собой образуют преципитат. Линия преципитации становится видимой в проходящем луче света, если реагирующие компоненты находятся в оптимальном соотношении.
С помощью этого метода можно провести анализ антигенной смеси, так |
как |
каждая пара «антиген - антитело» образует свою линию преципитации, |
и |
сравнить антигенные компоненты в различных системах.
Использовали метод двойной диффузии в агаре по O. Ouchterlony (1958) в
модификации Н.И. Храмковой и Г.Л.Абелевой (1961).
44
Техника постановки реакции преципитации в агаре со стандартной тест-
системой
В колбу вносят I г агара и 2,5г NaCl, доливают до объема 100 мл дистиллированной воды. В зависимости от сорта применяемого агара он должен набухать в течение 10-30 минут. Колбу с набухшим агаром помещают в водяную баню. Помешивая стеклянной палочкой, доводят до полного растворения. О
готовности агара судят по прозрачности и однородности раствора. |
|
|||||
Хорошо |
обезжиренные |
и |
протертые |
стекла |
помещают на |
строго |
горизонтальную |
поверхность |
на |
некотором |
расстоянии |
друг от друга. |
Слегка |
остывший агар |
наносят на стекла из вертикально расположенной пипетки в центр |
|||||
стекла в количестве 4-5 мл. Реакцию можно ставить и на стеклах любого другого размера, залитых 2-2,5-миллиметровым слоем 1% агара. В застывшем слое агара
пробивают лунки штампом «семерка» с диаметром 18-20 мм. Агар из лунок
извлекают с помощью иглы, пера или насоса. Несколько минут дают постоять стеклам на воздухе, чтобы произошло приглажение нижних краев лунки к стеклу для предотвращения затекания впоследствии растворов под агар. После этого можно приступать к заполнению лунок жидкостями по предварительно подготовленной росписи. В центральную лунку заливают антисыворотку, в две диаметрально противоположные периферические лунки – тест-антиген. Оставшиеся свободные резервуары заполняют исследуемыми образцами сыворотки крови, других биологических жидкостей или экстрактов тканей. Одну из лунок можно использовать для контрольного раствора (дистиллированная вода, физиологический раствор). Для предотвращения испарения жидкостей и подсыхания агаровой пластинки заполненные стекла помещают в чашки Петри или специальную влажную камеру. При комнатной температуре линии преципитации появляются через 4-6 часов и окончательно формируются через 12-18 часов. Размещение стекол в термостате при
37-38°С значительно ускоряет реакцию. Результаты учитываются по степени подгиба преципитационной линии тест-системы. Если известна чувствительность тест-
системы, то реакция может расцениваться как полуколичественное определение тестируемого белка. Для этого необходимо провести калибровку при различных разведениях. Конечное разведение с отчетливо регистрируемым подгибом умножается на чувствительность тест-системы, которая чаще всего находится в пределах 2-5 мг/л.
45
Классическим примером считается чувствительность ИДА для альбумина в модификации И.Храмковой и Г. И. Абелаева (1961). Например, разведенная в 8 раз сыворотка дала положительный результат при чувствительности тест-системы 5 мг/л.
Значит, в цельной пробе концентрация определяемого антигена составит 5x8 = 40 мг. При полуколичественном анализе важно пользоваться автоматической пипеткой со строго заданным объемом пробы. Разрешающие возможности метода можно повысить путем увеличения объема вносимой пробы расширением лунки или ее двойным наполнением.
Статистическую обработку результатов исследования осуществляли с помощью пакетов программ: Microsoft Office Excel 2007 (Microsoft, США),
BIOSTAT 2008 Professional 5.1.3.1. В зависимости от характера полученных результатов использовали параметрический метод с определением t-критерия Стьюдента с поправкой Бонферрони и Ньюмена-Кейлса для множественных сравнений. Различия между показателями в группах сравнения считали значимыми при p<0,05 и ниже.
46
Глава 3. Собственные результаты и их обсуждение
3.1. Клиническая характеристика больных лепрой,
представленна в исследовании
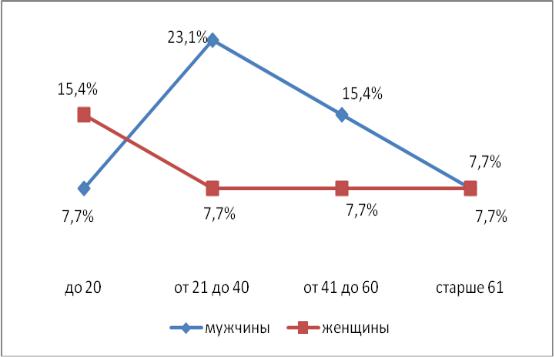
Встречаемость остеодеструктивных осложнений у больных лепрой зависела от типа заболевания, возраста и пола. Они преобладали у пациентов с лепроматозным типом лепры (76,9%), реже регистрировались при недифференцированном типе (15,4%) и у отдельных больных – при туберкулоидном типе (9%).
Клинические симптомы поражения костной системы в подавляющем большинстве случаев выявлялись поздно – спустя 9-10 лет после постановки основного диагноза (203 больных или 97%). Редко отмечались ранние изменения мелких костей (фаланг) (7 больных или 3%): в течение первого года (3 или 1%) и
спустя 4 года (2 или 1,2 %). Остеодеструктивные изменения в 1,6 раза преобладали у мужчин по сравнению с женщинами (61% против 39%). У женщин они диагностировались первично преимущественно в возрасте после 20 лет (100%), а у мужчин после 40 лет (95%).
Рис.1. Частота встречаемости остеодеструкций у пациентов с лепроматозным типом лепры в зависимости от пола и возраста.
47
У больных лепроматозным типом лепры (I группа) при поступлении в стационар можно условно выделить три этапа диагностики остеодеструктивных изменений при первичном обращении больного:
наличие остеомиелита и мутиляций (23,1%);
верификация трофических язв с формирование остеомиелита и мутиляциий в поздние сроки (24,3%);
полная утрата кожной чувствительности конечностей с последующим возникновением остеодеструктивных изменений (52,6%).
Мутиляции были представлены истончением, укорочением и деформацией костей стоп. Важно отметить, что клинические симптомы мутиляций и остеомиелитов в данной группе были диагностированы на десятом году от официальной регистрации заболевания (94%) и только у 2 (2,4%) – в течение четырех лет, а у троих (3,5%) – в течение первого года. Это указывает на необходимость совершенствования методов ранней диагностики остеодеструктивных изменений при лепроматозном типе лепры, доля которой среди больных превышает ¾.
У больных c лепроматозным типом лепры полную утрату кожной чувствительности в области фаланг, голени, предплечий наблюдали в 76,8%
случаев, а в 23,2% зарегистрировано только ее снижение. Остеодеструктивные процессы только фаланг стоп первично возникали у 2/3 (67%) больных. У трети
(33%) сначала развивался остеомиелит фаланг кистей, который прогрессировал и распространялся на фаланги стоп, приобретая генерализованный характер.
Остеодеструктивные изменения у больных I группы с туберкулоидным типом лепры были представлены на рентгенограммах в виде очагов просветления с нечеткими краями, информирующими о наличии остеопороза. Остеолизис у них проявлялся в виде мутиляции фаланг кистей (54%) и стоп (46%), которые развивались в течение 2–3 лет от момента регистрации лепры. Несмотря на проводимое специфическое лечение, остеодистрофические процессы прогрессировали с формированием хронического остеомиелита. У всех больных с туберкулоидным типом лепры развитию клинической симптоматики остеолизиса предшествовало образование трофических язв. Динамика остеодистрофического процесса была следующей: трофические язвы (100%) – остеопороз (100%)–
48
остеолизис с мутиляциями фаланг кистей (54%) и стоп (46%) с развитием хронического остеомиелита (100%).
Деструктивные изменения костей у больных I группы с недифференцированным типом лепры так же сопровождались развитием остеопороза с переходом в остеолизис в виде развития хронического остеомиелита.
При этом клиническая симптоматика была представлена формированием мутиляций фаланг, которым в 100% случаев предшествовали трофические изменения мягких тканей. На рентгенограммах у этих больных воспалительные процессы были представлены в виде очагов просветления с неровными краями и узкопетлистой структуры, за счет формирования остеосклероза в губчатых участках костей. Динамика остеодистрофического процесса была следующей:
трофические язвы (100%) – остеопороз (100%)– остеолизис, мутиляции,
остеомиелит (100%) – остеосклероз в губчатых участках костей.
У всех больных I группы обострения остеодеструктивных процессов развивались достаточно быстро с момента появления болей в фалангах пальцев и возникновения трофических изменений мягких тканей. Этот период в среднем составлял 8,5 – 10 недель, а у 9% больных с лепроматозном типом лепры он даже сокращался до 3 недель.
При исследовании периферической крови было выявлено, что у больных при остеодеструктивных нарушениях общее количество лейкоцитов изменялось в пределах от 4,4 -7,1х 109/л и только в 16,7% случаев увеличивалось до 10,0х 09/л.
Среднестатистические параметры данного показателя не отличались от таковых контрольной группы и больных без остеодеструктивных нарушений. У больных обеих групп, в сравнении с контролем, было выявлено достоверное (р<0,001)
снижение эозинофилов до 1,5±0,53% в Iгруппе и 1,4±0,62% во II гуппе при контроле ‒ 4,3±0,26%. У больных с остеодеструктивными нарушениями прослеживалось достоверное (р<0,01) повышение содержания сегментоядерных нейтрофилов до 63,4±0,93% при контроле 59,5±1,02% и снижение содержания молодых форм лейкоцитов(р<0,05) до 1,2±0,42% при контроле 2,1±0,35%. У
больных лепрой без остеодеструкций, напротив, в сравнении с контролем и I
группой фиксировали достоверно (р<0,001) повышенный уровень лимфоцитов
(32,5±0,38% с 28,5±0,61% и 29,1±0,54% соответственно). Скорость оседания
49
