
- •3. Нуклеосома как единица структурной организации хроматина. Октамер гистонов в составе нуклеосомы. Линкер и линкерный гистон.
- •4. Полуконсервативный механизм репликации днк. Опыт Мезельсона и Сталя (1958).
- •5. Свойство анипаралленльности цепей в молекуле днк. Биологический смысл. Правило Чаргаффа.
- •6. Конформационные формы молекулы днк. Денатурация и ренатурация днк. Температура отжига (плавления) днк.
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •11. Транскрипция у прокариот. Основные этапы транскрипции: инициация, элонгация, терминация. Регуляция транскрипции (в вопросе 10).
- •12. Транскрипция у эукариот. Основные этапы транскрипции: инициация, элонгация, терминация. Регуляция транскрипции (в вопросе 10).
- •16. Рекомбинантная днк. Инструментарий для создания рекомбинантных молекул днк.
- •17. Системы рестрикции-модификации (r-m системы), их биологическая роль.
- •19. Клонирование днк in vitro.
- •21. Плазмиды. Плазмидные векторы для клонирования in vivo. Методы трансформации плазмидной днк. Скрининг (отбор) трансформированных бактериальных клеток.
- •22. Получение библиотеки геномной днк с помощью плазмидных векторов.
- •24. Плазмидный вектор для экспрессии гена. Экспрессионные векторы.
- •30. Метод гель-электрофореза. Назначение метода и принцип его действия. Разделение и анализ фрагментов днк. Маркеры молекулярного веса днк. Красители, применяемые при проведении гель-электрофореза.
- •31. Пцр и ее применение
- •Подготовки исследуемой пробы материала, которая в большинстве случаев сводится к выделению днк или рнк;
- •Собственно полимеразной цепной реакции;
- •Детекции продукта пцр (амплифицированной нуклеиновой кислоты).
1. Ученые, сделавшие великие открытия в молекулярной биологии Джеймс Уотсон, Френсис Крик, Розалинд Франклин, Эрвин Чаргафф, Хар Гобинд, Роберт Уильям, Уоррен Ниренберг, Кэри Муллис, Смит Майкл, Арбер Вернер, Натанс Даниел, Хэмилтон Смит.
Уотсон Джеймс (06.04.1928, Чикаго), американский биохимик, специалист в области молекулярной биологии, член Национальной АН США (1962), Американской академии искусств и наук (1957), Датской королевской АН (1962). Окончил Чикагский университет (1947). Работал в Копенгагенском университете (1950–51), в Кавендишской лаборатории Кембриджского университета (1951–53 и 1955–56), Калифорнийском технологическом институте (1953–55). С 1956 преподавал биологию в Гарвардском университете (с 1961 профессор). С 1962 консультант президента США по науке. С 1968 директор лаборатории количественной биологии в Колд-Спринг-Харборе (штат Нью-Йорк).
Основные работы по изучению структуры дезоксирибонуклеиновой кислоты (ДНК), роли рибонуклеиновой кислоты (РНК) в биосинтезе белка. Совместно с Ф. Криком в 1953 предложил модель пространственной структуры ДНК (т. н. «двойную спираль»), что позволило им объяснить, каким образом генетическая информация записана в молекулах ДНК, и высказать гипотезу о механизме её самовоспроизведения (репликации). С появлением этой работы связывают рождение молекулярной генетики. Автор гипотезы (совместно с Ф. Криком) полуконсервативного механизма репликации ДНК. Известен также работами по структуре вирусов и их роли в возникновении злокачественного роста тканей. Нобелевская премия (1962, совместно с Ф. Криком и М. Уилкинсом).
Крик Фрэнсис (08.06.1916, Нортгемптон), английский биофизик, удостоенный в 1962 Нобелевской премии по физиологии и медицине (совместно с Дж. Уотсоном и М. Уилкинсом) за открытие молекулярной структуры ДНК. Окончил Милл-Хилл-скул и Юниверсити-колледж в Лондоне. В 1953 получил степень доктора философии в Кембриджском университете. В 1937–39 и с 1947 работал в Кембриджском университете (с 1963 – заведующим лабораторией молекулярной биологии). Во время Второй мировой войны был сотрудником научного отдела Адмиралтейства, участвовал в создании магнитных мин. В 1953–54 работал в Бруклинском политехническом институте (Нью-Йорк) в рамках программы по изучению структуры белков, в 1962 – в Лондонском университете.
Основные работы Крика посвящены молекулярной структуре нуклеиновых кислот. Проанализировав полученные М. Уилкинсом данные по рассеянию рентгеновских лучей на кристаллах ДНК, Крик вместе с Дж. Уотсоном построил в 1953 модель трёхмерной структуры этой молекулы (модель Уотсона–Крика). Согласно этой модели, ДНК состоит из двух комплементарных цепей, образующих двойную спираль. Такая структура не только соответствовала известным химическим данным о ДНК, но и объясняла механизм ее репликации, обеспечивающий передачу генетической информации при делении клетки. В 1961 Крик и его сотрудники установили основные принципы генетического кода, показав, каким образом последовательность азотистых оснований, мономерных единиц ДНК, переводится (транслируется) в последовательность аминокислот, мономерных единиц белка.
Открытия Крика и Уотсона легли в основу молекулярной генетики и позволили изучать живые организмы на молекулярном уровне. Крик – автор книг «О молекулах и человеке» (1966) и «Жизнь как она есть» (1981), в которых обсуждается возможность внеземного происхождения жизни.
Розалинд Франклин (25 июля 1920 — 16 апреля 1958) — английский биофизик и учёный-рентгенограф, занималась изучением структуры ДНК.
Розалинд Франклин известна в большей степени своей работой над получением рентгенограмм структуры ДНК. Сделанные ею снимки отличались особой чёткостью и, по некоторым сведениям, послужили основанием для выводов о структуре ДНК, сделанных и опубликованных впоследствии в журнале «Nature» работавшими в Кавендишской лаборатории Кембриджского университета Джеймсом Уотсоном и Фрэнсисом Криком.
Одним из важнейших вкладов Франклин в модель Уотсона-Крика стала её лекция, проведенная в ноябре 1951 года, где она представила присутствующим, среди которых был и Уотсон, две формы молекулы, типа А и типа В, а также её строение, при котором фосфатные группы расположены с наружной части молекулы. Она также определила количество воды в молекуле и соотношение её в различных частях молекулы - данные, которые были чрезвычайно важны для сохранения стабильности молекулы. Франклин первая открыла и сформулировала те факты, которые впоследствии составили основу для последующих попыток построить модель молекулы. Ещё одним вкладом стала рентгенографический снимок В-ДНК (названный фотографией 51), который был мельком показан Джеймсу Уотсону Морисом Уилкинсом в январе 1953 года. После завершения работы над своей частью исследования ДНК Франклин начала первую в своем роде работу по исследованию вирусов табачной мозаики и полиомиелита.
Правила получения Нобелевской премии запрещают присуждение премии посмертно, а, так как Розалинд Франклин умерла в 1958 году, она не имела права быть выдвинутой на номинацию Нобелевской премии, которую впоследствии присудили Крику, Уотсону и Уилкинсу в 1962 году. Премия была присуждена за их наследие в области исследования нуклеиновых кислот, а не исключительно за открытие структуры ДНК. К моменту вручения премии Уилкинс занимался исследованиями структуры ДНК в течение уже более 10 лет и многое сделал для подтверждения модели Уотсона-Крика. Крик занимался генетическим кодом в Кембридже, а Уотсон в течение нескольких лет занимался исследованиями РНК.
Эрвин Чаргафф родился 11 августа 1905 года в городе Черновицы в семье банковского служащего. Высшее образование получил в Венском университете, где в 1928 году защитил докторскую диссертацию и стал научным сотрудником. Работал в лаборатории обменной химии в Йельском университете в США (1928—1930), в Берлинском университете (1930—1933). В 1933 эмигрировал из Германии в связи с приходом к власти нацистов, в 1933—1934 работал вПастеровском институте в Париже. С 1935 года в Колумбийском университете в Нью-Йорке (с 1952 года — профессором, с 1970 —заведующим кафедрой биохимии, с 1974 — профессором биохимии в лаборатории клетки.
Главным направлением научной деятельности было изучение химического состава и структуры нуклеиновых кислот. Эрвин Чаргафф определил количественное отношениеазотистых оснований, входящих в их состав. В 1950 — 1953 годах им было показано, что общее количество адениновых остатков в каждой молекуле ДНК равно количествутиминовых остатков, а количество гуаниновых остатков — количеству цитозиновых. Правила Чаргаффа использовали Фрэнсис Крик и Джеймс Уотсон при определении структуры ДНК в виде двойной спирали. Также Чаргафф доказал, что ДНК обладает видовой специфичностью, и отверг гипотезы о существовании многих разновидностей ДНК. Эрвин Чаргафф был первым кто начал исследовать денатурацию ДНК. Кроме того, он занимался исследованием свертывания крови, изучал липиды и липопротеины и метаболизмаминокислот.
Корана, Хар Гобинд (Har Gobind) (1922– 2011), индийско-американский биофизик, Лауреат Нобелевской премии по физиологии и медицине 1968 (совместно с Робертом Уильямом Холли и Маршаллом Ниренбергом).
Родился в Райпуре, маленькой деревушке в штате Пенджаб (в настоящее время западная часть Пакистана). Предположительная дата рождения, записанная в документах 9 января 1922, но настоящая дата рождения неизвестна. Его отец был так называемым «патвари», сборщиком сельскохозяйственных налогов.
В 1945 он получил государственную стипендию, позволившую талантливому ученому поехать в Англию, в Ливерпульский университет. Это было первое знакомство Корана с западной цивилизацией и культурой.
В университете он изучал органическую химию, и в 1948 защитил докторскую диссертацию. После защиты диссертации уехал в Цюрих.
Зимой 1949 Корана вернулся в Индию, но через несколько месяцев опять уехал в Англию на этот раз работать в Кембриджском университете вместе с профессором Дж.В.Кеннером и профессором А.Р.Тоддом.
Именно в этот период он начал интересоваться биохимией протеинов (протеин белок, состоящий только из остатков аминокислот) и нуклеиновых кислот (нуклеиновые кислоты полинуклеотиды, важнейшие биологически активные биополимеры; содержатся в каждой клетке всех организмов) – высокомолекулярных органических соединений, содержащихся в ядрах клеток.
Особый интерес ученого вызывают исследования по изучение химической структуры ацетилкоэнзима А (ацетилкоэнзим А химически активная форма ацетата, молекула с двумя атомами углерода).
В 1949 Корана и его коллеге Джону Моффату удалось синтезировать ацетилкоэнзим А. Разработанный ими метод был гораздо проще и дешевле, и позволял синтезировать ацетилкоэнзим А в количествах, необходимых для лабораторных исследований. Это открытие принесло ему мировую известность. (К концу 1940-х учеными был разработан метод выделения ацетилкоэнзима А из дрожжей, но этот способ был слишком сложным и дорогостоящим.)
В 1964 стал профессором биологии в Висконсинском университете. Главной темой его исследований становится биохимия нуклеиновых кислот, природа генов и биосинтез клеточных белков.
Нуклеиновые кислоты были открыты еще в конце 19 в., а в первой половине 20 в. ученым удалось выделить две основные нуклеиновые кислоты: рибонуклеиновую кислоту (РНК) (рибонуклеиновые кислоты – тип нуклеиновых кислот; высокомолекулярные органические соединения, образованные нуклеотидами, в которые входят: аденин, гуанин, цитозин, урацил и сахар рибоза; в клетках всех живых организмов РНК участвуют в реализации генетической информации) и дезоксирибонуклеиновую кислоту (ДНК) (дезоксирибонуклеиновая кислота – высокополимерное природное соединение, содержащееся в ядрах клеток живых организмов).
Роберт Уильям (Holley, Robert William) (1922–1993), американский биохимик, лауреат Нобелевской премии по физиологии и медицине 1968 (совместно с Харом Гобиндом Кораной и Маршаллом Ниренбергом).
Родился 28 января 1922 в Урбане, штат Иллинойс, в семье школьного учителя. В 1942 получил степень бакалавра и перевелся в университет Корнелла, продолжить изучение курса органической химии. Но закончить образование он смог только в 1947. После вступления Соединенных Штатов Америки во Вторую мировую войну Холли работал под руководством профессора Винсента ди Вино медицинском колледже при Корнелльском университете: по заданию военного ведомства ученые синтезировали антибиотик пенициллин. После окончания войны, в 1947 он защитил диплом и получил степень доктора философии. В том же 1947 он стал стипендиатом Американского химического общества, что позволило ему в течение двух лет (1947–1948) стажироваться в Вашингтонском университете в лаборатории профессора Карла М.Стевенса.
После окончания стажировки он вернулся в Корнелльский университет, где работал ассистентом профессора по органической химии на экспериментальной станции «Женева». Там он начал серию экспериментов по изучению биохимии нуклеиновых кислот (нуклеиновые кислоты полинуклеотиды, важнейшие биологически активные биополимеры, содержатся в каждой клетке всех живых организмов).
Основной темой его научных изысканий в те годы было изучение рибонуклеиновой кислоты (РНК) (рибонуклеиновые кислоты тип нуклеиновых кислот; высокомолекулярные органические соединения, образованные нуклеотидами; в клетках всех живых организмов РНК участвуют в реализации генетической информации).
Нуклеиновые кислоты были открыты еще в конце 19 в., а в первой половине 20 в. ученым удалось выделить две основные нуклеиновые кислоты: рибонуклеиновую кислоту (РНК) и дезоксирибонуклеиновую кислоту (ДНК) (дезоксирибонуклеиновая кислота высокополимерное природное соединение, содержащееся в ядрах клеток живых организмов; носитель генетической информации)
Через четыре года после начала работы в Агрохимической лаборатории при Национальной лаборатории сельского хозяйства Холли стал профессором биохимии. А в 1964 вернулся в родной Корнелльский университет, где занял должность профессора биохимии и молекулярной биологии. В 1965–1966 стал деканом факультета биохимии.
В начале 1960-х Маршаллу У.Ниренбергу удалось открыть основной триплетный код (триплетный код система, состоящая из трех азотистых оснований, которая определяет местоположение аминокислоты с молекуле белка при его синтезе) для аминокислоты фенилаланина.
Вдохновленный успехом Ниренберга, Холли начал серию опытов, главная цель которых, синтез молекул транспортной РНК (транспортная РНК растворимая и низкомолекулярная РНК, являющаяся переносчиком аминокислот к рибосомам во время синтеза полипептидной цепи) с нуклеотидной последовательностью, специфичной для фенилаланина. Им удалось определить ее нуклеотидную последовательность. Результаты проведенных исследований Холли обобщил в статье, опубликованной в 1965 в журнале «Science».
Уоррен Ниренберг (Nirenberg) Маршалл родился 10 апреля 1927 года в Бруклине в семье выходцев из Российской империи, умер в 2010 году в Нью-Йорке.
Американский биохимик, член Национальной АН США (1967) и Американской академии искусств и наук (1966). Окончил университет штата Флорида (1952). Работал в Мичиганском университете (1952–57), институте артритов и болезней обмена веществ (с 1957); с 1962 заведующий лабораторией биохимической генетики Линговского национального института сердца.
Основные труды посвящены расшифровке генетического кода. Ниренберг показал, что полиуридиловая кислота служит матрицей синтеза полифенилаланина и что кодон УУУ (урацил-урацил-урацил) определяет включение аминокислоты фенилаланина в полипептидную цепь в процессе биосинтеза белка. В 1968 году Ниренберг вместе с Робертом Холли и Харом Гобиндом Кораной получили Нобелевскую премию «за расшифровку генетического кода и его функционирования в синтезе белков».
В начале 60-х годов они провели серию экспериментов, которая позволила им расшифровать генетический код. Сначала они синтезировали полиурацил, молекулу РНК, которая содержит только урацил (РНК в отличие от ДНК содержит урацил вместо тимина). Затем исследователи поместили полиурацил в бесклеточную экспериментальную систему, образованную осторожным размельчением бактерий, способствующим получению смеси аминокислот, РНК, рибосом, необходимых ферментов и других веществ. Полиурациловая РНК направляла синтез молекулы белка, состоящего из цепочки молекул аминокислоты фенилаланина. Следовательно, код для фенилаланина представлял собой триплет урацил-урацил-урацил (т. к. урацил является единственным азотистым основанием в полиурациле), или УУУ.
Поскольку ДНК содержит 4 азотистых основания, а генетический код образуется из триплетов азотистых оснований, то существует 64 (4х4х4) возможные триплетные комбинации для ДНК. Ниренбергу и его коллегам удалось синтезировать все возможные триплетные последовательности, повторив бесклеточные эксперименты с каждой из них и открыв таким путем коды триплетов азотистых оснований для всех 20 аминокислот. Некоторые из аминокислот кодируются более чем одним триплетом, а некоторые триплеты известны как "бессмысленные", т. к. они не кодируют ни одну аминокислоту. Ниренберг обнаружил, что "бессмысленные триплеты", как точка в предложении, могут сигнализировать об окончании процесса биосинтеза в клетке. Он и его коллеги провели позднее дополнительные эксперименты, чтобы определить последовательность азотистых оснований в каждом триплете.
Кэри Муллис родился 28 декабря в г. Ленуар (Северная Каролина). Семья жила рядом с фермой деда.
После окончания средней школы учился Технологическом институте штата Джорджия, где получил степень бакалавра в 1966. Затем была степень доктора по биохимии в Калифорнийском университете в Беркли в 1972, где он преподавал биохимию до 1973.
В 1973 стал постдокторантом по детской кардиологии Университета Канзасской медицинской школы по проблеме, связанной с васкулярной физиологией легких. В 1977 по 1979 работал в области фармацевтической химии в Калифорнийском университете в Сан-Франциско.
В 1979 поступил на работу в компанию «Сетус» в Эмервилле (Калифорния) в качестве биохимика, специалиста в области ДНК. Занимался синтезом олигонуклеотидов и в результате изобрел метод полимеразной цепной реакции (ПЦР), основную концепцию которого развил к 1983.
Метод включает четыре компонента: сегмент двойной спирали ДНК, называемый темплатной ДНК, который следует копировать, два олигонуклеотидных праймера (короткие отрезкив односпиральной ДНК, каждый из которых комплементарен одной из коротких последовательностей темплатной ДНК), нуклеотиды – химические строительные блоки, из которых строится молекула ДНК, и фермент полимераза, который копирует темплатную ДНК, присоединяя к ней свободные нуклеотиды в правильной последовательности.
Эти ингредиенты нагревают, что вызывает разъединение двойной спирали темплатной ДНК на отдельные спирали. Смесь охлаждают, чтобы праймеры связались с комплементарными концами отрезков темплатных цепей. Затем полимераза начинает копировать темплатные отрезки присоединением нуклеотидов на один из концов праймеров и в итоге производя двойную спираль ДНК.
Повторение цикла увеличивает количество ДНК по экспоненте: каждые 30 циклов, что занимает всего несколько минут, дают более миллиарда копий исходной последовательности ДНК.
В августе 1984 Муллис доложил свою идею на семинаре фирмы, но коллеги восприняли ее безразлично. Единственным человеком, поддержавшим его идею, был основатель фирмы «Биосёрч», выпускающей аппараты для автоматического синтеза олигонуклеотидов.
Первую версию статьи Муллиса и соавторов по методу ПЦР редакция журнала «Science» отклонила. Все же он опубликовал статьи и в «Science» (1985), и в «Nature» (1986). А метод ПЦР стал быстро распространяться в практике.
Метод ПЦР относится к числу фундаментальных научных технологий 20 в. Он позволяет всего за несколько часов перевести микрограммы генетического материала в приемлемые для последующих исследований количества вещества. Метод широко применяется в медицине, генетике, биотехнологии, судебной медицине и др.
Например, в медицинской диагностике можно быстро идентифицировать источник бактериальной или вирусной инфекции непосредственно из малого образца генетического материала. ПЦР используют для обследования пациентов с наследственными заболеваниями. Биологи применяют ПЦР для генетического анализа ископаемых остатков. Так сложилась основа новой научной дисциплины – палеобиологии.
В 1986 Муллис стал руководителем по молекулярной биологии в фирме «Кситроникс» в Сан-Диего, Калифорния, где его деятельность была связана с ДНК-технологиями и фотохимией. В 1987 – консультант более дюжины корпораций, включая «Итсмен Кодак», «Эбботс лэбс» и др.
В 1993 Муллис получил Нобелевскую премию «за вклад в развитие методов химии на основе ДНК – за изобретение метода полимеразной цепной реакции».
Ему принадлежит ряд патентов, среди которых изобретения, связанные с применением ПЦР-технологии к светочувствительным пластикам, изменяющим окраску при освещении.
Смит Майкл (Smith, Michael) (1932–2000) родился 26 апреля 1932 на южном побережье Англии в Блэкпуле. В 1950 при финансовой поддержке комитета по образованию Блэкпула Смит поступил в Манчестерский университет и закончил его в 1953. В 1956 получил докторскую степень.
Он приехал в Ванкувер в сентябре 1956. Ему была поручена разработка эффективного способа синтеза нуклеозид-5-фосфатов. Изученный в процессе работы класс защитных групп теперь используется в современном автоматизированном синтезе фрагментов ДНК и РНК.
В 1960 Смит перешел в Институт исследований ферментов при Висконсинском университете, где работал над синтезом олигорибонуклеотидов, самой острой в то время химической проблемой в области нуклеиновых кислот.
Он создал новый метод синтеза нуклеозид-3,5-циклофосфатов. Смит стал канадским гражданином в 1964.
Первым разработал метод направленного мутагенеза в начале 1970-х и несколько лет его совершенствовал. В 1978 Смит и его сотрудники достигли первых успехов в направленном мутагенезе молекулы ДНК бактериофага, а в 1982 они уже смогли производить большие количества фермента, в котором с помощью своего метода заменяли любую выбранную аминокислоту в аминокислотной последовательности фермента.
Метод стал новым способом изучения функции белков. Аминокислотную последовательность белка, а, следовательно, и его функцию можно модифицировать, если вызвать мутацию в нуклеотидной последовательности гена. Затем структуру и функцию модифицированного белка можно сопоставить со свойствами неизмененного природного полипептида. До появления метода Смита техника биохимического эксперимента по созданию генетических мутаций была неточным и часто случайным инструментом, а сам эксперимент – трудоемким и длительным. Смит поправил положение, создав методику направленного мутагенеза, заключающуюся в специфическом мутагенезе в желаемом месте гена. Это дало возможность экспериментаторам определять роль и место каждой аминокислоты в структуре и функции белка.
Направленный мутагенез стал мощным инструментом генной инженерии. Помимо его ценности для фундаментальных исследований направленный мутагенез нашел множество применений в медицине, сельском хозяйстве, промышленности. Например, с его помощью можно создавать вариант белка, более стабильный, или более активный, или более полезный, чем его природный предшественник.
В 1993 Смит вместе с Маллисом получил Нобелевскую премию «за фундаментальный вклад в установление направленного мутагенеза, основанного на олигонуклеотидах, и за его развитие для изучения белков». В 1995 в одном из интервью предсказал изменения в биологической науке. С завершением проекта по геному человека становится известной общая нуклеотидная последовательность ДНК для всех генов. Эти гены составляют код для каждого их 100 000 разновидностей белков, нужных организму, однако мы понимаем кое-что лишь не более чем о 5 000 из них. Расшифровка информации о связи нуклеотидных последовательностей генома с оставшейся частью аминокислотных последовательностей будет представлять собой достаточно трудоемкую задачу.
Умер 4 октября 2000.
Арбер Вернер (03.06.1929, Гренхен) швейцарский учёный, специалист в области молекулярной биологии. В 1949 он поступил в Швейцарскую политехническую школу в Цюрихе для изучения естествознания.
В 1953 Арбер поступил в аспирантуру Женевского университета и стал старшим лаборантом кафедры биофизики. Здесь он разрабатывал методы изучения бактериофагов с помощью электронной микроскопии.
В 1958 Арбер получил в этом университете докторскую степень, защитив диссертацию, посвященную дефектам мутантного штамма бактериофага λ, и далее в течение двух лет работал научным сотрудником на кафедре микробиологии университета Южной Калифорнии.
В 1962 Арбер выявил механизм рестрикции-модификации. При этом процессе ДНК бактериофага расщепляется на фрагменты под действием рестрикционного фермента эндонуклеазы, действующего совместно с метилазой. При этом бактериальная эндонуклеаза распознает опредёленную последовательность нуклеотидов в бактериофагальной ДНК и в соответствующих участках расщепляет эту ДНК, тем самым инактивируя её. Метилаза же распознаёт такую же последовательность в ДНК бактериальной клетки, метилирует её и тем самым предохраняет от ферментативного разрушения собственной эндонуклеазой.
В 1965 Арбер стал адъюнкт-профессором молекулярной биологии Женевского университета. Спустя год он женился. У Арбер и его жены Антонии две дочери. В конце 60-х гг. Арбер ушёл из Женевского университета и принял предложение стать профессором Биологического центра – нового научно-исследовательского института, создававшегося при Базельском университете. Здесь для Арбера открывались широкие исследовательские возможности. По возвращении в Швейцарию Арбер стал профессором молекулярной биологии Базельского университета.
В 1978 Арберу совместно с Даниелом Натансом и Хамилтоном Смитом была присуждена Нобелевская премия по физиологии и медицине за обнаружение рестрикционных ферментов и их применение в молекулярной генетике. Применение рестрикционных ферментов, – продолжал он, – произвело переворот в генетике высших организмов и полностью изменило наши представления об организации их генов. Оказалось, что в отличие от ДНК бактерий ДНК высших организмов – это не непрерывная последовательность, кодирующая один белок: в генах имеются нейтральные участки, чередующиеся с участками, хранящими генетический код .
Продолжая свои исследования в Базельском университете, Арбер заинтересовался различными типами генных систем, рекомбинацией и диверсификацией генов. ир
Нобелевская премия (1978) совместно с Д. Натансом и Х. Смитом.
Натанс Даниел (1928) - еврей, микробиолог и генетик, профессор. Открыл ферменты (рестриктазы), расщепляющие ДНК и впервые применил их в молекулярной генетике. Родился в Вилмингтоне (штат Делавэр, США). В 1946-50 изучал математику, химию и др. предметы в Делавэрском университете, закончил его со званием бакалавра. Поступив затем в медиц. школу Вашингтонского ун-та в Сент-Луисе, он закончил ее с медиц. степенью.
Натанс изучал биосинтез белка, в частности миеломного; идентифицировал некоторые бактериальные факторы, ускоряющие включение аминокислот в белковые молекулы; изучал роль РНК бактериофагов в синтезе их белков; изучая вирусы животных, заинтересовался онкогенным вирусом-40 обезьян и сконцентрировал свое внимание на анализе локализации и функционирования генов ДНК этого вируса. Используя в биохимии. свойства нуклеиновых кислот, состав и назначение ферментов и коферментов, химич. структура и функции ДНК (состав нуклеотидов, комплементарности нуклеотидных цепей и характер их соединений, механизм репликации ДНК и синтеза белковых молекул), а также выделены в чистом виде ферменты, ответственные за биосинтез ДНК и РНК.
Проведя важную серию экспериментов, Натанс и его коллеги расшифровали в начале 60-х генетич. код и обнаружили, что он образуется из триплетов азотистых оснований. Они открыли коды этих триплетов для всех 20 аминокислот и определили последовательность азотистых оснований в каждом триплете. Был выявлен механизм управления генетич. кодом синтеза всех белков, необходимых организму для поддержания своего существования, а также передачи наследственных признаков. В своей Нобелевской лекции Натанс сказал: "Передача информации от нуклеиновой кислоты к белковому синтезу происходит последовательно, в соответствии с систематич. кодом по относительно простым правилам. Каждая единица нуклеиновой кислоты определяет вид отобранных молекул, их положение относительно предыдущей отобранной молекулы и время события относительно предыдущего. Таким образом, нуклеиновая кислота функционирует одновременно как матрица для других молекул и как биологии. часы". Расшифровав код, Натанс предоставил сведения, которые со временем позволят ученым контролировать наследственность и устранять заболевания, вызванные генетич. дефектами. Eгo работа дала основание предположить, что генетич. код млекопитающих существует уже несколько миллиардов лет и что он одинаков у всех видов. С 1966 Натанс - главный биохимик в генетич. лаборатории Нац. ин-та сердца, легких и крови.
Хэмилтон Смит (родился 23 августа 1931, Нью-Йорк, США) — американский микробиолог, лауреат Нобелевской премии в области медицины и физиологии 1978 года.
Хэмилтон Смит родился 23 августа 1931 года в Нью-Йорке, где в то время его отец был аспирантом в Колумбийском университете. Окончил школу в городе Урбана (Иллинойс) и начал учиться в Университете Иллинойса в Урбана-Шампейн, но в 1950 году перевелся в Калифорнийский университет Беркли, который и закончил в 1952 году по специальности математика. В 1956 году Смит получил медицинскую степень в Университете Джонса Хопкинса. В 1957-1959 годах служил в армии в Сан-Диего. В 1959 году начал работу в Госпитале Генри Форда (Детройт, Мичиган), где заинтересовался новой тогда наукой, молекулярной биологией.
В 1962 году Смит начал работать в Университет Мичигана в Энн-Арбор, где вместе с Майроном Левиным (англ. Myron Levine) занимался исследованием фага P22 сальмонеллы (Salmonella Phage P22) и открыл ген, контролирующий прикрепления бактериофага, int. В 1967 году получил должность в Университете Джонса Хопкинса. Майрон Левин в это время работал в Швейцарии с Вернером Арбером над явлениями рестрикции и модификации у бактерий. Смит также начал заниматься этими явлениями, в результате которых были открыты рестрикционных ферменты.
В 1978 году Хэмилтон Смит, другой американский микробиолог Даниэл Натанс и швейцарский микробиолог и генетик Вернер Арбер получили Нобелевскую премию по медицине и физиологии за открытие рестриктаз, широкое использование которых в молекулярной биологии фактически революционизирующее эту науку.
2. Нуклеиновые кислоты. Строение РНК и ДНК
К нуклеиновым кислотам относят высокополимерные соединения, распадающиеся при гидролизе на пуриновые и пиримидиновые основания, пентозу и фосфорную кислоту. Нуклеиновые кислоты содержат углерод, водород, фосфор, кислород и азот. Различают два класса нуклеиновых кислот: рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК).
Химические связи между частями нуклеотида ковалентные, образующиеся в результате реакций конденсации (т. е. с выделением молекул воды). Конденсация обратна гидролизу.
В нуклеотиде первый атом углерода пентозы связан с азотистым основанием (связь C-N), а пятый — с фосфорной кислотой (фосфоэфирная связь: C-O-P).
Существуют два основных типа нуклеиновых кислот — ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). В составе РНК сахар представлен рибозой, а в ДНК — дезоксирибозой. В обоих случаях в нуклеиновых кислотах встречается циклический вариант пентоз. Дезоксирибоза отличается от рибозы отсутствием атома кислорода при втором атоме углерода.

Наличие дополнительной гидроксильной группы (-OH) у рибозы делает РНК молекулой, легче вступающей в химические реакции.
В составе нуклеотидов нуклеиновых кислот обычно встречаются следующие азотистые основания: аденин (А), гуанин (Г, G), цитозин (Ц, C), тимин (Т), урацил (У, U).
Строение и функции ДНК
ДНК — полимер, мономерами которой являются дезоксирибонуклеотиды. Модель пространственного строения молекулы ДНК в виде двойной спирали была предложена в 1953 г. Дж. Уотсоном и Ф. Криком (для построения этой модели они использовали работы М. Уилкинса, Р. Франклин, Э. Чаргаффа).
Молекула ДНК образована двумя полинуклеотидными цепями, спирально закрученными друг около друга и вместе вокруг воображаемой оси, т.е. представляет собой двойную спираль (исключение — некоторые ДНК-содержащие вирусы имеют одноцепочечную ДНК). Диаметр двойной спирали ДНК — 2 нм, расстояние между соседними нуклеотидами — 0,34 нм, на один оборот спирали приходится 10 пар нуклеотидов. Длина молекулы может достигать нескольких сантиметров. Молекулярный вес — десятки и сотни миллионов. Суммарная длина ДНК ядра клетки человека — около 2 м. В эукариотических клетках ДНК образует комплексы с белками и имеет специфическую пространственную конформацию.
Мономер ДНК — нуклеотид (дезоксирибонуклеотид) — состоит из остатков трех веществ: 1) азотистого основания, 2) пятиуглеродного моносахарида (пентозы) и 3) фосфорной кислоты. Азотистые основания нуклеиновых кислот относятся к классам пиримидинов и пуринов. Пиримидиновые основания ДНК (имеют в составе своей молекулы одно кольцо) — тимин, цитозин. Пуриновые основания (имеют два кольца) — аденин и гуанин.
Моносахарид нуклеотида ДНК представлен дезоксирибозой.
Название нуклеотида является производным от названия соответствующего основания. Нуклеотиды и азотистые основания обозначаются заглавными буквами.
Полинуклеотидная цепь образуется в результате реакций конденсации нуклеотидов. При этом между 3'-углеродом остатка дезоксирибозы одного нуклеотида и остатком фосфорной кислоты другого возникает фосфоэфирная связь (относится к категории прочных ковалентных связей). Один конец полинуклеотидной цепи заканчивается 5'-углеродом (его называют 5'-концом), другой — 3'-углеродом (3'-концом).
Против одной цепи нуклеотидов располагается вторая цепь. Расположение нуклеотидов в этих двух цепях не случайное, а строго определенное: против аденина одной цепи в другой цепи всегда располагается тимин, а против гуанина — всегда цитозин, между аденином и тимином возникают две водородные связи, между гуанином и цитозином — три водородные связи. Закономерность, согласно которой нуклеотиды разных цепей ДНК строго упорядоченно располагаются (аденин — тимин, гуанин — цитозин) и избирательно соединяются друг с другом, называется принципом комплементарности. Следует отметить, что Дж. Уотсон и Ф. Крик пришли к пониманию принципа комплементарности после ознакомления с работами Э. Чаргаффа. Э. Чаргафф, изучив огромное количество образцов тканей и органов различных организмов, установил, что в любом фрагменте ДНК содержание остатков гуанина всегда точно соответствует содержанию цитозина, а аденина — тимину («правило Чаргаффа»).
Из принципа комплементарности следует, что последовательность нуклеотидов одной цепи определяет последовательность нуклеотидов другой.
Цепи ДНК антипараллельны (разнонаправлены), т.е. нуклеотиды разных цепей располагаются в противоположных направлениях, и, следовательно, напротив 3'-конца одной цепи находится 5'-конец другой. Молекулу ДНК иногда сравнивают с винтовой лестницей. «Перила» этой лестницы — сахарофосфатный остов (чередующиеся остатки дезоксирибозы и фосфорной кислоты); «ступени» — комплементарные азотистые основания.
Функция ДНК — хранение и передача наследственной информации.
Строение и функции РНК
РНК — полимер, мономерами которой являются рибонуклеотиды. В отличие от ДНК, РНК образована не двумя, а одной полинуклеотидной цепочкой (исключение — некоторые РНК-содержащие вирусы имеют двухцепочечную РНК). Нуклеотиды РНК способны образовывать водородные связи между собой. Цепи РНК значительно короче цепей ДНК.
Мономер РНК — нуклеотид (рибонуклеотид) — состоит из остатков трех веществ:
1) азотистого основания,
2) пятиуглеродного моносахарида (пентозы)
3) фосфорной кислоты.
Азотистые основания РНК также относятся к классам пиримидинов и пуринов.
Пиримидиновые основания РНК — урацил, цитозин, пуриновые основания — аденин и гуанин. Моносахарид нуклеотида РНК представлен рибозой.
Выделяют три вида РНК: 1) информационная (матричная) РНК — иРНК (мРНК), 2) транспортная РНК — тРНК, 3) рибосомная РНК — рРНК.
Все виды РНК представляют собой неразветвленные полинуклеотиды, имеют специфическую пространственную конформацию и принимают участие в процессах синтеза белка. Информация о строении всех видов РНК хранится в ДНК. Процесс синтеза РНК на матрице ДНК называется транскрипцией.
Транспортные РНК содержат обычно 76 (от 75 до 95) нуклеотидов; молекулярная масса — 25 000–30 000. На долю тРНК приходится около 10% от общего содержания РНК в клетке.
Функции тРНК: 1) транспорт аминокислот к месту синтеза белка, к рибосомам, 2) трансляционный посредник. В клетке встречается около 40 видов тРНК, каждый из них имеет характерную только для него последовательность нуклеотидов. Однако у всех тРНК имеется несколько внутримолекулярных комплементарных участков, из-за которых тРНК приобретают конформацию, напоминающую по форме лист клевера. У любой тРНК есть петля для контакта с рибосомой (1), антикодоновая петля (2), петля для контакта с ферментом (3), акцепторный стебель (4), антикодон (5). Аминокислота присоединяется к 3'-концу акцепторного стебля. Антикодон — три нуклеотида, «опознающие» кодон иРНК. Следует подчеркнуть, что конкретная тРНК может транспортировать строго определенную аминокислоту, соответствующую ее антикодону. Специфичность соединения аминокислоты и тРНК достигается благодаря свойствам фермента аминоацил-тРНК-синтетаза.
Рибосомные РНК содержат 3000–5000 нуклеотидов; молекулярная масса — 1 000 000–1 500 000. На долю рРНК приходится 80–85% от общего содержания РНК в клетке. В комплексе с рибосомными белками рРНК образует рибосомы — органоиды, осуществляющие синтез белка. В эукариотических клетках синтез рРНК происходит в ядрышках.
Функции рРНК: 1) необходимый структурный компонент рибосом и, таким образом, обеспечение функционирования рибосом; 2) обеспечение взаимодействия рибосомы и тРНК; 3) первоначальное связывание рибосомы и кодона-инициатора иРНК и определение рамки считывания, 4) формирование активного центра рибосомы.
Информационные РНК разнообразны по содержанию нуклеотидов и молекулярной массе (от 50 000 до 4 000 000). На долю иРНК приходится до 5% от общего содержания РНК в клетке.
Функции иРНК: 1) перенос генетической информации от ДНК к рибосомам, 2) матрица для синтеза молекулы белка, 3) определение аминокислотной последовательности первичной структуры белковой молекулы.
3. Нуклеосома как единица структурной организации хроматина. Октамер гистонов в составе нуклеосомы. Линкер и линкерный гистон.
ДНК в ядрах клеток эукариот обычно находится в тесном взаимодействии с ядерными белками разных групп: основными (гистоновыми) и кислыми (негистоновыми). Ассоциируясь, ДНК и белки образуют единый нуклеопротеидный комплекс –дезоксирибонуклеопротеид (ДНП). Процентное соотношение сухого веса всех указанных компонентов ДНП таково: ДНК – 35–40 %, гистоновые белки – 30–50 %, негистоновые белки – 4–33 %, то есть 40 % сухого веса составляет ДНК и около 60 % – белки.
Термин «хроматин» (от греч. chroma – цвет, краска) был введен в 1880 году немецким гистологом Вальтером Флеммингом (1843–1905). Хроматин легко окрашивается ядерными красителями при исследовании клеточного препарата с помощью светового микроскопа.
Хроматином обычно называют дисперсное (деспирализированное) состояние хромосом в интерфазе клеточного ядра эукариот (в неделящейся клетке). Но с начала деления ядра молекулы ДНК уже спирализированы (упакованы) в хромосомы. Одна молекула ДНК (точнее – комплекс ДНП) представляет собой одну хромосому. Спирализацию, или упаковку, ДНК осуществляют преимущественно гистоны.
Белки хроматина
В структурной организации ДНП центральную роль играют специфические белки – гистоны.
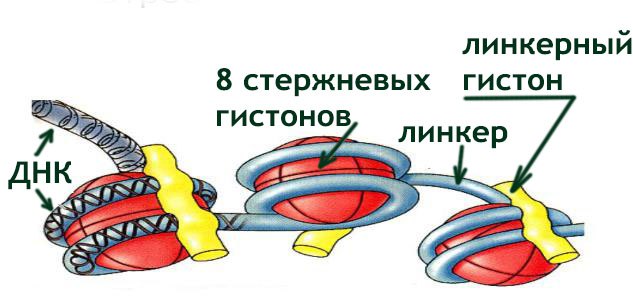
Гистоны – это относительно небольшие по молекулярной массе белки, присутствуют в ядрах клеток эукариот. Гистоновые белки богаты остатками аминокислот аргинина и лизина, определяющими их щелочные свойства. Практически все гистоны одинаковы, среди них насчитывают 5–7 типов молекул, обладающих сходными свойствами.
Гистоны – это структурные белки, выполняющие важную роль – упаковку ДНК. Например, в растянутом состоянии двойная спираль ДНК, содержавшаяся в хромосоме человека, имеет длину в среднем 4 – 5 см, а будучи спирализованной в хромосоме при участии гистонов, измеряется долями микрометра.
Отрезок молекулы ДНК длиной около 200 п. н. вместе с октомером составляет нуклеосому. Благодаря такой организации в основе структуры хроматина лежит нить, представляющая собой цепочку повторяющихся единиц — нуклеосом (рис. 3.46, Б). В связи с этим геном человека, состоящий из 3 · 109 п. н., представлен двойной спиралью ДНК, упакованной в 1,5 · 107 нуклеосом.Вдоль нуклеосомной нити, напоминающей цепочку бус, имеются области ДНК, свободные от октомеров. Эти области, расположенные с интервалами в несколько тысяч пар нуклеотидов, играют важную роль в дальнейшей упаковке хроматина, так как содержат нуклеотидные последовательности, специфически узнаваемые различными негистоновыми белками.
В результате нуклеосомной организации хроматина двойная спираль ДНК диаметром 2 нм приобретает диаметр 10—11 нм.
Уровни компактизации:
Первый уровень компактизации ДНК - нуклеосомный. Если подвергнуть действию нуклеазы хроматин, то он и ДНК, подвергаются распаду на регулярно повторяющиеся структуры. После нуклеазной обработки из хроматина путем центрифугирования выделяют фракцию частиц со скоростью седиментации 11S. Частицы 11S содержат ДНК около 200 нуклеотидных пар и восемь гистонов. Такая сложная нуклеопротеидная частица получила название Нуклеосомы. В ней гистоны образуют белковую основу-сердцевину, по поверхности которой располагается ДНК. ДНК образуют участок, с белками сердцевины не связанный, — Линкер, Который, соединяя две соседние нуклеосомы, переходит в ДНК следующей нуклеосомы. Они образуют «бусины», глобулярные образования около 10 нм, сидящие друг за другом на вытянутых молекулах ДНК.
У это тоже гистон, и он называется ЛИНКЕРНЫМ ГИСТОНОМ. Он отличается от стержневых гистонов.
Нуклеосома + линкерный гистон образуют ХРОМАТОСОМУ.
Второй уровень компактизации—30 нм фибрилла. Первый, нуклеосомный, уровень компактизации хроматина играет регуляторную и структурную роль, обеспечивая плотность упаковки ДНК в 6—7 раз. В митотических хромосомах и в интерфазных ядрах выявляются фибриллы хроматина с диаметром 25—30 нм. Выделяют соленоидный тип укладки нуклеосом: нить плотно упакованных нуклеосом диаметром 10 нм образует витки с шагом спирали около 10 нм. На один виток такой суперспирали приходится 6—7 нуклеосом. В результате такой упаковки возникает фибрилла спирального типа с центральной полостью. Хроматин в составе ядер имеет 25-нм фибриллы, которая состоит из сближенных глобул того же размера — Нуклеомеров. Эти нуклеомеры называют сверхбусинами («супербиды»). Основная фибрилла хроматина диаметром 25 нм представляет собой линейное чередование нуклеомеров вдоль компактизованной молекулы ДНК. В составе нуклеомера образуются два витка нуклеосомной фибриллы, по 4 нуклеосомы в каждом. Нуклеомерный уровень укладки хроматина обеспечивает 40-кратное уплотнение ДНК. Нуклесомный и нуклеомерный (супербидный) уровни компактизации ДНК хроматина осуществляются за счет гистоновых белков.
Петлевые домены ДНК —третий уровень структурной организации хроматина. В высших уровнях организации хроматина специфические белки связываются с особыми участками ДНК, которая в местах связывания образует большие петли, или домены. В некоторых местах есть сгустки конденсированного хроматина, розетковидные образования, состоящие из многих петель 30 нм-фибрилл, соединяющихся в плотном центре. Средний размер розеток достигает 100—150 нм. Розетки фибрилл хроматина—Хромомеры. Каждый хромомер состоит из нескольких содержащих нуклеосомы петель, которые связаны в одном центре. Хромомеры связаны друг с другом участками нуклеосомного хроматина. Такая петельно-доменная структура хроматина обеспечивает структурную компактизацию хроматина и организует функциональные единицы хромосом — репликоны и транскрибируемые гены.
Четвертый уровень компактизации-метафазная хромосома,когда размер молекулы уменьшается в 5×103-104.Обеспечило информационную емкость геномов эукариот.
