
2421
.pdf
|
|
|
|
aMeCО |
|
||
K |
p |
|
|
|
3 |
, |
(4.5) |
a |
|
|
|||||
|
|
MeO |
P |
|
|||
|
|
|
|
CO2 |
|
||
если окисел и образующийся карбонат являются самостоятельными чистыми фазами. Для чистых твердых веществ активности близки к единице, поэтому
|
|
K p |
|
1 |
, |
(4.6) |
|
P |
|||||
откуда получаем |
|
|
|
|||
|
CO2 |
|
|
|||
|
|
|
|
|||
P |
1 |
f (T) |
|
|
|
(4.7) |
|
|
|
|
|||
CO2 |
Kp |
|
|
|
||
Этот |
результат согласуется |
с |
правилом фаз, из |
|||
которого следует
i = 2 + 2 – 3 = 1,
т.е. равновесное давление СО2 в системе зависит только от температуры. Оно называется давлением диссоциации карбоната, и может рассматриваться как величина, эквивалентная константе равновесия. Стандартное изменение энергии Гиббса
G0 RT lnK |
p |
RT lnP |
(p) |
. |
|
|
(4.8) |
||
T |
|
CO2 |
|
|
|
|
|
||
Как следует из выражений (4.7) и (4.8) давление |
|||||||||
диссоциации карбоната также, |
как и величины |
|
GT0 |
|
и Кр |
||||
|
|
||||||||
может характеризовать химическое сродство МеО к СО2 и
термодинамическую прочность МеСО3. Чем меньше PCO (p) |
|||
|
|
|
2 |
в системе, |
тем выше сродство, тем прочнее |
карбонат и |
|
наоборот. |
|
|
|
При |
повышении |
температуры |
равновесие |
экзотермических реакций (4.2 – 4.4) смещается влево,
поэтому Кр уменьшается, а |
PCO (p) |
растет, т.е. |
|
2 |
|
81 |
|
|
термодинамическая прочность карбонатов уменьшается
(рис.4.1 а,б).
К Р |
|
Рсо2 |
|
Рсо2 |
|
|
|||
|
|
|
РФ |
|
а |
Рат |
|
|
|
|
|
|
|
Р1 |
|
|
|
||
|
|
|
РР |
|
|
|
|
Т |
|
|
а) |
Т |
б) |
Т |
|
Тп.р. в) Тх.к. |
|||
Рис. 4.1. Влияние температуры и состава газовой фазы на реакцию образования и разложения карбонатов
Кривая на рис. 4.1,б характеризует зависимость равновесного давления от температуры. Вместе с тем любая точка, лежащая вне кривой (например точка а), отвечает любой фактической величине PCO2 ф , которая может
существовать или поддерживаться в системе. Направление процессов, выражающихся уравнениями (4.2 – 4.4), можно определить по уравнению изотермы
GT0 |
|
1 |
|
|
1 |
|
|
RT lnPCO |
|
|
(ф) (4.9) |
RT ln |
|
ln |
|
|
(p) |
lnPCO |
|||||
PCO |
|
PCO |
|
||||||||
|
|
(ф) |
|
( p) |
2 |
|
2 |
|
|||
|
|
2 |
|
2 |
|
|
|
|
|
|
|
Поскольку условие самопроизвольного течения процесса определяется как GT0 0, из (4.9) следует, что при значении Pф>Pр развивается прямое течение реакции, а при Рф < Рр - обратное течение (на рис. 4.1.б это указано стрелками). При Рф = Рр система находится в равновесии. Таким образом, с помощью подобных диаграмм можно находить температуру и состав газа при которых реакция идет в нужном направлении. Кроме того, можно определить два технологически важных параметра – температуру начала разложения Тн.р. и температуру «химического кипения» Тх.к.
82
(рис.4.1, в). Как следует из рисунка, Тн.р. |
характеризует ту |
температуру, при которой диссоциация |
начинается при |
нагреве карбоната в газе с заданным PCO2 |
ф = const. |
Например в атмосфере Земли из-за деятельности человека парциальное давление постоянно растет, и сейчас составляет в среднем ~3∙10-3 ат. Эту температуру находим как точку пересечения линий Р1=const и PCO2 ( p) (T). Если
PCO2 (p) при нагреве достигает атмосферного давления Рат , то
процесс разложения будет идти во всём объёме и бурно. Эту температуру называют точкой «химического кипения».
Спомощью термодинамических данных, приведённых
вприложении, можно температурную зависимость Рр(Т) привести к виду
lgP |
|
(p) |
|
A |
|
B . |
|
(4.10) |
||||
|
|
|
|
|||||||||
CO |
|
T |
|
|
|
|
|
|
||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из этого уравнения можно получить выражение для |
||||||||||||
нахождения Тн.р. и Тх.к. |
расчетным путем: |
|
||||||||||
Tн.р. |
|
|
|
|
A |
|
|
, |
(4.11) |
|||
lgP |
|
(ф) |
B |
|||||||||
|
|
|
|
|
CO |
|
|
|
|
|
||
|
|
|
|
|
2 |
|
|
|
|
|
||
Tх.к. |
|
|
|
|
A |
|
|
|
. |
|
(4.12) |
|
lg P |
|
B |
|
|||||||||
|
|
|
|
|
аТ |
|
|
|
|
|
|
|
4.2. Термодинамическая прочность окислов
Запишем реакцию окисления на примере образования окисла двухвалентного металла
2Ме + О2(г) = 2МеО ∆Н<0 , (4.13)
В реакции окисления может образовываться низший (одновалентный) окисел, и он же может быть окисляемым веществом, т.е. реакция окисления металла может быть двух
– (или много -) ступенчатой.
83
Уравнение (4.13) по форме аналогично уравнению реакции карбонизации (4.2 – 4.4) , оба процесса экзотермичные, поэтому общие их термодинамические закономерности аналогичны друг другу. Система (4.13) двухкомпонентна, состоит из трёх фаз и обладает одной степенью свободы. Константа равновесия выражается как
|
Kp |
|
|
a |
2 |
|
|
|
|
|
|
||
|
|
|
MeO |
|
|
|
, |
(4.14) |
|||||
|
|
a |
2 |
|
|
|
|||||||
|
|
|
|
|
Me |
P |
|
|
|
|
|||
|
|
|
|
|
|
|
O |
|
|
|
|
||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
Для чистых твёрдых фаз |
K |
p |
|
1 |
|
|||||||
|
P |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
O (MeO) |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
откуда |
P |
|
1 |
f (T), |
|
|
|
|
(4.15) |
||||
Kp |
|
|
|
|
|||||||||
|
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
Равновесное парциальное давление кислорода в реакции образования (или диссоциации) окисла называется давлением (упругостью) диссоциации окисла. Давление диссоциации окисла связано с Кр и GT0 :
G0 |
RT ln K |
Р |
RT ln P |
(MeO) |
, |
(4.16) |
T |
|
O |
|
|
||
|
|
|
2 |
|
|
|
откуда видно, что все эти три параметра можно использовать для оценки нормального сродства окисляющихся веществ (металлов и низших окислов) к кислороду или термодинамической прочности окислов. Из (4.15) и (4.16) следует, что чем меньше давление диссоциации, тем выше термодинамическая прочность окислов (тем ниже сродство).
На основе уравнений изобары и изотермы реакции
можно изобразить |
качественный график зависимости |
|
lgPCO2 (T) |
(рис.4.2) |
и на этом графике определить поля |
значений PO2 (ф) , в пределах которых реакция идёт в прямом
и обратном направлении подобно тому, как это делалось для реакции карбонизации (рис.4.1).
84
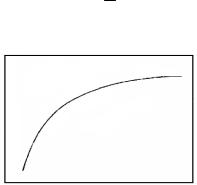
На основе термодинамических данных (приложение) зависимость давления диссоциации от температуры можно представить в форме
A
lg PO2 (MeO) T B
gPO2
2Ме О2 2МеО
2МеО 2Ме О2
T
Рис. 4.2. Зависимость lgPO2 (MeO) от температуры для реакции (4.13)
В табл. 4.1 приведены рассчитанные по этим данным давления диссоциации ряда различных по термодинамической прочности окислов при металлургических температурах. Видно, что для всех этих окислов PO2 (MeO) имеет низкие значения, что свидетельствует
о значительном сродстве элементов кислороду и достаточно высокой термодинамической прочности этих окислов в данных условиях.
Для рассмотренных случаев достижение условий, при
которых возможна диссоциация окислов (PO (ф) |
PO |
( р) , |
2 |
2 |
|
рис.4.2), практически невозможно. Это объясняет, почему металлы на Земле встречаются, в основном, в связанном (окисленном) состоянии.
85

Таблица 4.1 Давление диссоциации окислов некоторых элементов
Элементы |
Реакции |
gPO (MeO) |
|||
образования окисла |
Т=1000К |
|
Т=1600К |
||
|
|
|
|
2 |
|
|
|
|
|
|
|
Сu |
4Сu O2 |
2Cu2O |
-9,94 |
|
-3,40 |
Ni |
2Ni O2 |
2NiO |
-16,02 |
|
-6,24 |
Fe |
2Fe O2 |
2FeO |
-20,84 |
|
-10,25 |
Mn |
2Mn O2 |
2MnO |
-32,70 |
|
-17,55 |
Si |
Si O2 |
SiO2 |
-36,10 |
|
-19,00 |
Ae |
43 Ae O2 |
23 Ae2O3 |
-46,70 |
|
-25,55 |
Mg |
2Mg O2 |
2MgO |
-53,20 |
|
-27,30 |
Ca |
2Ca O2 |
2CaO |
-55,80 |
|
-30,80 |
Более высокие давления диссоциации имеют лишь только высшие окислы некоторых металлов, например – железа и марганца, которые заметно диссоциируют при металлургических температурах по уравнениям:
6Fe2O3 = 4Fe3O4 + O2 ,
6Mn2O3 = 4Mn3O4 + O2 ,
4MnO2 = 2Mn2O3 + O2 .
Эти реакции протекают, например, в процессе агломерации рудной мелочи.
4.3. Факторы, влияющие на термодинамическую прочность химических соединений
К таким факторам относятся степень дисперсности твердотельных реагентов и продуктов реакции, наличие в
86

системе твердых растворов, фазовые переходы в твердом состоянии и некоторые другие.
4.3.1. Влияние степени дисперсности
Увеличение степени дисперсности конденсированной фазы (окислов, карбонатов, сульфидов и т.д.) приводит к увеличению её площади поверхности, что сопровождается приростом свободной энергии, т.е. общим увеличением энергии Гиббса твердого вещества. Поэтому термодинамическая прочность соединений и давление диссоциации образующегося газа будут зависеть не только от температуры, но и от степени дисперсности веществ, участвующих в химическом превращении. Для реакции
A(т) + B(г) = AB(т) |
(4.17) |
|||||||
Kp |
|
|
aAB(Т ) |
(4.18) |
||||
a |
A(Т) |
P |
|
|
||||
|
|
|
B( ) |
|
||||
P |
|
|
1 |
|
aAB(Т) |
|
(4.19) |
|
|
Kp |
aA(Т ) |
||||||
В( ) |
|
|
|
|
||||
где aAB(Т ) ,aA(Т ) |
|
- |
активности |
твердофазных участков |
||||
процесса.
Активности можно выразить через химический потенциал (см.разд.1.1)
|
|
|
|
G G0 RT lna , |
(4.20) |
||
где G и G0 - значение мольных изобарных потенциалов вещества в данном и стандартном состоянии при одной и той
87

же температуре. Если за стандартное принять крупнокристаллическое состояние, то для него
G G0 RT lna 0, a 1
Для мелкодисперсного состояния G G0 , т.е.
G G0 RT lna 0, a 1.
Отсюда следует, что чем выше степень дисперсности вещества, тем больше величина активности. Поэтому, как видно из (4.19) , увеличение степени дисперсности соединения уменьшает его термодинамическую прочность, а увеличение степени дисперсности продукта распада действует в противоположном направлении. Это соответствует физическому смыслу химического потенциала как меры стремления компонента к выходу из той фазы, в которой он находится. Чем выше дисперсность вещества, тем выше его активность и тем больше μ. Повышенная активность высокодисперсных конденсированных фаз проявляется не только в их повышенной реакционной способности, но и в повышении растворимости и понижении температуры плавления мелких кристаллов в сравнении с крупными, повышенном давлении насыщенного пара над мелкими каплями жидкости, рекристаллизации и в других явлениях. Оценки показывают, что данный эффект становится существенным при размерах частиц конденсированной фазы ~ 1мкм и менее.
4.3.2.Влияние концентраций реагирующих веществ
втвердых фазах
В общем случае в реакциях диссоциации и образования соединений могут принимать твердые растворы, содержащие реагирующие вещества, и давление диссоциации зависит от их концентрации. При участии в реакции чистых твердых фаз
88
|
|
|
|
P |
|
1 |
, а при наличии растворов |
|
||||
|
|
|
|
Kp |
|
|||||||
|
|
|
|
B( ) |
|
|
|
|
|
|
||
P |
/ |
|
|
1 |
|
aAB(Т ) |
P |
|
aAB(Т ) |
, |
(4.21) |
|
|
|
|
aA(Т) |
aA(Т) |
||||||||
В |
( ) |
|
Kp |
B( ) |
|
|
|
|||||
поскольку величина Кр реакции имеет одно и то же значение и не зависит от того, реагируют ли чистые вещества или их растворы. Таким образом, давление диссоциации при наличии в системе твердых растворов будет зависеть от соотношения активностей веществ А и АВ в растворах. Активности компонентов связаны с их концентрациями аАВ = γАВNАВ , аА = γАNА , где γАВ и γА – коэффициенты активности, NAB и NA – мольные доли компонентов в твёрдом растворе. Тогда
|
P` |
|
P |
|
AB NAB |
, |
|
(4.22) |
|
|
|
|
|
||||||
|
B |
(Т) |
B(Т) |
|
|
A NA |
|
|
|
Отсюда можно сделать следующие качественные выводы: |
|||||||||
1) при |
уменьшении |
концентрации диссоциирующего |
|||||||
соединения |
в |
растворе |
давление |
диссоциации |
P` |
||||
|
|
|
|
|
|
|
|
|
B(Т) |
уменьшается, и его термодинамическая прочность возрастает. 2) снижение концентрации вещества, образующегося в результате диссоциации повышает PB`(Т) и уменьшает
прочность соединения.
Наиболее распространенными являются системы, в которых вещества А(т) и АВ(т) или неограниченно или частично растворимы друг в друге. Состояние таких систем не может быть определено заданием только температуры и давления: необходимо кроме того указать состав раствора, например, значения молярных долей А и АВ. Так как последние в бинарном растворе связаны соотношением NА + NАВ = 1 , то достаточно знать одну из них. Поскольку такие двухкомпонентные системы содержат не три, а две фазы, i = 2. То есть, из трёх переменных РВ , Т и N в равновесных
89
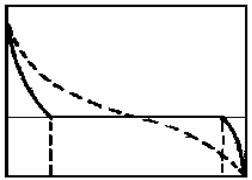
условиях независимы любые две, а третья является их функцией, например РВ = f(Т,N) . При постоянной температуре зависимости РВ(N) будут иметь для обозначенных выше систем следующий вид (рис.4.3).
РВ
2
3 |
1' |
1 |
|
|
2' |
|
3' |
АВ [A]1 |
[AВ]1 А |
Рис. 4.3. Изотермы упругости диссоциации:
1-1 при отсутствии взаимной растворимости конденсированных фаз; 2-2 при неограниченной взаимной растворимости; 3-3 при ограниченной взаимной растворимости
В присутствии любых, отличных от нуля количеств фаз АВ и А в системах, состоящих из чистых веществ, аАВ и аА постоянны для каждой заданной температуры, что приводит к неизменному, не равному нулю значению равновесного давления РВ (см.ур.(4.21)). Изотерма представляет собой прямую 1 – 1, параллельную оси составов во всей её области, за исключением крайних точек, где аАВ = 0 и РВ = 0 или аА = 0 и РВ = ∞ .
Если же А и АВ неограниченно растворимы друг в друге, то активности веществ непрерывно меняются с их концентрациями, а изотерма плавно переходит от РВ = 0 к РВ
= ∞ (кривая 2 – 2).
90
