
2421
.pdf
|
|
|
|
|
v |
D |
(Cоб Cпов ) kд(Cоб Cпов ), |
|
|
|
|
|
|
|
|||
|
|
|
|
- |
|
|
||
здесь |
толщина ламинарного слоя; коэффициент |
|||||||
k |
д |
|
D |
по |
аналогии с законом действия масс называют |
|||
|
||||||||
|
|
|
|
|
|
|||
константой скорости диффузии.
Чем больше скорость потока и выше степень турбулентности, тем меньше толщина ламинарного слоя, и тем выше скорость массопереноса.
В реакции горения углерода взаимодействие с кислородом происходит на реакционной поверхности, поэтому его концентрация вблизи этой поверхности Cпов
меньше, чем в объеме потока, где концентрация Соб
максимальна. Напротив, концентрация СО2 , выделяющегося на поверхности, максимальна вблизи нее и минимальна в ядре газового потока.
Для рассмотрения можно выделить следующие последовательные стадии процесса:
1)доставка кислорода из газового потока к реакционной поверхности (в случае горения топлива – кускам угля);
2)проникновение кислорода в глубь кусков угля по порам и трещинам (внутренняя диффузия);
3)адсорбция кислорода на поверхности углерода;
4)поверхностные процессы (в том числе химическая реакция, поверхностная диффузия);
5)десорбция углекислого газа;
6)отвод CO2 от реакционной поверхности в ядро
газового потока.
Эти стадии (звенья) можно разделить на две группы: адсорбционно-химические звенья (3,4,5) и диффузионные (1,2,6); они обязательны для любой гетерогенной реакции.
71
Для понимания кинетических закономерностей гетерогенного процесса достаточно рассмотреть его упрощенную схему. Предположим что горение определяется двумя стадиями – доставкой кислорода к месту реакции и химическим взаимодействием на поверхности. Скорость диффузии кислорода к поверхности описывается уравнением:
|
|
|
kд CО2 (об) СО2 (пов) , |
(3.12) |
||
|
На реакционной поверхности происходит химическая |
|||||
реакция |
горенияCT O2 |
CO2 , |
скорость |
которой |
||
кин |
kкинCOn |
(пов) , |
где |
kкин |
- константа |
скорости |
|
2 |
|
|
|
|
|
адсорбционно-химической (кинетической) стадии (т.е. количество газифицируемого углерода с единицы поверхности в единицу времени); n – порядок реакции.
При установившемся режиме скорости последовательных звеньев и наблюдаемая скорость суммарного процесса одинаковы:
|
|
кин |
наб . |
|
Из условия д |
кин можно найти СО2 (пов) : |
|||
kд |
CО |
(об) СО (пов) kкинCOn |
(пов) , |
|
|
2 |
2 |
2 |
|
откуда в простейшем случае (n=1)
|
CO (пов) |
|
kд |
|
CO (об) ; |
(3.13) |
||||
|
|
|
|
|||||||
|
2 |
|
kд |
kкин |
2 |
|
|
|||
|
|
|
|
|
|
|||||
наб |
кин |
kкинCO (пов) |
|
|
kкинkд |
CO (об) |
kнабCO (об) . |
|||
k |
|
|||||||||
|
|
|
|
2 |
|
|
2 |
2 |
||
|
|
|
|
|
|
|
д kкин |
|
||
Таким образом трудно определяемая концентрация кислорода на поверхности исключена из кинетического
уравнения и заменена на доступную измерению C .
O2(об)
72
Выражение |
|
|
kкинkд |
|
|
|
k |
наб |
|
. |
(3.14) |
||
|
||||||
|
|
kд kкин |
|
|||
имеет смысл константы скорости суммарного процесса и позволяет установить связь с кинетическими коэффициентами отдельных стадий. Преобразуя (3.14), имеем:
k |
наб |
|
|
1 |
|
; |
|
1 |
|
1 |
|
1 |
. |
(3.15) |
||||
|
|
|
|
|
|
|||||||||||||
|
|
1 |
|
|
1 |
|
|
k |
наб |
|
k |
кин |
|
k |
д |
|
||
|
|
|
kкин |
|
kд |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Выражение (3.15) показывает, что обратная величина константы скорости суммарного превращения равна сумме обратных значений констант скоростей последовательных звеньев процесса.
Этот результат, полученный для двухстадийного процесса, характерен в простейших случаях (если все звенья имеют первый порядок) для систем с любым числом последовательных звеньев.
Константа скорости характеризует «пропускную способность» того или иного звена, а обратная величина – «сопротивление» превращения равно сумме «сопротивлений» последовательных звеньев (как для электрической цепи с последовательным соединением резисторов).
Стадия с наибольшим «сопротивлением» имеет наименьшую скорость и ограничивает скорость всего процесса. Такую стадию называют лимитирующей. В зависимости от условий проведения процесса возможны следующие случаи:
1) процесс лимитируется химической реакцией (kкин kд ). Этот тип реакции называется кинетическим, а
совокупность условий, при которых он реализуется –
73
кинетической областью. Из (3.15) вытекает, что наблюдаемая скорость процесса подчиняется закономерностям, присущим химическим взаимодействиям.
Если |
необходимо |
изучить |
механизм |
химического |
|||||
превращения, |
в экспериментах |
должен быть |
обеспечен |
||||||
кинетический режим; |
|
|
|
|
|
||||
|
2) |
процесс |
лимитируется |
переносом |
вещества |
||||
(kкин |
kд ) |
и находится в диффузионной области. Для него |
|||||||
kнаб kд . |
Скорость |
суммарного |
превращения |
для |
него |
||||
подчиняется |
закономерностям, |
|
характерным |
для |
|||||
массопередачи; |
|
|
|
|
|
|
|
||
|
3) между |
кинетической и диффузионной областями |
|||||||
находится переходная область, где кд |
и ккин |
соизмеримы. В |
|||||||
этом случае кнаб |
определяется выражением (3.14). Здесь |
||||||||
скорость процесса определяется как кинетическими, так и транспортными закономерностями.
3.5. Особенности гетерогенных процессов в условиях кинетического и диффузионного режима
Наиболее важным результатом исследования механизмов любого гетерогенного процесса является установление эмпирическим путем зависимости суммарной скорости от различных параметров (температуры, скорости потока газа, пористости твердой фазы и т. п.) Это позволяет определить тип лимитирующей стадии, чувствительность скорости к параметрам процесса и оптимизировать аппаратуру и параметры процесса с целью обеспечения высокой производительности и экономичности.
Концентрация диффузионного реагента на поверхности раздела фаз Спов.
74
Запишем уравнение (3. 13,) в виде
Спов |
|
|
1 |
|
Соб . |
|
|
|
|
|
ккин |
|
|
|
|||
|
1 |
|
|
|
|
|
||
|
|
к |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
В кинетической |
области |
|
ккин к и |
ккин |
1 |
|||
|
|
|||||||
|
|
|
|
|
|
|
к |
|
последним можно пренебречь как слагаемым в знаменателе, тогда Спов≈Соб. Иначе говоря, содержание реагента на поверхности устанавливается примерно таким же, как и в объёме. Небольшой градиент концентрации обеспечивает медленный подвод вещества к поверхности в соответствии с его расходом на реакцию.
Если твердое тело пористое, то реагирующее вещество (например, О2) проникает вглубь, и взаимодействие распространяется на внутреннюю поверхность тела. Чем больше внутренняя поверхность, тем больше вещества единовременно участвует в превращении, и тем выше скорость превращения.
В диффузионной области к |
кин |
к |
|
, |
ккин |
1 и |
|
||||||
|
|
|
к |
|||
Спов 0.
Всвязи с большими кинетическими возможностями
химического превращения, кислород интенсивно расходуется в наружной части кусков угля, и для проникновения в поры и трещины его почти не остается. Ввиду этого процесс локализуется на внешней поверхности, и
его скорость мало зависит от скорости. |
В |
переходной |
|
области реагирования |
распространяется на |
ту |
или иную |
глубину твёрдого тела. |
|
|
|
Порядок реакции. |
|
|
|
Наблюдаемая скорость процесса совпадает с таковой |
|||
для реакции на поверхности |
|
|
|
наб |
кин ккинСповn . |
|
|
|
75 |
|
|

В кинетической области Спов Соб и наб ккинСобn . Порядок химической реакции (n) по концентрации на
поверхности может быть разным, в соответствии с чем порядок реакции и по объёмной концентрации реагента, т.е.
тот порядок, |
который обычно наблюдают экспериментально, |
|||||||
бывает нулевым, дробным, первым и т.д. |
|
|||||||
|
В |
диффузионной |
области |
наблюдаемая скорость |
||||
процесса |
определяется |
скоростью поступления реагента |
к |
|||||
|
|
|
наб |
д |
поверхности |
или |
||
наб |
Кд |
Соб Спов . |
|
|
|
|
||
|
Подставив |
в это |
выражение |
Спов ≈ 0 , получим |
||||
наб |
к Соб |
или |
всегда |
первый |
порядок реакции |
по |
||
концентрации реагента в объёме. |
|
|
||||||
Влияние температуры.
Константа скорости химической реакции возрастает с температурой по экспоненциальной зависимости. В кинетической области такой же закономерности подчиняется и кнаб :
W
кнаб ккин к0е RT .
Температура влияет на константу скорости массопередачи в жидкости и газе гораздо слабее. В частности, для газа коэффициент диффузии, а следовательно и кq ~ Т1,7. Поэтому скорость процесса, в том случае, если он лимитируется диффузией в газе, связана с температурой такой же степенной функцией.
кнаб кд Т1,7 .
где - коэффициент пропорциональности
76
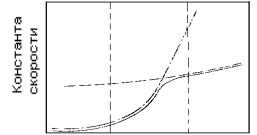
Температурная зависимость констант скоростей химической реакции и диффузии приведена на рисунке (3.5) из которого видно, что понижение температуры ведет к неравенству ккин << кд или к переходу в кинетическую область, а рост температуры – в диффузионную область.
Константа скорости суммарного превращения в зависимости от температуры изображается S- образной кривой, которая при низкой температуре совпадает с ккин (Т), а при высоких – с кд (Т).
кк
I II III
кд
Т1 Т2 Т
Рис. 3.5. Соотношение констант скоростей химической реакции ккин и диффузии (кд) при разных температурах: I - кинетическая область; IIпереходная область; IIIдиффузионная область
Влияние гидродинамической обстановки процесса Скорость газового потока и степень турбулентности
влияет лишь на константу скорости диффузии и при кинетическом режиме не сказывается на скорости процесса. В диффузионной области скорость процесса заметно возрастает с увеличением скорости потока газа. Это наблюдается только до определенного предела (Vпотока ), после чего скорость реакции не растет.
Влияние характера реакционной пористости поверхности и размера кусков.
77
Реакционная поверхность обладает различной адсорбционно-химической активностью в зависимости от особенностей кристаллического строения вещества (углерода), наличия в нем каталитических добавок и т.д.
Изменения этой активности и величины поверхности сказываются на наблюдаемой скорости процесса главным образом в кинетической области, и отчасти в переходной. В ряде случаев определяющей стадией процесса является внутренняя диффузия. Её скорость существенно зависит от величины и характера пористости. Чем менее извилисты поры и чем они крупнее, тем легче в них проникает газ. Диффузия также облегчается при наличии сквозных пор. Уменьшение размера кусков угля сокращает путь внутренней диффузии и облегчает проникновение газа вглубь.
Можно примерно считать, что увеличение относительного объёма пор и уменьшение величины кусков повышает скорость внутренней диффузии и тем самым приближает процесс к кинетическому режиму.
Факторы, понижающие константу скорости химического взаимодействия и увеличивающие константу скорости диффузии (внутренней и внешней), благоприятствуют смещению процесса в кинетическую область и наоборот. Следовательно, переходу процесса в кинетическую область способствует понижение температуры, увеличение скорости потока газа, увеличение пористости, сокращение размера кусков, уменьшение давления газа.
Последнее связано с тем, что коэффициент диффузии в газе обратно пропорционален давлению.
Контрольные вопросы
1.Охарактеризуйте роль углерода в металлургических системах с газовыми атмосферами.
2.Проведите термодинамический анализ процессов в
системе С-СО2 .
78
3. Проведите расчёт равновесного состава газовой фазы в системе С-СО2 для ряда температур и постройте график зависимости %СО(Т).
4.Постройте график зависимости %СО2(Т).
5.Как влияет общее давление системы на равновесный состав газовой фазы в системе СО2 С ?
6.Примените уравнения изотермы реакции для анализа процессов в системе СО2 С .
7.Проведите анализ реакции горения твердого углерода.
8.От чего зависит равновесный состав газовой среды в
системе СО2 С ?
9.Проведите анализ взаимодействия углерода с водяным паром.
10.Расчет равновесного состава газовой фазы в системе С-Н-О.
11.Проведите анализ последовательности стадий процесса горения твердого углерода.
12.Как описывается скорость гетерогенного процесса, состоящего из ряда последовательных стадий?
13.Что понимается под терминами кинетический и диффузионный режим процесса?
14.Охарактеризуйте особенности процессов в кинетическом и диффузионном режиме.
15.Охарактеризуйте пути интенсификации гетерогенных процессов.
79
4. ОБРАЗОВАНИЕ И ДИССОЦИАЦИЯ КАРБОНАТОВ, ОКИСЛОВ, СУЛЬФИДОВ МЕТАЛЛОВ
В металлургических процессах важную роль могут играть реакции образования и диссоциации окислов, сульфидов и более сложных соединений металлов. В частности такие реакции протекают при образовании шлаков и штейнов, которые используются для получения жидкого
металла |
с заданным составом и свойствами. Для этих |
||
веществ |
уравнения реакций |
образования |
и разложения |
однотипны : |
|
|
|
|
АВ(ТВ) = А(ТВ) + В(г) . |
(4.1) |
|
в котором, в зависимости от конкретного вещества АВ может быть карбонатом, окислом или сульфидом металла ; А – соответственно – окислом, металлом, низшим окислом или сульфидом ; В – это СО2 , кислород или сера. Поэтому различные подобные системы подчиняются одним и тем же термодинамическим закономерностям, изучение которых позволяет выявить количественные характеристики прочности соединений и условия их образования или распада.
4.1. Термодинамика образования и диссоциации карбонатов
Запишем реакции образования некоторых наиболее важных для металлургических систем карбонатов :
СаО(т) + СО2(г) = СаСО3(т) ; |
H2980 |
170,577 |
Дж |
(4.2) |
MgO(т) + CO2(г) = MgCO3(т) ; |
H2980 |
110,825 |
Дж |
(4.3) |
FeO(т) + CO2(г) = FeCO3(т) ; |
H2980 |
103,334 |
Дж |
(4.4) |
Таким образом, реакции образования карбонатов экзотермичны. Обратные процессы термической диссоциации являются эндотермическими. Выражение для константы равновесия будет иметь вид :
80
