
2421
.pdf
Значения G0 для реакции (1) можно найти через
GМо е О и GМо е О
2Ме" О2 2Ме"О
2Ме' О2 Ме'О
∆Gо = 1 ( GМое 'О - GМео 'О )
2
Реакция (1) может идти в сторону восстановления Ме/О при ∆Gо < 0. Развитие металлотермического процесса без внешнего подогрева возможно только в том случае, когда количество выделяемого тепла достаточно для получения высокой температуры в системе Ме//-Ме/О.
Характеристикой тепловыделения в металлургическом процессе служит количество тепла, выделяемого на единицу массы реагирующей смеси. Эта характеристика называется термичностью шихты и обычно определяется из выражения
q = Н2980 ,
М
где Н2980 - тепловой эффект реакции (1), а М - сумма
молекулярных или атомных масс исходящих веществ, взятых в стехиометрических соотношениях
Экспериментально установлено, что в случае когда численные значения этой величины q < 2300 Дж/г, то энергии недостаточно для расплавления и нагрева продуктов до нужной температуры, и для осуществления процесса восстановления необходим подвод тепла. Превышение q > 4600 Дж/г может привести к взрывному характеру реакции.
Для алюминотермического восстановления, например, оксидов марганца, величины Н2980 равны:
(А) 3 МnO2(т) + 4АI(т) = 3Мn(ж) + 2 АI2О3(т)Н2980 =-1,7∙106 Дж/моль
161

(Б) 3Мn3O4(т) + 8АI(т) = 9Мn(ж) + 4АI2О3(т)Н2980 = -2,4∙106 Дж/моль
(В) 3 МnO(т) + 2АI(т) = 3Мn(ж) + АI2О3(т)Н2980 = -4,8∙105 Дж/моль.
Если пересчитать на 1г металлотермической смеси, то получим соответственно 4700, 2612 и 1783 Дж/г. таким образом, реакция (А) может протекать бурно и иметь взрывной характер, а реакция (В) требует нагрева.
Важное значение имеет полнота восстановления металла. Константа равновесия реакции (1)
Кр = |
аМе О аМе |
. |
|||
|
|||||
|
а |
а |
Ме |
|
|
|
Ме О |
|
|
|
|
Полнота восстановления металла определяется отношением α = аМе /аМе - чем оно меньше, тем выше
полнота восстановления Ме/, выше выход металла Ме/. Из уравнения для Кр реакции имеем
аМе аМе О Кр .
аМе аМе О
Учитывая, что из уравнения G RT nKp константу
|
|
|
|
|
G0 |
|
|
||
равновесия можно записать как Kp e |
RT , получаем |
||||||||
|
аМе |
|
аМе О |
|
G0 |
||||
|
|
e |
|
RT |
. |
||||
аМе |
|
||||||||
|
|
аМе О |
|
|
|
|
|||
Из этого уравнения видно, что чем больше GОТ , т.е.
чем выше химическое сродство к кислороду у Ме//, по сравнению с химическим сродством к О2 у Ме/ , тем выше будет выход продукта, больше полнота восстановления.
162
Контрольные вопросы
1.В чем заключается преимущество реакций восстановления перед реакциями диссоциации при получении металлов?
2.Сформулируйте наиболее общее условие протекания реакции восстановления.
3.Проведите термодинамический анализ процесса восстановления окисла металла окисью углерода.
4.Проведите сравнительный анализ возможностей восстановления различных окислов.
5.Как влияет наличие растворов в системе на возможность восстановления окислов?
6.Охарактеризуйте различные ступени восстановления окислов железа монооксидом углерода.
7.Нарисуйте и поясните зависимость равновесного состава газовой фазы от температуры в реакции восстановления окислов железа водородом и монооксидом углерода.
8.В чем заключается процесс, называемый косвенным восстановлением окислов углеродом?
9.Как определить термодинамические условия протекания процессов восстановления окислов углеродом и окисления металлов?
10.Сформулируйте термодинамические условия металлотермического восстановления окислов.
11.Что такое термичность шихты? В каких пределах она может изменяться?
12.Чем определяется полнота восстановления окислов при металлотермическом восстановлении?
13.Для каких целей используется металлотермическое восстановление окислов?
163
7. СТРОЕНИЕ И СВОЙСТВА МЕТАЛЛУРГИЧЕСКИХ РАСПЛАВОВ
Многие металлургические процессы протекают с участием жидких фаз – металлической, оксидной (шлаковой), сульфидной (штейновой), солевой (галогениды металлов, соли кислородных кислот). Взаимодействие между жидкими фазами, а также с газообразной средой зависит от структуры
исвойств металлургических расплавов.
7.1.Строение жидких металлов
При большом перегреве над точкой плавления жидкие металлы относят к так называемым простым жидкостям, которыми являются сжиженные инертные газы с вандерваальсовскими силами межмолекулярного взаимодействия. Простые жидкости состоят из сферически симметричных частиц, между которыми действуют ненаправленные и ненасыщенные силы связи.
В жидких чистых металлах межчастичные связи осуществляются коллективизированными валентными электронами. Эта связь, как и вандерваальсова связь, ненаправлена и ненасыщенна. Металлические ионы, составляющие расплав, сферически симметричны, т.к. имеют структуру внешних электронных оболочек, аналогичную структуре оболочек атомов благородных газов.
При небольших перегревах можно предположить что жидкие металлы ближе по своей структуре к кристаллическому состоянию. Детальное обоснование близости структуры жидкостной и твердых тел вблизи температуры кристаллизации было дано Я.И.Френкелем, и получены прямые подтверждения при экспериментальном исследовании структуры жидкости рентгеновскими дифракционными методами.
164
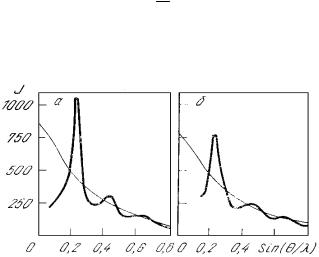
Первичной информацией в рентгеноструктурных исследованиях является кривая зависимости интенсивности
рассеянного излучения от sin , где Ө - угол рассеяния, λ –
длина волны.
Вид функции J=f(sinΘ/λ) (рис. 7.1) отражает неравномерность распределения частиц в расплаве.
Рис. 7.1. Интенсивности рентгеновского излучения, рассеянного жидкой медью (а) и жидким никелем (б)
Наличие интерференционных максимумов на кривой свидетельствует о наличии определенного порядка в расположении атомов. Плавная кривая выражает интенсивность рассеяния рентгеновских лучей неупорядоченной системой независимо рассеивающих атомов, т.е. она характерна для нерегулярной и несвязанной структуры. Для кристаллического состояния график интенсивности излучения выражается четкими и регулярными пиками, что свидетельствует о рассеянии лучей строго фиксированными атомами.
Рентгенограммы для жидких металлов имеют как бы промежуточный характер, но ближе к таковой для кристаллического состояния, а не парообразного.
165
По рентгенограммам можно определить такие важные структурные параметры жидкого металла, как межатомное расстояние и координационное число.
Рентгеновские исследования (а также данные электроно- и нейтронографии) показали, что атомы или молекулы находятся в жидкости на близких расстояниях друг от друга, мало отличающихся от расстояний между частицами в кристаллах. Частицы в жидкости очень подвижны, поэтому ближайшие соседи непостоянны и сменяют друг друга. В жидком металле наблюдается, как уже отмечалось, определенный ближний порядок в расположении атомов. Этот ближний порядок распространяется на ограниченное число межатомных расстояний; около выбранного атома имеет место упорядоченное расположение соседних атомов, напоминающее расположение в различно ориентированных мелких кристалликах с линейными размерами ~10-7 см. При наличии ближнего порядка в жидких металлах отсутствует периодичность расположения на большие расстояния, т.е в них нет дальнего порядка, характерного для кристаллических тел.
Эти обстоятельства и привели к представлениям о квазикристаллическом строении жидкостей. Были предложены различные модели квазикристаллической структуры, в которых группировки атомов с ближним порядком имеют разное название – кластеры, кванты структуры, квазикристаллы и т.п.
Опираясь на представление о квазикристаллическом строении жидкостей, Я.И. Френкель дал качественное описание теплового движения атомов и молекул в жидкостях и на основе решеточной модели объяснил диффузию и вязкость жидкостей, описал процессы плавления и кристаллизации.
Согласно Френкелю, тепловое движение атомов или молекул в жидкости сводится к нерегулярным колебаниям относительно положений равновесия. Эти положения
166
равновесия не являются строго фиксированными на одном месте, как в кристалле. Они временные и непрерывно изменяют свои координаты. В связи с большой плотностью и сильным взаимодействием частиц в жидкости частота колебаний атомов в группировке относительно временных положений равновесия близка к частоте колебаний атомов в твердом теле. Но частота перескоков группировок атомов из одного положения равновесия в другое значительно меньше частоты колебаний вблизи исходного или нового положения
равновесия:
= 0eW/кТ.
где 0 - период колебания атомов вблизи положения равновесия, - время между двумя перескоками, W-энергия активации, необходимая атому для преодоления потенциального барьера, разделяющего два возможных
положения равновесия.
При этом 0 ~10-12 – 10-13 с, а τ ~10-11 с и зависит от величины W, т.е от природы жидкости.
Косвенное подтверждение близости строения жидких и твердых металлов вблизи температуры кристаллизации следует из данных об изменении удельного объема, теплоемкости электрического сопротивления при плавлении металла и ряда других физических свойств.
У большинства металлов при плавлении объем увеличивается всего лишь на 3-6%, что свидетельствует о малом изменении сил взаимодействия и расстояния между атомами. На это же указывают значения теплот плавления, которые у металлов составляют ~10% от теплоты испарения.
Электрическое сопротивление при плавлении металлов увеличивается в 1,5 – 2 раза, а у переходных металлов всего на несколько процентов. Тип проводимости в жидких металлах не изменяется и обусловлен наличием коллективизированных электронов.
Теплоемкость металлов в твердом и жидком состоянии вблизи точки плавления также изменяется незначительно (на
167
несколько %), что указывает на сохранение теплового движения частиц, которые совершают колебания около временных положений равновесия.
7.2. Свойства жидких металлов
Вязкость жидкости тесно связана с ее структурой и определяется силами межчастичного взаимодействия.
Для характеристики вязкости жидкости используется коэффициент вязкости η, называемый динамической вязкостью. Он входит в уравнение Ньютона для стационарного потока вязкой жидкости :
F = η·S· V ,
X
где F – сила взаимодействия между двумя движущимися
слоями, S – площадь соприкасающихся слоев, V - градиент
X
скорости слоев жидкости по нормали к направлению потока
(рис. 7.2)
х

 3
3
х 
 2
2

 1
1
Рис. 7.2. Распределение скоростей течения в потоке вязкой жидкости
Величину η, зависящую от природы жидкости, можно найти экспериментально по уравнению Ньютона или другим соотношениям, полученным на основе этого уравнения (например, формуле Пуазейля, формуле Стокса и т.п.). В системе СИ [η]=Па∙с.
Кроме того используется кинематическая вязкость = η/ρ, которая определяется отношением динамической
168

вязкости к плотности жидкости. Кинематическая вязкость характеризует скорость передачи импульса для потока единичной массы, [ν]=м2/с.
Вязкость жидких металлов близка к вязкости воды (при
25оС H2O =0,00089 Па∙с = 0,89 мПа·с).
Следует отметить наличие связи между вязкостью жидких металлов и их положением в Периодической системе элементов. Переходные металлы имеют наибольшие значения вязкости, щелочные металлы-наименьшие. Так, при температурах, на 50оС выше точки плавления вязкость (мПа∙с) у жидких металлов составляет (табл. 7.1):
Таблица 7.1 Динамическая вязкость некоторых металлов (мПа с)
K |
Mg |
Al |
Cu |
Fe |
Ni |
0,6 |
1,7 |
1,1 |
4,1 |
5,4 |
5,0 |
4 |
|
3 |
|
|
|
Для описания температурной зависимости вязкости жидких металлов, чаще всего используется уравнение Я.И.Френкеля
η = Аexp(Wη/RT) , |
(7.1) |
где А – постоянная, зависящая от природы металла, Wη – энергия активации вязкого течения (энергия, необходимая для перехода частицы или группы частиц из одного положения равновесия в другое).
Это уравнение справедливо для сравнительно небольшого температурного интервала (100-200оС выше точки плавления), что подтверждается линейной
зависимостью g от 1 . Значения энергии активации
T
вязкого течения изменяется в широких пределах и зависит от
169
природы металла ( от 5 до 50 кДж/моль). Ее приближенное значение может быть оценено по эмпирическому уравнению
Wη = 14,33 Тпл.
Температурная зависимость динамической вязкости чистого железа описывается уравнением ( в интервале Т=1812-1973К)
lgη = 1951- 2,327.
T
Для жидкого алюминия (до 1223К, Тпл.=933К)
lgη = 720 - 2,680.
T
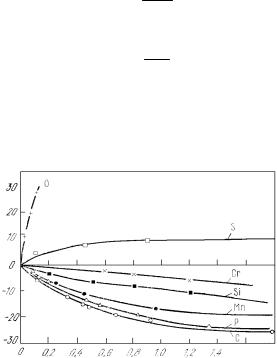
Наличие примесей в жидких металлах влияет на величину их вязкости. При этом (например, для жидкого железа) одни примеси (кислород, сера) повышают вязкость, а другие (С, Si , Mn и др.) понижают вязкость (рис.7.3)
,%
[ Э ],%
Рис. 7.3. Влияние содержания различных примесей на вязкость жидкого железа при 1873 К. [Э]- концентрация примесей
Для металлических растворов, близких к идеальным, значение вязкости рассчитывается исходя из вязкости компонентов η1 и η2 и их мольных долей N1 и N2
η = N1 ∙ η1 + N2 ∙ η2 . |
(7.2) |
170
