
2421
.pdf
РН |
2(Ф) |
< РН |
2( |
Р) |
и РN |
2( |
< РN |
. |
(8.18) |
|
|
|
ф) |
2(р) |
|
То есть дегазация возможна, когда фактическое парциальное давление компонента в газовой фазе ниже, чем равновесное его давление над металлом. Развитие процесса дегазации осложняется кинетическими трудностями, связанными с зарождением новой фазы в недрах старой. Газовыделение возможно лишь при наличии в металле готовых газовых пузырьков размером больше критического. Поэтому интенсивное псевдокипение стали или продувка ее инертным газом (например, аргоном) являются действенными средствами дегазации. Когда объем расплава пронизан поднимающимися газовыми пузырьками, в которых преобладают СО или Аr при почти полном отсутствии Н2 и N2, то обеспечивается условие (8.18) и устраняется трудная стадия зарождения пузырьков.
Новые отрасли техники требуют применения металлов с ничтожным содержанием таких газовых примесей, как кислород, водород и азот, Такие металлы выплавляют в специальных вакуумных электрических печах. Разливка или выдержка в вакууме жидкой стали, выплавленной в обычных агрегатах, позволяет значительно улучшить раскисление и дегазацию металла и тем самым повысить его качество.
Общее давление в пузырьках газа, находящихся в жидком металле под слоем шлака записывается соотношением (8.14). В обычных открытых печах и разливных устройствах Ратм ≈ 1 атм. Гидростатическое давление колеблется от небольших значений до ~ 1 ат, что в сумме с атмосферным давлением не превышает ~ 2 атм.
Капиллярное давление 2 r сильно зависит от радиуса
пузырька. Как было отмечено в разд. 8.3, в жидкой стали критический радиус газового пузырька имеет величину r ~ 5∙10-3 см, и соответствующее давление Лопласа ~ 0,1 атм, т.е. мало, по сравнению с атмосферным и гидростатическим. Если понизить Рат (создать вакуум), то давление внутри
221

пузырьков уменьшится, и их объем при Т - const увеличится (PV = const). Это способствует переходу в них растворенных в металле газов и интенсивному всплыванию пузырьков.
Вакуумирование жидкой стали позволяет в ряде случаев существенно снизить содержание кислорода без применения специальных раскислителей и, следовательно, без дополнительного загрязнения металла шлаковыми включениями. В условиях вакуумирования роль раскислителя может выполнять углерод восстановительная способность которого значительно возрастает. Из уравнения (8.12) следует, что
[O]= РСO( ) .
К[C]
Отсюда видно, что положение кривой [% O] = f[%C] зависит от РСO( ) , а оно зависит от внешнего давления (Рат) (рис. 8.6).
Рис. 8.6. Соотношение равновесных концентраций углерода и кислорода в жидком железе прт 1540 С и различном общем давлении в системе: 1-1ат; 2-5ат; 3-10 ат; 4- 20 ат.
222

При низких давлениях глерод становится даже более сильным раскислителем, чем алюминий.
8.6.Дефосфорация сталей
Вбольшинстве случаев фосфор является нежелательной примесью литейных сплавов. По этой причине еще во время плавки (это относится в первую очередь к сплавам на основе железа) принимаются меры к удалению фосфора.
Этот процесс принято называть дефосфорацией. Перевод фосфора из металлического расплава в шлаковую фазу является типичным окислительным процессом. Эта фаза дефосфорации является первой и необходимой. Обычно реакция окисления фосфора представляется в виде
52
[P]+ 4О2 4(Р2О5 ).
Переходу фосфора из металла в шлак способствует все, что повышает активность его в металлическом расплаве и понижает активность в шлаке. Решающее значение в поддержании условий экстракции фосфора в шлаковую фазу имеет сохранение фосфора в соединении с кислородом. Кислый окисел P2O5 не относится к числу стойких. Сохранение фосфора в малоактивной форме в шлаке связано с необходимостью принятия соответствующих дополнительных мер. К их числу относится, например, введение в шлак СaO или других сильно-основныхокислов.
При этом согласно ионной теории имеется в виду, что в шлаке образуется относительно больших размеров катион Са2+, слабо взаимодействующий с кислородом. Катионы Са2+ группируются возле анионов РО34 и повышают устойчивость последних. Области неоднородности, образующиеся в результате этого в шлаковом расплаве, характеризуются наличием группировок Ca2+ — РО34 и Fe2+ — О2-.
223
Если в такой шлак вводить кислые окислы, например SiO2, то это вызовет образование комплексных анионов с заимствованием из расплава свободных кислородных анионов. В результате этого эффективность дефосфорации будет понижаться.
Исходя из представления, что шлаковые расплавы являются высокотемпературными ионными растворами, реакцию взаимодействия фосфора металла с окислами железа в шлаке можно представить в виде
5 |
Fe |
2 |
2- |
|
|
|
3 |
5 |
Fe . |
|
||||
[P] + |
|
|
+ 4О |
= РО4 |
+ |
|
(8.19) |
|||||||
2 |
|
2 |
||||||||||||
|
|
|
Н 209340Дж/моль . |
|
||||||||||
Константа равновесия реакции, выраженная через |
||||||||||||||
активности равна |
|
|
|
|
а |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
(РО 3) |
|
||||||
|
|
|
|
Кр = |
|
|
4 |
|
. |
|
||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
5 |
|
a4O2 |
|
||||
|
|
|
|
|
а |
|
a |
2 |
|
|
||||
|
|
|
|
|
[P] |
(Fe2 ) |
|
|
|
|
|
|||
Большая экзотермичноеть реакции (8.19) является показателем того, что более полная дефосфорация будет протекать при пониженных температурах.
Из кинетических факторов, обеспечивающих успешную дефосфорацию в реальных условиях плавки, большое значение имеет интенсивность перемешивания шлака. Чем интенсивнее перемешивается шлак, тем успешнее протекает дефосфорация. Такой эффект является следствием того, что лимитирующим является диффузионное звено процесса.
Необходимо отметить, что приведенные выше условия дефосфорации согласуются с условиями, вытекающими из
224
принятого ранее представления, согласно которому удаление фосфора из металла в шлак происходило по реакции
2[Р]+5(FeO)+4(СаО)=(4СаО•Р2О5)+5Fe(ж)
Шлак, содержащий фосфор, который извлечен из металла, во избежание его обратного перехода в металл (рефосфорации) перед раскислением рекомендуется удалить (полностью или частично).
8.7. Поглощение и удаление серы (десульфурация)
При производстве литейных сплавов сера может находиться в газовой фазе (SO2), в топливе (главным образом в виде FeS), в металлическом и шлаковом расплавах.
Взависимости от характера процесса плавки возможны разные варианты взаимодействия серы и ее соединений с теми или иными компонентами — участниками процесса.
Вусловиях плавки с использованием сернистого топлива может иметь место переход серы из газовой фазы
вшлак и металл. Возможно также непосредственное растворение сульфидов топлива в металлическом или шлаковом расплаве. При воздействии струей кислорода на металлический расплав термодинамически возможна реакция окисления серы и переход ее в газовую фазу. Исключительно большое значение имеют процессы распределения (и перехода) серы между металлическим и шлаковым расплавами.
Во всех случаях направление реакций связано с величиной потенциала, при этом равновесие наступает при выравнивании значений соответствующих потенциалов.
Обычно процесс плавки ведут таким образом, чтобы
вготовом продукте довести до минимума содержание серы. На рис. 4.8 приведены значения ∆G° образования различных сульфидов, отнесенные к молю реагирующей
225
серы S2. В верхней части диаграммы расположены сульфиды менее стойкие, в нижней — более стойкие. В первом случае потенциалы πS имеют большие значения, во втором — меньшие.
Обменная реакция, т. е. переход серы от одного металла к другому, характеризуется стремлением потенциала к
выравниванию, т. е. направлением
S/ S// ,
где S/ S//
Реакция вобщемвиде может быть представлена уравнением:
Ме/S + Ме// ↔ Ме//S + Ме/ .
Любая точка, взятая вне кривой на рис. 4.8 характеризует отличие потенциала серы газовой фазы от потенциала серы данногосульфида:
πS(г.ф.)≠ πS(MeS) .
Знак неравенства показывает, каким будет процесс: поглощениесерыизгазовойфазыилиудаление ее.
Если атмосфера над расплавом будет восстановительной, напримерсодержащейводород,то
πS(MeS) < S(H2S) ,
тогда имеет место переход серы из газовой фазы в металл. Если же
πS(MeS) > S(H2S) ,
то протекаетпроцессдесульфурации.
При окислительной атмосфере, содержащей кислород, неравенство
πS(MeS) < S(SO2 ) ,
характеризуетпоглощениесеры,анеравенство
πS(MeS) > S(SO2 )
характеризует удаление серы в газовую фазу.
226
Еслидопустить,чтоможетпротекатьреакция
S2 +2[Fe]↔2[FeS],
то потенциал серы сульфида, растворенного в железе, может бытьопределенпо уравнению
|
|
a2 |
|
|
πS[FeS] = GO |
+ RT1n |
[FeS] |
. |
(8.20) |
|
||||
FeS |
|
a2 |
|
|
|
|
[FeS] |
|
|
Из уравнения (8.20) следует, что свойства серы, растворенной в железе, определяются термодинамической прочностью чистого сульфида в жидком состоянии и его активностью в металлическом растворе при данной концентрации. Когда на железный расплав воздействует серосодержащая восстановительная атмосфера, перераспределение серы происходит до выравнивания потенциалов:
S(r.ф.) = S[FeS] .
Количественной оценкой перехода серы из газовой фазы в металлический расплав является коэффициент распределения К:
К = а[FeS1 ] (8.21)
PS2
2
где а[FeS] — активность сульфида в металлическом расплаве
при данной концентрации.
Коэффициент распределения зависит от прочности сульфида.
При постоянных заданных свойствах атмосферы поглощение серы расплавом можно регулировать, изменяя величину активности серы в расплаве. Из уравнения (8.21) следует, что активность сульфида пропорциональна равновесному давлению серы в газовой фазе.
227

Если в расплаве кроме железа и серы присутствует третий компонент, то он оказывает определенное влияние на величину активности серы. На рис. 8.7 показано влияние некоторых элементов на изменение коэффициента активности серы в расплавах железа.
Рис. 8.7. Влияние некоторых элементов на изменение
коэффициента активности серы в расплавах железа при
1600оС
Элементы, содержащиеся или вводимые в расплавы железа, оказывают также влияние и на величину предельного содержания серы.
Возможно, например, образование нерастворимых тугоплавких сульфидов по общей схеме
[FeS]+Me → (MeS) + Fe.
В этом случае перераспределение серы между фазами и содержащимися в них сульфидами будет происходить до выравнивания соответствующихпотенциалов:
|
= |
, |
S[FeS] |
S[МeS] |
|
Чем больше разность |
- GO |
, |
GO |
||
(MeS ) |
(FeS ) |
|
228 |
|
|
тем полнее может быть использован элемент Me для удаления серы.
Из рис. 4.8 видно, что по величине силы связи с серой элементы можно расположить в следующий ряд: Са, Ва, Na, Mg, Al.
Чем дальше отстоит элемент от железа, тем эффективнее он может быть использован для десульфурации. Однако не все из перечисленных элементов могут быть эффективно использованы для десульфурации из-за низкой температуры их кипения и другихпричин.
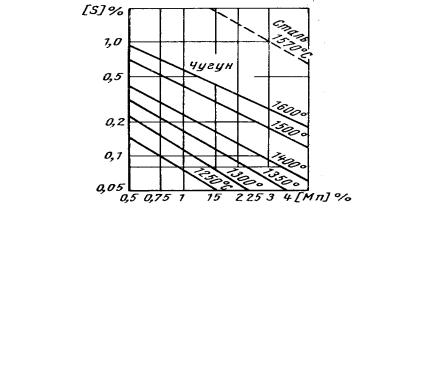
В практике производства чугуна и высокомарганцевых сталей большую роль в десульфурации играет марганец. Его влияние на растворимость серы в чугуне и стали видно из рис. 8.8.
Рис. 8.8. Влияние марганца на растворимость серы в расплавленных чугуне и стали
При сопоставимых температурах и одинаковом содержании марганца равновесное содержание серы в чугуне значительно меньше, чем в стали.
В том случае, когда с газовой фазой контактирует шлак, он поглощает серу. Так, сернистый ангидрид SO2 поглощается шлаком при одновременном увеличении в нем
229

концентрации ионов серы и кислорода. Препятствовать этому может повышенная окисленность шлака.
Непосредственное окисление серы, содержащейся в расплавах железа, кислородом наблюдается в кислородноконвертерных процессах по реакции
[S] + O2 = SO2 . ∆G° = -228 + 0,495 Т кДж/моль
При наличии благоприятных условий такая реакция может происходить в месте контакта кислорода с атомами (ионами) серы. Развитие ее будет определяться величиной поверхности контакта металл — газ, скоростью массопереноса внутри объема металла и другими факторами. При этом решающим фактором является наличие избытка кислорода в пузырьках или на поверхности окисления. При непосредственном воздействии кислорода на шлак термодинамически возможен процесс окисления серы шлака
судалением ее в газовую фазу.
Вспециальной литературе приводятся следующие реакции такого типа:
S2- + 3О2(г) = О2- + SO2(г) ;
2
S2- + 6Fe3+ + 2O2- = 6Fe2+ + SO2(г) .
В процессе десульфурации большое значение имеет изучение закономерностей распределения серы между металлическим и шлаковым расплавами.
Как было отмечено, шлаковый расплав представляет собой высокотемпературный раствор различных анионов и катионов. Поэтому старые представления о переходе серы из металла в шлак (и обратно) по схеме
[FeS]↔(FeS)
и последующем взаимодействии молекул FeS с СаО по реакции (FeS}+(СаО)=(CaS)+(FeO)
230
