
2834.Введение в супрамолекулярную химию
..pdfМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пермский национальный исследовательский политехнический университет»
С.Е. Порозова
ВВЕДЕНИЕ В СУПРАМОЛЕКУЛЯРНУЮ ХИМИЮ
Утверждено Редакционно-издательским советом университета
в качестве учебного пособия
Издательство Пермского национального исследовательского
политехнического университета
2012
1
УДК 541.57 П59
Рецензенты:
член-корр. РАН, д-р хим. наук, проф. В.Г. Бамбуров (Институт химии твердого тела РАН, г. Екатеринбург); д-р техн. наук, проф. С.А. Оглезнева
(Пермский национальный исследовательский политехнический универститет)
Порозова, С.Е.
П59 Введение в супрамолекулярную химию / С.Е. Порозова. – Пермь: Изд-воПерм. нац. исслед. политехн. ун-та, 2012. – 124 с.
ISBN 978-5-398-00753-4
Изложены основы супрамолекулярной (надмолекулярной) химии – междисциплинарной области знания, синтезирующей достижения и терминологию целого ряда естественно-научных дисциплин. Знание основных положений супрамолекулярной химии необходимо современному материаловеду для поиска ответов на возникающие при создании, изучении и применении новых современных наноматериалов проблемы.
Предназначено для студентов, обучающихся по магистерской программе «Наноструктурные материалы и покрытия в нефтедобывающем машиностроении» направления подготовки 150100 – «Материаловедение и технологии материалов» и направлению 210600.62 – «Нанотехнология». Может быть полезно для студентов и аспирантов других инженерных нехимических специальностей в качестве краткого ознакомительного курса.
УДК 541.57
ISBN 978-5-398-00753-4 |
© ПНИПУ, 2012 |
2
ОГЛАВЛЕНИЕ |
|
Предисловие.......................................................................................... |
4 |
Глава 1. Основные понятия и термины |
|
супрамолекулярной химии ................................................................ |
6 |
1.1. Природа супрамолекулярных взаимодействий...................... |
10 |
1.2. Основные разновидности молекул-хозяев.............................. |
20 |
Список литературы к главе 1 .......................................................... |
28 |
Глава 2. Образование супермолекул. |
|
Супрамолекулярные ансамбли....................................................... |
30 |
2.1. Связывание катионов и анионов.............................................. |
30 |
2.2. Связывание нейтральных молекул.......................................... |
38 |
2.3. Молекулярные кристаллы. Самосборка кристаллов. |
|
Жидкие кристаллы........................................................................... |
52 |
Список литературы к главе 2 .......................................................... |
70 |
Глава 3. Супрамолекулярные устройства..................................... |
73 |
Список литературы к главе 3 .......................................................... |
85 |
Глава 4. Супрамолекулярная химия жизни.................................. |
87 |
4.1. Биологические системы и их модели...................................... |
87 |
4.2. Биомиметика............................................................................ |
112 |
Список литературы к главе 4 ........................................................ |
122 |
3
ПРЕДИСЛОВИЕ
Супрамолекулярная (надмолекулярная) химия – междисциплинарная область знания, синтезирующая достижения и терминологию целого ряда естественно-научных дисциплин, таких как материаловедение, физическая химия конденсированных сред, химия координационных соединений, органическая химия, молекулярная биология и т.д. Уже этот неполный перечень дисциплин, лежащих
воснове супрамолекулярной химии, говорит о том, что это «химия для избранных», поскольку трудно представить себе специальность, где одновременно изучались бы все указанные предметы. Вместе с тем краеугольный камень супрамолекулярной химии – исследование процессов самоорганизации материи, без чего практически невозможно создание новых материалов и технологий, органично вписывающихся в экосистему планеты.
Цель предлагаемого пособия – ознакомить студентов, изучавших химию в рамках основного курса для инженерных специальностей, с терминами и понятиями супрамолекулярной химии, основными направлениями исследований, перспективами развития. К сожалению, доступные в настоящее время двухтомник английских авторов (Стид Дж. В., Эствуд Дж. Л. Супрамолекулярная химия:
в2 т. М.: Академкнига, 2007) и книга Ж.-М. Лена (Лен Ж.-М. Супрамолекулярная химия: концепции и перспективы. Новосибирск: Наука, 1998) сложны для понимания неподготовленным читателем. Предлагаемое пособие – это краткий начальный курс, предназначенный для освоения основных положений, которые в дальнейшем могут быть развиты самостоятельно.
Автор надеется, что пособие поможет студентам в будущем как минимум понимать проблемы тех, кто работает в смежных с материаловедением областях знания (химиков-синтетиков, биологов, специалистов по физике и химии конденсированных сред) и без чьего участия невозможно получение систем, способных к самоорганизации на уровне молекулярных ансамблей с сохранением химической индивидуальности компонентов. Создание супрамолеку-
4
лярных ансамблей, в свою очередь, – путь к созданию супрамолекулярных устройств, являющихся основной целью нанотехнологии. При этом успех может быть достигнут только при совместной работе специалистов в области различных наук. И научным фундаментом, объединяющим их в общий коллектив, будут основные положения супрамолекулярной химии, позволяющей по-новому увидеть окружающий нас мир.
Пособие издано в рамках программы опережающей подготовки, ориентированной на инвестиционные проекты Фонда инфраструктурных и образовательных программ «Роснано» в области производства погружных электронасосов для нефтедобычи и их узлов с наноструктурными покрытиями.
5
ГЛАВА 1. ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ СУПРАМОЛЕКУЛЯРНОЙ ХИМИИ
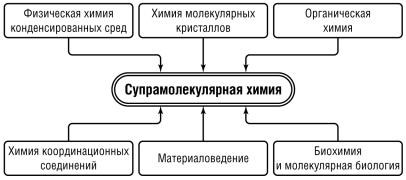
Супрамолекулярная химия – одна из самых молодых дисциплин, появление которой относят к 60–70 гг. XX в. Супрамолекулярная (надмолекулярная) химия – междисциплинарная область знания, вобравшая в себя достижения и терминологию целого ряда ес- тественно-научных дисциплин (рис. 1.1).
Рис. 1.1. Основы супрамолекулярной химии
«Супрамолекулярная химия – это «химия за пределами молекулы», изучающая структуру и функции ассоциаций двух или более химических частиц, удерживаемых вместе межмолекулярными силами» − такое определение дал в 1989 г. Ж.-М. Лен, ранее предложивший сам термин «супрамолекулярная химия». В настоящее время определений супрамолекулярной химии множество, исследователи пытаются дать наиболее точное научное определение, хотя для понимания сути дисциплины достаточно ограничиться определением Ж.-М. Лена.
Истоки основных понятий супрамолекулярной химии можно найти в работах, выполненных значительно раньше второй половины XX в. (табл. 1). По мнению Ж.-М. Лена, фундамент супрамолекулярной химии заложили три понятия – селективное связывание
6
(П. Эрлих, 1906 г.), распознавание (Э. Фишер, 1894 г.) и координация (А. Вернер, 1893 г.).
Таблица 1 Некоторые этапы развития супрамолекулярной химии
Год |
Автор |
Достижение |
1810 |
Г. Дэви |
Открытие гидрата хлора |
1823 |
М. Фарадей |
Формула гидрата хлора |
1893 |
А. Вернер |
Химия координационных соединений |
1894 |
Э. Фишер |
Концепция «ключ – замок» (молекулярное |
|
|
распознавание) |
1906 |
П. Эрлих |
Введение понятия «рецептор» (селективное |
|
|
связывание) |
1937 |
К. Вольф |
Введение термина «супермолекула» для |
|
|
описания образований, возникающих при |
|
|
объединении координационно насыщенных |
|
|
частиц |
1961 |
Н. Куртис |
Первое макроциклическое основание Шиф- |
|
|
фа из ацетона и этилендиамина |
1964 |
В. Буш, |
Макроциклические основания Шиффа |
|
В.-Г. Егер |
|
1967 |
Ч. Педерсен |
Синтез краун-эфиров |
1978 |
Ж.-М. Лен |
Введение понятия «супрамолекулярная хи- |
|
|
мия», ее определения как «химии молекуляр- |
|
|
ных ансамблей и межмолекулярных связей» |
1983 |
Д. Крам |
Синтез сферандов и кавитандов |
1987 |
Присуждение |
Нобелевской премии по химии Д. Краму, |
|
Ж.-М. Лену и Ч. Педерсену за их работы в области супра- |
|
|
молекулярной химии |
|
В супрамолекулярной химии молекула играет роль, аналогичную той, которую атом выполняет в химии традиционной, т.е. является как бы неделимой частицей в надмолекулярных процессах.
7
Взаимодействуя, молекулы хотя и претерпевают определенные изменения, но в таких пределах, которые, как правило, оставляют за ними их химическую индивидуальность.
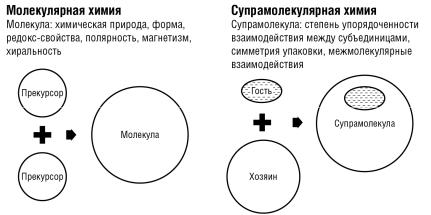
На рис. 1.2 представлено сравнение диапазонов молекулярной и супрамолекулярной химии. Классическая химия исследует структуру, свойства и превращения отдельных молекул и имеет дело в основном с реакциями, в которых происходят разрыв и образование валентных связей. Объектом изучения супрамолекулярной химии служат почти исключительно невалентные взаимодействия: водородная связь, электростатические взаимодействия и т.д. Энергия невалентных взаимодействий на 1–2 порядка ниже энергии валентных связей, однако для невалентных взаимодействий характерно образование множественных связей и прочных, но гибко изменяющих свою структуру ассоциатов. Именно сочетание прочности и способности к быстрым и обратимым изменениям – важнейшее свойство всех биологических молекулярных структур: белков, ферментов, нуклеиновых кислот.
Рис. 1.2. Сравнение диапазонов молекулярной и супрамолекулярной химии
Межмолекулярные взаимодействия могут привести к образованию макромолекулярного ансамбля (надмолекулы), который состоит
8
из нескольких десятков молекул, или (при хорошей пространственной комплементарности) к образованию клатратных соединений. Последние представляют собой молекулярные кристаллы, построенные из разного сорта молекул таким образом, что молекулы одного сорта строят кристаллический каркас (молекулы-«хозяева»), в полостях которого располагаются молекулы-«гости». Клатраты относятся к так называемым гетеромолекулярным кристаллам (в отличие от гомомолекулярных кристаллов − молекулярных кристаллов, построенных из одного вида молекул). Упаковка молекул разного вида с образованием кристаллической клатратной фазы энергетически более выгодна, чем существование исходных веществ порознь в присущем им при данных условиях агрегатном состоянии.
Согласно Ж.-М. Лену, супрамолекулярную химию можно разделить на две широкие, частично налагающиеся друг на друга области:
–химию супермолекул – четко обозначенных олигомолекулярных частиц, возникающих в результате межмолекулярной ассоциации нескольких компонентов – рецептора и его субстрата (хозяина
игостя – по другой терминологии) и строящихся по принципу молекулярного распознавания;
–химию молекулярных ансамблей – полимолекулярных систем,
которые образуются в результате спонтанной ассоциации неопределенного числа компонентов с переходом в специфическую фазу, имеющую более или менее четко обозначенную микроскопическую организацию и зависимые от ее природы характеристики (например, клатраты, мембраны, везикулы, мицеллы).
Основные функции супермолекул – молекулярное распознавание, превращение (катализ) и перенос. Функциональные супермолекулы наряду с организованными полимолекулярными ансамблями и фазами могут быть использованы для создания молекулярных
исупрамолекулярных устройств.
9
1.1. Природа супрамолекулярных взаимодействий
Наука и искусство химического синтеза – это знание и предвидение как комбинировать орбитали атомов, чтобы осуществлять химическую сборку атомов, создавая заданные молекулы и вещества.
Бучаченко А.Л. Химия как музыка, или Химические ноты и новые мелодии нового века
Как известно, орбиталь – это область наиболее вероятного местонахождения электрона. Электрон движется в атоме вокруг ядра не по фиксированной линии-орбите, а занимает некоторую область пространства. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая. К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип.
Формы орбиталей вычислены методами квантовой химии. s-Орби- тали имеют сферическую форму и одинаковую электронную плотность в направлении каждой оси трехмерных координат. Далее следуют три р-орбитали. Они имеют форму объемных восьмерок. Каждая р-орби- таль расположена вдоль одной из трех взаимно перпендикулярных осей, в соответствии с этим в названии р-орбитали указывают спомощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность. Начиная с четвертого электронного уровня у атомов появляются пять d-орбиталей, их заполнение электронами происходит у переходных элементов. Четыре d-орби- тали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d-орбиталь представляет собой объемную восьмерку, продетую вкольцо. d-Орбитали могут образовывать гибриды с s- и p-орби- талями. Параметры d-орбиталей обычно используют при анализе строения и спектральных свойств вкомплексах переходных металлов. Семь f-орбиталей и девять g-орбиталей имеют очень сложную форму ивнастоящеевремяпрактическинерассматриваются.
10
