
2834.Введение в супрамолекулярную химию
..pdf
знании механизмов переноса ионов сквозь биологические мембраны. За большой вклад в эти исследования в 1978 г. Ю.А. Овчинников и член-корреспондент АН СССР В.Т. Иванов были удостоены Ленинской премии, а скульптурная композиция, изображающая пространственную структуру калиевого комплекса валиномицина, ныне украшает лужайку перед главным входом в Институт биоорганической химии РАН (рис. 2.1).
Следующий |
важный |
этап |
|
||
визучении соединений, |
способ- |
|
|||
ных связывать |
катионы |
иявив- |
|
||
шихся первыми синтетическими |
|
||||
аналогами природных веществ, |
|
||||
осуществляющих перенос ионов |
|
||||
щелочных металлов через кле- |
|
||||
точную мембрану, связан |
сот- |
|
|||
крытием Ч. Педерсеном в1962 г. |
|
||||
краун-эфиров. Пытаясь синтези- |
Рис. 2.1. Скульптурная композиция, |
||||
ровать ингибиторы, стабилизиру- |
изображающая пространственную |
||||
ющие нефтяные масла для пре- |
|||||
структуру калиевого комплекса |
|||||
дотвращения автоокисления, Пе- |
валиномицина |
||||
дерсен получил вкачестве побоч- ногопродуктапервыйкраун-эфир.
Целых пять лет ученый не спешил публиковаться, а синтезировал все новые и новые краун-эфиры. В полученных Педерсеном соединениях фигурировали несколько атомов кислорода, связанных мостиками CH2CH2, которые, образуя кольцевую цепь (макроцикл того или иного размера), создавали прочные комплексы с ионами щелочных металлов (рис. 2.2). В общей сложности к 1967 г. − моменту первой публикации в журнале Американского химического общества − было синтезировано более 60 полиэфиров с числом кислородных атомов от 4 до 20 и размером цикла от 12до 60-член- ного. Работа ученого стала примером способности одного химика обеспечить интереснейшими задачами значительную часть химического сообщества: Ч. Педерсен стал не только лауреатом Нобелев-
31

ской премии, но и родоначальником гигантского пласта исследований и открытий.
Рис. 2.2. Образование комплекса 18-краун-6 и катиона калия
В качестве примера кавитанда, способного связывать катионы, может быть рассмотрен кукурбитурил. Кукурбитурил – тривиальное название органического макроциклического соединения состава C36H36N24O12, данное ему в 1981 г. В. Фриманом в связи с внешним сходством формы молекулы с тыквой (род Cucurbita). Действительно, строение этой молекулы напоминает тыкву или бочку: в областях ее дна и крышки располагаются по шесть атомов кислорода сильно поляризованных карбонильных групп (рис. 2.3).
а |
б |
Рис. 2.3. «Бочка» кукурбитурила: а – вид сбоку; б – вид сверху
32

Соединение было впервые получено еще в 1905 г., но только в 1981 г. удалось определить его состав и структуру. Высота «бочки» оказалась равной 6 Å, максимальный внутренний диаметр – 5,5 Å, атомы же кислорода карбонильных групп образуют два одинаковых портала (т.е. вход и выход) с вандерваальсовым диаметром 4,2 Å. Размеры ее внутренней полости позволяют включать «гостей» – небольшие органические молекулы или ионы.
Кукурбитурил растворим в кислотах и щелочах, легкодоступен, устойчив и способен к координации различных частиц. Даже при очень низкой концентрации он легко связывает кальций − один из наиболее важных и многофункциональных элементов в живых организмах. Атомы кислорода обоих порталов одной молекулы координируют катионы кальция, а те в свою очередь «схватывают» с каждой стороны еще по «бочке». В результате макроциклические молекулы кукурбитурила выстраиваются друг над другом и, чередуясь с катионами кальция, образуют бесконечные полимерные цепи (рис. 2.4) − молекулярные «трубы». Метильная группа коорди-
нированной к кальцию моле- |
||||
кулы метанола располагается |
||||
внутри |
полости |
кукурбиту- |
||
рила, |
что свидетельствует |
|||
о ее гидрофобности. |
Такие |
|||
высокоупорядоченные |
орга- |
|||
нические-неорганические гиб- |
||||
ридные |
материалы |
сболь- |
||
шими |
каналами, |
размеры |
||
и форму которых можно кон- |
||||
тролировать, |
представляют |
|||
несомненный |
интерес для |
|||
тонкой |
очистки, |
разделения |
||
и выделения веществ, супра- |
Рис. 2.4. Молекулярные «трубы», |
молекулярного катализа, оп- |
образованные супермолекулами |
тоэлектроники. |
кукурбитурила с катионами кальция |
|
|
|
33 |
Кукурбитурил, образно говоря, «бочка без дна и крышки». Для получения супермолекул на основе кукурбитурила «крышки» должны хорошо подходить по размеру и образовывать межмолекулярные контакты с самой «бочкой», и чем таких взаимодействий больше, тем лучше «крышки» будут удерживаться.
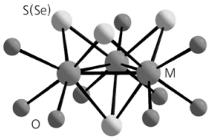
Наиболее подходящими для этой цели оказались трехъядерные аквакомплексы молибдена или вольфрама состава [M3Q4(H2O)9]4+
|
(M = Mo, |
W; Q = S, Se) |
||
|
(рис. 2.5). |
В этих |
комплек- |
|
Рис. 2.5. Трехъядерныекоординационные |
сах атомы металла образу- |
|||
ют треугольник, а из четы- |
||||
аквакомплексы [M3Q4(H2O)9]4+ |
рех имеющихся |
мостико- |
||
(M = Mo, W; Q = S, Se) |
||||
вых атомов серы или селена |
||||
|
||||
один соединен с тремя атомами металла по одну сторону треугольника М3, а три располагаются по другую. Атомы металла дополнительно координированы молекулами воды, шесть из которых лежат примерно в одной плоскости и способны образовывать водородные связи с шестью атомами кислорода в портале. Кислотные свойства трехъядерных аквакомплексов облегчают образование водородных связей.
Для создания прочных супрамолекулярных соединений необходимо как совпадение размеров «крышки» и «бочки», так и образование между ними развитой системы водородных связей. Экспериментальные исследования подтвердили, что аквакомплексы [M3Q4(H2O)9]4+ и кукурбитурил прекрасно отвечают обоим этим условиям. В результате удалось получить «бочки» двух типов: с одной «крышкой» и с двумя (рис. 2.6). Размеры таких супермолекул составляют 15 и 25 Å соответственно. «Крышка» плотно закрывает «бочку» кукурбитурила с одной или с обеих сторон, а шесть молекул воды кластера соединяются с атомами кислорода портала максимально возможным числом водородных связей – 12 (!), благодаря чему
34
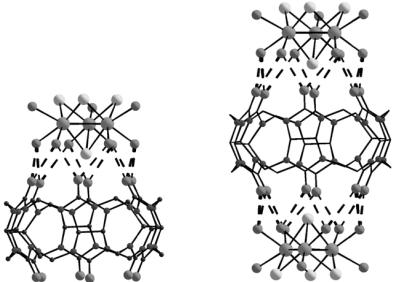
строительные блоки прочно удерживаются вместе. Супрамолекулярные комплексы, полученные в виде красивых кристаллов из смеси разбавленныхрастворовисходныхсоединений– кукурбитурилаикластеров, – ужеболеенерастворяютсянивводе, нивкислотах.
а |
б |
Рис. 2.6. Супермолекулы «бочки»: а – с одной «крышкой»; б – с двумя. Водородные связи показаны пунктирными линиями
На основе рассмотренных основных классов соединений за последнее время было создано огромное количество макроциклов. Следует отметить, что более сложным соединениям присущ также и более сложный процесс молекулярного распознавания. Если для простых криптатных комплексов характерно наиболее простое – «сферическое» распознавание, при котором играет роль лишь размер сферы, аппроксимирующий субстрат, то для сложных соединений молекулярное распознавание может быть «тетраэдрическим» или «линейным» распознаванием, осуществляемым рецепторами разного типа.
35

Более сложной задачей является конструирование молекулхозяев для анионов.
1. Анионы довольно велики и для них требуются рецепторы значительно большего размера, чем для катионов. Например, ионный радиус иона F− (одного из самых маленьких анионов) сравним
сионным радиусом K+ (1,33 и 1,38 Å).
2.Даже у простых неорганических ионов существует большое разнообразие формы и геометрии (линейная, тетраэдрическая, октаэдрическая и т.д.).
3.У анионов свободные энергии сольватации больше, чем у катионов того же размера, поэтому хозяева анионов должны более эффективно конкурировать с окружающей средой.
4.Многие анионы существуют в узких пределах рН.
5.Обычно анионы координационно насыщены и поэтому связываются только посредством слабых взаимодействий, таких как водородные связи и силы Ван-дер-Ваальса.
В живой природе очень распространены такие анионы, как фосфаты, хлориды, сульфаты и карбоксилаты, связывание этих анионов в основном достигается с помощью хозяев-белков.
Химики из США получили самоорганизующуюся «клетку», предназначенную для специфического распознавания сульфатанионов (рис. 2.7). Рецептор достаточно прочно связывает сульфат, что позволяет использовать его для выделения сульфатионов из воды. Исследователи применяли компьютерное моделирование для предска-
Рис. 2.7. Строение зания идеального окружения для сульфат- сульфат-иона анионов. Обычно выделить сульфат из вод-
ного окружения очень сложно, так как он образует 12 прочных водородных связей с окружающими молекулами воды, а для эффективного связывания сульфата необходимо их разрушить. Расчеты показали, что для успешного разрушения клетки водородных связей сульфата с водой можно использовать
36
шесть молекул мочевины, расположенных на гранях тетраэдр. Таким образом, проблема исследователей заключалась в разработке способа правильного размещения молекул мочевины в пространстве. Казалось очевидным, что получение клетки такой формы средствами органического синтеза будет неэффективно, поэтому исследователи решили использовать подход, связанный с самоорганизацией. Стабильные в воде бипиридиновые комплексы никеля оказались идеальными кандидатами для заполнения вершин тетраэдрической клетки. Окончательной задачей было разработать подходы к правильному размещению всех компонентов в пространстве. В решении этого вопроса исследователям помогла программа HostDesigner, позволяющая быстро перебирать возможные структуры (в данном случае было исследовано около 270 000 структур).
Ученые из МГУ в ходе поиска новых супрамолекулярных образований, содержащих положительно заряженные каркасы хозяина ианионы гостей впустотах каркаса, синтезировали новые фазы:
[Hg6P4](TiCl6)Cl (I), [Hg6As4](TiBr6)Br (II), [Hg6As4](InCl6)Cl (III); [Hg2As]2GaI4 (IV), [Hg2As]2InBr4 (V), [Hg2P]2ZnI4 (VI), [Hg23As12](ZnBr4)6 (VII) [Hg13As8](ZnCl4)4 (VIII), [Hg11As4](GaBr4)4 (IX), [Hg7As4I3](SnI3) (X),
[Hg7As4Br3](SnBr3) (XI), [Hg7Sb4I3](SnI3) (XII) и [Hg7As4Cl3](SnCl3) (XIII).
Для соединений I–III, VI–VIII и X–XII определены кристалллические структуры, дляостальных– моделикристаллическихструктур.
Показано, что в основе кристаллического строения всех фаз лежат положительно заряженные каркасы, образованные атомами ртути и пниктогена – элемента 15-й группы (подгруппа азота). При этом атомы ртути имеют координацию, близкую к линейной, а атомы пниктогена – тетраэдрическую.
Во всех фазах, кроме IV–VI и IX, образуются связи между атомами пниктогена, тогда как в IX – связи между атомами ртути. Образование связей ртуть-ртуть и пниктоген-пниктоген позволяют варьировать размеры полостей и заряд каркаса и тем самым создавать возможности для внедрения металл-галогенид-анионов различной формы и заряда.
37
Во всех случаях расстояния между атомами, входящими в подструктуру хозяина, и атомами аниона-гостя превышают сумму ковалентных радиусов. Тем не менее взаимодействие «гость – хозяин» заметно более сильное, чем ожидается при наличии только дисперсионных (вандерваальсовых) взаимодействий. С привлечением ряда спектральных методов, резистивных и магнитных измерений, а также квантово-механических расчетов различного уровня показано взаимное влияние структур гостя и хозяина. Такое влияние проявляется как в стабилизации необычных степеней окисления, так и в переносе заряда в системе «гость – хозяин» в случае соединений, содержащих переходный металл в составе аниона-гостя.
2.2. Связывание нейтральных молекул
Среди хозяев, связывающих нейтральные молекулы, встречаются как кавитанды − молекулы-хозяева с внутримолекулярными полостями, так и клатранды − хозяева с межмолекулярными полос- тями-зазорами между двумя или более молекулами хозяина, существующими только в кристаллическом или твердом состоянии.
Образующиеся при внедрении молекул-гостей в межмолекулярные полости хозяев клатраты очень распространены и уже в настоящее время находят широкое применение в промышленности. Известны неорганические твердофазные клатратные соединения − клатратные гидраты, цеолиты, твердые слоистые материалы и их интеркаляты − и твердофазные клатратные соединения органических хозяев.
Клатратные гидраты
Газовые гидраты, или клатратные гидраты – кристаллические соединения, образующиеся при определенных термобарических условиях из воды и газа. Гидраты газа относятся к соединениям переменного состава − нестехиометрическим. Молекулы газа связаны с каркасом воды вандерваальсовыми силами. Впервые гидраты газов (сернистого газа и хлора) наблюдали еще в конце XVIII в. Дж. Пристли, Б. Пелетье и В. Карстен. В общем виде состав газовых гидратов описывается формулой
38

M · nH2O,
где М – молекула газа-гидратообразователя; n – число, показывающее количество молекул воды, приходящихся на одну молекулу газа (n может изменяться от 5,75 до 17).
Клатратные газовые гидраты − твердые кристаллические вещества, внешним видом напоминающие снег или рыхлый лед. Способностью образовывать гидраты обладают все гидрофобные газы и легколетучие органические жидкости, молекулы которых имеют
размеры в пределах 3,8–9,2 Å (Ar, N 2, O2, CH4, C2H4, C2H6, C3H8, изо-
С4Н10, Cl2, галогенопроизводные углеводородов и т.д.), а также некоторые гидрофильные соединения (СО2, SO2, окись этилена, ацетон), взаимодействие которых с водой достаточно слабое и не может препятствовать клатратообразованию. Гидратообразующие вещества, будучи заключенными в водный клатратный каркас, в основном сохраняют свою химическую индивидуальность, равно как и вода.
Тетраэдрическая координация и гибкость Н-связи по длине иуглу позволяют строить из молекул воды рыхлые и близкие по энергии структуры, из которых наиболее устойчивой при обычных условиях является структуральда (обычный лед). Вней все длины связей и углы между нимипрактическиодинаковы иравны2,76 Å и109,5°.
В присутствии гидратооб- |
|
|||
разующих |
частиц |
во |
льду |
|
происходит |
темплатная |
реак- |
|
|
ция, когда вокруг гостя возни- |
|
|||
кают полиэдрические полости, |
|
|||
соответствующие |
его |
разме- |
|
|
рам и состоящие исключи- |
|
|||
тельно из пятиишестичлен- |
|
|||
ных колец с водородными свя- |
Рис. 2.8. Полиэдральное представле- |
|||
зями (рис. 2.8). Их обозначают |
||||
верхними индексами согласно числу колец каждого типа, присутствующихв клетке.
ние больших и малых полостей
39

Существует три типа структуры клатратных газовых гидратов (рис. 2.9). Клатраты типа I состоят из двух полостей 512 и шести полостей 51262. Клатраты типа II – из шестнадцати полостей 512 и восьми полостей 51264. Среди более чем 100 клатратообразующих соединений существуют только 6 исключений из двух основных типов. Полости 51262 и 51264 способны улавливать молекулы разме-
ром до 6,0–6,6 Å.
а |
б |
Рис. 2.9. Кристаллические модификации газовых гидратов: а – структура типа I; б – структура типа II
Первые клатратные гидраты открыты Г. Дэви в 1810 г. (при охлаждении водного раствора хлора до –9 °С образуется гидрат хлора Cl2·10H2O). Некоторые гидраты устойчивы до 31,5 °С. В 1888 г. П. Виллар получил гидрат метана СН4·6Н2О, соответствующий сильно сжатой форме газа (в гидрате метана содержится в 184 раза больше газа, чем в равном объеме при нормальных температуре
идавлении). Гидрат метана поддерживает горение (рис. 2.10).
Внастоящее время повышенное внимание к гидрату метана обусловлено открытием в 1969 г. советскими учеными газовых гидратов в недрах Земли и появившейся затем серией исследований, обнаруживших громадный резерв топлива в виде газовых гидратов в недрах Земли и на дне Мирового океана (рис. 2.11).
40
