
2834.Введение в супрамолекулярную химию
..pdf
Распространенными разновидностями фотохимических устройств являются устройства для преобразования света, способные поглощать свет одной длины волны и излучать свет другой длины волны. В таких устройствах оптимальным считается наличие двух центров (светопоглощающего и светоизлучающего), настраиваемых независимо друг от друга.
Рис. 3.6. Фотохимическое устройство, способное катализировать электрохимическое восстановление углекислого газа
до муравьиной кислоты
Основная концепция молекулярного сенсора представлена на рис. 3.7. Субстрат приближается к рецепторной части сенсора. Рецептор (краун-эфир, кавитанд и т.д.) селективно связывает именно этот видионов илимолекуличерез сигнальноеустройство подаетсигнал.
Рис. 3.7. Схема устройства фотохимического сенсора
81
Можно сформулировать следующие критерии конструирования сенсоров:
–стабильность,
–селективность,
–сродство гостя к хозяину,
–эффективное преобразование сигнала,
–кинетически быстрое детектирование,
–простота передачи сигнала на записывающее устройство,
–доступность.
Ссередины 70-х гг. XX в. начались исследования по использованию разнообразных макроциклических соединений и их ациклических аналогов для создания ион-селективных электродов (ИСЭ) на органические ионы.
Сиспользованием в качестве активных компонентов мембран ди- бензо-18-краун-6 (ДБ18К6), дибензо-27-краун-9 (ДБ27К9) и родственных соединений разработаны ИСЭ на такие биологически активные вещества, как гуанидиний, катионы ароматических аминов, содержащие протонированную аминогруппу, например амфетамин – препарат, используемый для стимуляции нервной системы, а также электроды для определения катионных ПАВ. Селективность комплексообразования «гость– хозяин» в существенной степени зависит от структурного соответствия определяемого иона и органического лиганда. Наиболее ярко роль структурного соответствия проявляется при определении иона гуанидиния. Оказалось, что размер макроцикла и длина полиэфирной цепи поданда существенно влияют на характеристики ИСЭ– крутизну электродной функции ипотенциометрическую селективность. Лучшими реагентами для ионометрического определения гуанидиния оказались ДБ27К9 ифосфорилсодержащий поданд с шестью атомамикислородавполиэфирнойцепи.
Взаимодействия «гость – хозяин» могут быть реализованы и при ионометрическом определении анионов. Для этого в качестве хозяев используют соединения, способные легко протонироваться и, кроме того, содержащие высокоосновные группы, например эфирные, фосфиноксидные заместители, пригодные для образования водородных
82
связей с гидрокси- и карбоксигруппами сложного субстрата. Примеров применения протонированных аминов в качестве активных компонентов анион-селективных электродов мало, и относятся они в основном к использованию макроциклических полиаминов, способных взаимодействовать с полианионами нуклеотидов, анионами малеиновой и фумаровой кислот. При этом электрод способен эффективно различать геометрические изомеры-анионы малеиновой и фумаровой кислот, а также изомеры положения – анионы фталевой и терефталевой кислот (отклик дается на малеиновую и фталевую кислоты).
Cущественно расширяет круг определяемых органических ионов использование потенциометрических биодатчиков – ферментных электродов. В тонком слое иммобилизованного на поверхности ионочувствительной мембраны фермента осуществляется ферментативная реакция с образованием продуктов, обусловливающих отклик ИСЭ. Эти датчики позволяют с высокой селективностью определять белки, гормоны, антибиотики и еще некоторые органические соединения.
Молекулярные электронные устройства
К молекулярным электронным устройствам относят такие устройства, которые функционально схожи с компонентами электронных приборов. Так, основные свойства молекулярного провода – способность соединять два компонента (донор и акцептор электронов) и проводить электрический сигнал между ними.
Молекулярный выпрямитель, как устройство, пропускающее поток электронов только в одном направлении, должен состоять из донора и акцептора, разделенных изолирующим спейсером
(рис. 3.8).
Молекулярные переключатели. В последнее время удалось соз-
дать переключающиеся молекулярные ансамбли, изменяющие свою пространственную структуру в зависимости от действия таких внешних факторов, как рН среды или ее электрохимический потенциал. Примером может служить ротаксан (рис. 3.9).
83

Рис. 3.8. Примеры молекулярных выпрямителей
Рис. 3.9. рН- и электрохимически переключаемый молекулярный челнок на основе [2]ротаксана
84
Он состоит из длинной полиэфирной цепочки, которая «продета» через цикл, построенный из двух остатков дипиридила, соединенных циклофановыми мостиками. Чтобы цикл не соскочил с цепочки, на концах ее имеются объемные группы – триизопропилсилильные заместители. Включенные в полиэфирную цепочку остатки 4,4'-диаминодифенила и 4,4'-дигидроксидифенила обладают выраженными электронодонорными свойствами, поэтому электроноакцепторный тетракатионный цикл электростатически закрепляется именно на них. При этом реализуются две конформации, находящиеся в состоянии подвижного равновесия. Ввиду того, что ароматические амины – более сильные электронодоноры, чем фенолы, преобладает форма, где цикл взаимодействует с аминным фрагментом. Однако положение равновесия можно изменять, варьируя кислотность среды. В сильнокислой среде аминные атомы азота протонируются, т.е. сами становятся электроноакцепторами, и бисдипиридиниевый цикл полностью перескакивает на фенольный фрагмент. То же самое происходит при изменении внешнего электрохимического потенциала. По-видимому, на основе этого устройства может быть создан молекулярный переключатель. Полагают, что подобные молекулярные устройства обеспечат будущее развитие нанотехнологии, которая во многом заменит доминирующую сейчас полупроводниковую технологию.
Список литературы к главе 3
1.Стид Дж. В., Эствуд Дж. Л. Супрамолекулярная химия: пер.
сангл.: в 2 т. – М.: Академкнига, 2007. – Т. 1. – 480 с.; Т. 2. – 416 с.
2.Рамбиди Н.Г., Березкин А.В. Физические и химические основы нанотехнологий. – М.: Физматлит, 2008. – 456 с.
3.Нанотехнологии. Азбука для всех / под ред. Ю.Д. Третьякова. М.: Физматлит, 2010. – 2-е изд., испр. и доп. – 368 с.
4.Лукашин А.В. Создание функциональных нанокомпозитов на основе оксидных матриц с упорядоченной пористой структурой: автореф. дис. … д-ра хим. наук. – М., 2009. – 47 с.
85
5.Шведене Н.В. Селективные электроды на органические ионы // Соросовский образовательный журнал. – 2004. – № 2. – С. 37–43.
6.Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал. – 1996. – № 12. –
С. 26–32.
86
ГЛАВА 4. СУПРАМОЛЕКУЛЯРНАЯ ХИМИЯ ЖИЗНИ
4.1. Биологические системы и их модели
Биологические системы можно назвать совершенными супрамолекулярными системами. Супрамолекулярные хозяева в биологии – это рецепторные участки ферментов, ионов, антител иммунной системы, ионофоров. Все такие компоненты проявляют способность к распознаванию, самосборке, самоорганизации, кинетическую и термодинамическую комплементарность. Подавляющее большинство этих свойств обусловлено ион-дипольными, водородными и π -π - стэкинг-взаимодействиями. Наибольшая часть усилий, предпринятых до настоящего времени в области супрамолекулярной химии, направлена на попытки смоделировать катализ органических реакций ферментами и селективный транспорт ионов металлов или молекулярных субстратов. И хотя синтетические объекты еще очень сильно отстают от своих биохимических аналогов, именно этот путь позволяет надеяться на создание эффективных технологий, органично вписывающихся в процессы живой природы.
Структурной основой всех живых организмов являются биополимеры – природные высокомолекулярные соединения. К их числу относятся белки, полисахариды и нуклеиновые кислоты. Выделяют также группу смешанных биополимеров: липопротеины, гликопротеины, липополисахариды.
Важной частью смешанных биополимеров являются липиды – жирные кислоты и их производные. Жирными кислотами называют алифатические монокарбоновые кислоты R–COOH. Основные биологические функции липидов представлены на рис. 4.1. Этот список увеличивается по мере изучения липидов. В обеспечении названных и других функций участвуют липиды различной структуры и в разных количествах: от тонн до нанограммовых доз.
В настоящее время известно свыше 800 жирных кислот, отсюда нетрудно представить себе чрезвычайное многообразие липидов, являющихся их производными (спирты, альдегиды, эфиры и т.д.).
87

Рис. 4.1. Основные биологические функции липидов
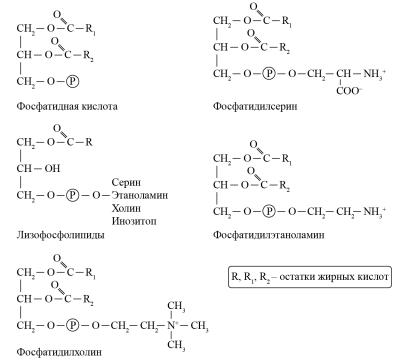
Биологическое и практическое значение липидов различно. Так, из 5 разновидностей полярных липидов во всех живых организмах присутствуют представители только фосфолипидов и гликолипидов. На рис. 4.2 приведены структурные формулы наиболее часто встречающихся фосфолипидов.
Фосфолипиды являются одними из основных компонентов биомембран, среди них есть биологически активные вещества, они довольно широко используются в пищевой и фармацевтической промышленности. Фосфатидилхолин − главный фосфолипид большинства животных. Его содержание обычно составляет не менее 50 % суммы фосфолипидов. Вторым по значению фосфолипидом у животных обычно является фосфатидилэтаноламин. В большинстве бактерий фосфатидилхолина нет, а более 60–70 % их фосфолипидов составляет фосфатидилэтаноламин. Оба липида присутствуют в большинстве растений. Фосфатидилглицерин – единственный фосфолипид сине-зеленых водорослей, главный фосфолипид фотосинтетического аппарата всех растений.
Животные и растения существенно различаются по составу полярных липидов. У животных преобладают фосфолипиды, в растениях гораздо больше гликолипидов, играющих важную роль в про-
88
цессе фотосинтеза. У позвоночных животных наиболее богаты гликолипидами мозг и нервные ткани. Животные различаются и по способности преобразовывать некоторые жирные кислоты. Так, хищники не могут синтезировать высшие полиеновые жирные кислоты, они должны получать все нужные им кислоты в готовом виде из мяса или рыбы. Организм человека может превращать жирные кислоты, однако делает это не очень активно. Существуют популяционные различия: у эскимосов, индейцев синтез высших полиеновых жирных кислот идет в значительно меньшей степени, чем у представителей европеоидов. Вероятно, поэтому не все люди могут быть вегетарианцами.
Рис. 4.2. Структурные формулы некоторых фосфолипидов
89

В середине 60-х гг. XX в. английский ученый Алек Бэнгхем установил, что фосфолипиды, являющиеся основными компонентами клеточных мембран, способны самопроизвольно образовывать в воде замкнутые мембранные оболочки. Эти оболочки захватывают в себя часть окружающего водного раствора, а образующая их фосфолипидная мембрана обладает свойствами полупроницаемого барьера, легко пропускающего воду, но препятствующего диффузии растворенных в ней веществ.
Открытие имело огромное значение для дальнейшего развития всей мембранной биологии. Липидные частицы, описанные А. Бэнгхемом и его сотрудниками, оказались максимально упрощенной моделью клеточных мембран. Очень скоро эти частицы, получившие название липосомы (от греч. «липос» − жир и «сома» − тельце или частица), стали излюбленным объектом исследования многих ученых, занимавшихся изучением самых разных свойств биологических мембран.
По своему химическому строению фосфолипиды относятся к группе амфифильных соединений, молекулы которых состоят из двух частей, радикальным образом различающихся по своему отношению к водному окружению. Такое «раздвоение личности» придает фосфолипидным молекулам замечательное свойство самопроизвольно образовывать в воде мембраны, которые представляют собой двойной слой липидных молекул, обычно называемый просто липидным бислоем. Стремление максимально ограничить контакт неполярных цепей липида с водой приводит к тому, что бислой при его достаточной протяженности замыкается сам на себя (рис. 4.3),
образуя полые оболочечные структуры, получившие назва-
ние |
«везикулы» |
(от англ. |
vesicle – маленький пузырек). |
||
|
Часто слова |
«липосомы» |
и «липидные везикулы» исполь-
зуют как синонимы. Однако
90
