
2834.Введение в супрамолекулярную химию
..pdfПри укладке молекул гидрохинона в кристаллическую структуру действуют два противоречивых, соизмеримых по величине начала: вандерваальсово взаимодействие стремится упаковать молекулы плотнейшим образом, тогда как для образования водородных связей необходима определенная ориентация молекул, в общем случае не совпадающая с требуемой для плотнейшей упаковки. Каждая структура представляет собой компромисс между этими требованиями. В β -гидрохиноне верх одерживает водородная связь (ее длина 2,68 Å) в ущерб качеству упаковки (плотность 1,26 г/см3), для такой структуры характерна высокая концентрация полостей (одна полость на три молекулы гидрохинона). В γ - гидрохиноне водородная связь ослаблена (2,84 Å), но упаковка заметно лучше (1,38 г/см3). В α -гидрохиноне наиболее удачный компромисс: средняя длина Н-связи 2,72 Å ( от 2,66 до 2,78 Å) и плотность 1,36 г/см3. Хотя в структуре и содержатся полости (практически те же, что в β -структуре), но в концентрации гораздо меньшей (1:18). Это делает структуру α -гидрохинона стабильной вплоть до температуры плавления.
Интересной особенностью этих структур является то, что полости и в той и в другой практически одинаковы. Шесть молекул гидрохинона связываются с помощью водородных связей. Три молекулы гидрохинона из шести (через одну) направлены вверх под углом около 45°, а три − вниз. В молекуле гидрохинона две гидроксильные группы находятся в пара-положении, поэтому в результате такой упаковки образуется ажурный каркас. Однако столь рыхлая структура абсолютно неустойчива. Структура β -гидрохинона представляет собой два таких взаимопроникающих каркаса, между которыми нет Н-связей. Структурная (предельная) стехиометрия для α -гидрохинона 1:18, для β -гидрохинона 1:3, если полости полностью заняты молекулами-гостями. Для α -модификации, которая стабильна и без гостей, степень заполнения полостей может быть нулевой, а в β -гидрохиноне только структура становится устойчивой в присутствии гостей.
51
Гидрохинон способен образовывать клатратные соединения с газами, в том числе и с благородными, с фуллеренами С60 и С70. Поскольку сам фуллерен кристаллизуется с плотнейшей укладкой молекул, то структуру клатрата можно представить как структуру фуллерена, в которой одна треть его молекул замещена фрагментами из шести молекул гидрохинона. Образующаяся структура имеет прекрасную упаковку. Коэффициент упаковки k = 0,764, что выше, чем при плотнейшей укладке шаров одинакового размера (0,740), в данном случае это возможно из-за более эффективного использования молекулами гидрохинона пространства октаэдрических и тетраэдрических полостей в плотной упаковке шаров. Установлено также, что гидрохинон, также как и вода, способен строить несколько каркасов, приспосабливаясь к гостевым молекулам. Соединения гидрохинона и его аналогов являются типичными представителями решетчатых клатратов, кристаллический каркас которых содержит полости молекулярного размера. В эти полости способны включаться совершенно разные по своей химической природе молекулы, в то же время эти молекулы-гости являются аналогами, поскольку имеют сравнительно одинаковые размеры, форму и взаимодействуют с хозяйским каркасом только посредством вандерваальсовых сил.
2.3. Молекулярные кристаллы. Самосборка кристаллов. Жидкие кристаллы
Супермолекулы способны организовываться в супрамолекулярные ансамбли. Супрамолекулярные ансамбли – это полимолекулярные образования, возникающие при спонтанной ассоциации неопределенно большого числа компонентов в специфическую фазу, которая может быть охарактеризована определенной микроскопической организацией и макроскопическими свойствами. Примерами супрамолекулярных ансамблей являются молекулярные пленки, слои, мембраны, мицеллы, жидкие кристаллы, молекулярные кристаллы, соединения типа «гость – хозяин».
52

|
гом в соседних слоях тем же самым |
||
|
образом, что и в супрамолекулярных |
||
|
соединениях. Дисульфид |
вольфрама |
|
|
имеет |
графитоподобную |
слоистую |
|
структуру, состоящую из чередую- |
||
|
щихся |
гексагональных |
плоскостей |
|
вольфрама и серы с межслоевым рас- |
||
|
стоянием 0,62 нм (рис. 2.20). |
||
|
В |
настоящее время дисульфиды |
|
|
получены в виде фуллереноподобных |
||
|
частиц. Для этого достаточно при оп- |
||
|
ределенных условиях (запатентован- |
||
|
ных международной фирмой, произ- |
||
Рис. 2.20. Структура дисуль- |
водящей дисульфиды в форме нано- |
||
фида вольфрама. Светлые |
частиц |
в количестве многих кило- |
|
кружки – сера, |
граммов в год) ввести |
в реакцию |
|
темные – вольфрам |
обычный сероводород, а также обыч- |
||
|
|||
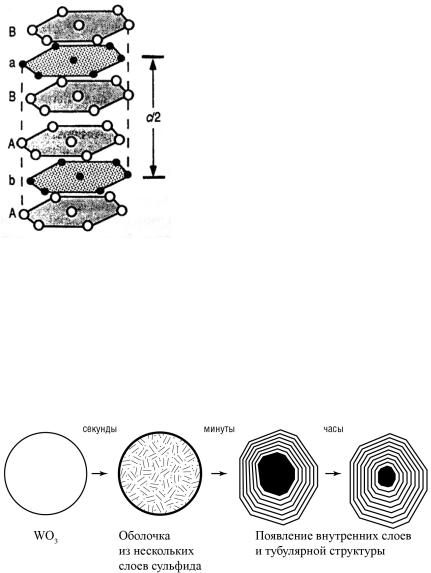
ный оксид вольфрама (VI) WO3. При этом с течением времени частицы трехокиси вольфрама сначала покрываются слоем дисульфида, затем вещество диффундирует внутрь и постепенно с сохранением формы получается слоистое фуллереноподобное или нанотубулярное образование (рис. 2.21).
Рис. 2.21. Процесс трансформации трехокиси молибдена или вольфрама
внанотубулярные и фуллереноподобные структуры при взаимодействии
ссероводородом
54
Формирование замкнутых слоев WS2 внутри частицы происходит самопроизвольно, поскольку любой незамкнутый слой WS2 стремится сомкнуть свои края: на них сосредоточены оборванные химические связи, которые стараются «срастись» друг с другом. В результате исходная частица оксида WO3 превращается в «матрешку», т.е. представляет собой несколько вложенных друг в друга слоистых оболочек. При других условиях из такой частицы может вытягиваться длинная нанотрубка.
Характернейшая особенность слоистых дихалькогенидов металлов − способность включать между слоями халькогена гостей: атомы металлов или малые молекулы. Такое внедрение приводит к раздвиганию слоев и позволяет целенаправленно менять свойства материалов. Атомы серы (или селена) могут, например, координировать атомы ртути. При этом размеры и геометрия треугольного комплексного фрагмента практически не меняются, а значит, он также способен взаимодействовать с кукурбитурилом и образовывать супрамолекулярные соединения (см. рис. 2.19, б). В них атом ртути координируется через атомы селена к «крышкам» соседних супермолекул кукурбитурила, связывая их в бесконечные цепочки. За счет включения ртути расстояние между атомами селена увеличивается. Таким образом, даже вторичные эффекты, например, нековалентные взаимодействия между атомами халькогена, служат важным фактором в образовании структуры как для создания неорганических материалов (дихалькогенидов переходных металлов), так и для упаковки супермолекул.
Кукурбитурил способен включать в свою полость и небольшие молекулы. Известно, что подобные явления играют исключительно важную роль в самых разнообразных процессах: дыхании и регенерации кислорода растениями, ферментативном катализе, анестезии, формировании залежей природного газа и т.д. Наличие у кукурбитурила одной или двух «крышек» создает более благоприятные условия для внедрения и удержания гостя в полости супермолекулы. Например, если добавить в реакционную смесь пиридин, он окажется внутри «бочки» с двумя «крышками» (рис. 2.22), несмотря на то что ван-
55
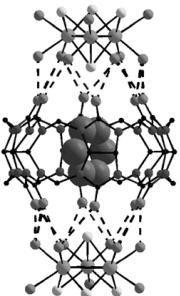
дерваальсов радиус этой органической молекулы (5,9 Å) больше внутреннего диаметра входного отверстия кукурбитурила (4,2 Å).
В этом соединении немного искажены молекулы и гостя, и самого кукурбитурила, но во всем остальном строение этого супрамолекулярного комплекса сходно с теми цепочками, которые получаются без пиридина. В полость кукурбитурила можно включать также другие небольшие молекулы, такие как тетрагидрофуран, бензол, диоксан.
Гости |
надежно размещены |
в «бочке», |
закрытой «крышками». |
Покинуть |
«бочку» они способны |
только при открытых «крышках». Можно ли подобрать экспериментальные условия, которые позволили бы контролировать образование и разрыв связей между исходными строительными блоками и, следовательно, открывать и закрывать «крышки», впускать и вы-
пускать гостя из полости? Да, увеличивая, например, концентрацию соляной кислоты, заменяют атомами хлора молекулы воды, координированные к металлу треугольного кластера и ответственные за образование водородных связей. Их система рушится, «крышки» снимаются, и гость покидает полость. Если условия реакции снова изменить, так чтобы молекулы воды заняли места атомов хлора, опять получатся супрамолекулярные соединения, в которых «крышки» эффективно закрывают «бочку» кукурбитурила.
Изучение обратимого включения гостей в полость молекулы хозяина представляет интерес не только с научной точки зрения.
56

Оно вносит существенный вклад и в развитие исследований по проблеме транспорта веществ, в том числе лекарств, и позволяет осуществлять направленное конструирование молекулярных «контейнеров». За счет взаимодействия «гость – хозяин», например, можно было бы включать в полости органических макроциклических соединений сильнодействующие лекарственные препараты, избирательно доставлять их в необходимое место в организме человека
ив нужный момент открывать «крышки».
Кнастоящему времени разработаны методы синтеза кукурби-
турилов более крупных размеров, «бочек» большего диаметра, с семью, восемью и более атомами кислорода в каждом портале. Такие молекулы способны образовывать больше водородных связей, за счет чего супрамолекулярные соединения становятся прочнее. Большие молекулярные контейнеры смогут вмещать в себя и более крупных гостей. Это открывает уникальные возможности для создания новых гибридных материалов.
Супрамолекулы в результате самосборки, как и обычные молекулы, могут образовывать молекулярные кристаллы. В узлах решеток молекулярных кристаллов находятся молекулы, между которыми действуют вандерваальсовы силы (или другие слабые взаимодействия), имеющие невысокую энергию. Это и определяет свойства молекулярных кристаллов. Вещества с молекулами сферической формы имеют структуру плотной упаковки. Кристаллы с полярными молекулами в узлах имеют более высокую прочность и температуру плавления, чем кристаллы с неполярными молекулами в узлах. На рис. 2.23 представлены примеры молекулярных кристаллов.
Приведем различные варианты молекул-хозяев, образующих молекулярные кристаллы.
Неорганические хозяева |
Органические хозяева |
Каркасные силикаты |
Гидрохинон |
Слоистыегидроксиды(Mg, Al, Fe) |
Мочевина |
Графит |
Тиомочевина |
Слоистые халькогениды металлов |
Циклодекстрины |
Слоистые оксиды / перовскиты |
Краун-эфиры |
Слоистые фосфаты |
Целлюлоза |
57

а б
Рис. 2.23. Молекулярные кристаллы краун-эфира (а, схематическое изображение) и белков (б, фотография)
Различают самосборку кристалла и самосборку в растворе. Самосборка кристалла – неравновесный процесс, в ходе которого конечная структура материала зависит от условий кристаллизации. Как правило, образуются полиморфные структуры, т.е. кристаллы, состоящие из одинаковых, но упакованных различным образом «строительных единиц» (супермолекул). При этом структуры, которые образуются быстро, могут доминировать над более стабильными структурами.
Самосборка в растворе – термодинамически контролируемая равновесная реакция, в ходе которой компоненты способны проходить через целый ряд возможных структур, пока не сформируется структура, обладающая максимальной устойчивостью. Реакция протекает в течение длительного времени.
Синтез кристаллов – сложный процесс, включающий в себя манипулирование системой, в которой осуществляются взаимодействия как дальнего, так и ближнего порядка. Эта область, получившая название «молекулярное конструирование» (А. фон Хиппель, 1962 г.) или «инженерия кристаллов», охватывает большой круг вопросов, таких как твердофазные межмолекулярные взаимодействия, направленное предсказание, получение и интерпретация различных структур, синтез новых кристаллических материалов. Таким образом, ин-
58
женерия кристаллов представляет собой конструирование и получение кристаллического материала на основе представлений о стерических и топологических особенностях имеющихся строительных блоков и их способности к межмолекулярным взаимодействиям.
В настоящее время наиболее распространены смешанные схемы получения молекулярных кристаллов, когда формирование кристалла начинается в растворе и только завершающие стадии происходят в отсутствие растворителя. При этом одним из самых интересных вопросов является формирование кристаллов, обладающих хиральностью, т.е. характеризующихся отсутствием симметрии относительно правой и левой стороны. Хиральность имеет решающее значение при синтезе сложных соединений, обладающих фармакологическими свойствами. Хиральность играет важную роль при синтезе регулярных полимеров, жидких кристаллов, материалов для нелинейной оптики.
Ксожалению, до настоящего времени инженерия кристаллов
взначительной степени основана на предвидении, предсказание структуры кристаллов находится на ранних этапах развития. Подавляющее большинство известных молекулярных кристаллов открыто случайно, а не получено в результате инженерных изысканий. Однако накопление знаний о супрамолекулах и межмолекулярных взаимодействиях позволит, опираясь на более мощные методы расчетов
имоделирования кристаллов, добиться успехов в этой области. Одним из наиболее результативных методов получения супрамолекулярных соединений и молекулярных кристаллов в настоящее время является темплатный синтез.
Термин «жидкий кристалл» подразумевает состояние вещества, сочетающее упорядоченность кристаллического состояния слегкой деформируемостью, характерной для жидкой фазы. По структуре жидкие кристаллы представляют собой жидкости, похожие на желе, состоящие из молекул, определенным образом упорядоченных во всем объеме этой жидкости. По форме молекулы, образующие жидкие кристаллы, могут быть либо вытянутые и стержнеобразные, либо плоские
икруглые (дискообразные). Сильная анизотропия подобных молекул
59
приводит к их упорядочиванию за счет межмолекулярных взаимодействий и высокой вязкости жидкой фазы. При этом незначительные возмущения способны привести кизменению ориентации упорядоченныхобластейдруготносительно друга.
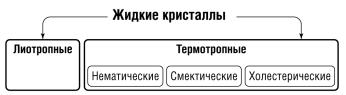
Впервые жидкие кристаллы наблюдал в 1888 г. австрийский ботаник Ф. Рейнитцер. Он обратил внимание, что у кристаллов холестерилбензоата и холестерилацетата было две точки плавления и, соответственно, два разных жидких состояния − мутное и прозрачное. В 1904 г. немецкий профессор О. Леманн после многолетних исследований издал книгу «Жидкие кристаллы», в которой дал научное объяснение открытому явлению. В 1963 г. американец Дж. Фергюсон использовал важнейшее свойство жидких кристаллов − изменять цвет под воздействием температуры − для обнаружения невидимых простым глазом тепловых полей. После того как ему выдали патент на изобретение, интерес к жидким кристаллам резко возрос. В 1968 г. американские ученые создали принципиально новые индикаторы для систем отображения информации. Принцип их действия основан на том, что молекулы жидких кристаллов, поворачиваясь в электрическом поле, по-разному отражают и пропускают свет. Под воздействием напряжения, которое подавали на проводники, впаянные в экран, на нем возникало изображение, состоящее из микроскопических точек. И все же только после 1973 г., когда группа английских химиков под руководством Дж. Грея синтезировала жидкие кристаллы из относительно дешевого и доступного сырья, эти вещества получили широкое распространение в разнообразных устройствах. На рис. 2.24 приведены основные типы жидких кристаллов.
Рис. 2.24. Основные типы жидких кристаллов
60
