
2834.Введение в супрамолекулярную химию
..pdfВ современной химии «орбиталь» – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства. Наиболее важны при этом орбитали тех электронов, которые участвуют в образовании химических связей, т.е. валентных электронов, обычно это электроны последнего уровня.
Орбитали способны к объединению (гибридизации). Так, у атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s-орбитали и по одному электрону на двух р-орбиталях. В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s-орбиталь и три р-орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей. Количество гибридных орбиталей всегда равно количеству исходных, в данном случае четырем. Получившиеся орбиталигибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки. Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями атомов водорода. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали. Гибридизация приводит лишь к изменению формы орбиталей внутри одного атома, а перекрывание орбиталей двух атомов (гибридных или обычных) – к образованию химической связи между ними. В данном случае максимальная электронная плотность располагается вдоль линии, связывающей два атома. Такую связь называют σ -связью.
Молекула этилена образована также с участием орбиталейгибридов, однако в гибридизации участвует одна s-орбиталь итолько две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z, в образовании гибридов не участвует. Из исходных трех орбиталей воз-
11

никают три гибридные орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углымежду осями – 120°. Две орбитали pz, не участвующие в гибридизации, взаимно перекрываются, их геометриятакова, чтоперекрываниепроисходитнеполиниисвязиС–С, а выше и ниже ее. В результате образуются две области с повышенной электронной плотностью, где помещаются два электрона, участвующие в образовании этой связи. Таким образом, образуется одна молекулярная орбиталь, состоящая из двух областей, разделенных в пространстве. Связь, укоторой максимальная электронная плотность расположена вне линии, связывающейдваатома, называютπ -связью.
Супрамолекулярная химия имеет дело с нековалентными связывающими взаимодействиями, т.е. с разнообразными силами притяжения и отталкивания (рис. 1.3).
Рис. 1.3. Супрамолекулярные взаимодействия и их энергия связи
При анализе супрамолекулярной системы очень важно учитывать взаимовлияния этих взаимодействий и эффекты, относящиеся не только к хозяину и гостю, но и к их окружению (сольватация, кристаллическая решетка и т.д.). Характеристика супрамолекулярных взаимодействий (см. ниже) дана по Дж.В. Стиду и Дж.Л. Этвуду.
12

Ион-ионные взаимодействия |
|
По силе ионная связь (энергия связи |
|
100–350 кДж/моль) сравнима с ковалент- |
|
ной. Типично ионное твердое тело – хло- |
|
рид натрия – может быть представлено как |
|
супрамолекулярное соединение, в котором |
|
катион натрия организует вокруг себя |
|
шесть комплементарных донорных атомов |
|
(рис. 1.4). В растворе структура этого типа |
Рис. 1.4. Структура |
распадается из-за эффектов сольватации. |
|
Более наглядным примером супрамо- |
хлорида натрия |
лекулярных ион-ионных взаимодействий являются координационные соединения сосложнымилигандами.
Ион-дипольные взаимодействия
Примером такого взаимодействия (энергия связи 50–200 кДж/моль) может служить связывание иона с полярной молекулой с образованием комплекса. Притяжение полярных молекул к ионам гораздо сильнее, чемкдругимполярныммолекулам, особенноеслиионмногозарядный.
Ион-дипольные взаимодействия хорошо изучены в растворах полярных растворителей. Под действием электрического поля иона полярные молекулы растворителя ориентируются соответствующим образом, создавая вокруг каждого иона сольватную оболочку,
вкоторую входит определенное число молекул растворителя, прочно связанных с ионом и участвующих в тепловом движении вместе с ним как единое целое. Энергия ион-дипольных взаимодействий тем больше, чем больше заряд и меньше радиус иона. Наличие вокруг иона сольватной оболочки и высокая диэлектрическая проницаемость растворителя препятствуют рекомбинации (объединению
вмолекулу) ионов.
Одна из самых полярных молекул – молекула воды, поэтому в водных растворах мы чаще всего имеем дело с супрамолекулярными структурами, называемыми гидратами (рис. 1.5), которые могут существовать не только в растворе, но и в виде кристаллов.
13
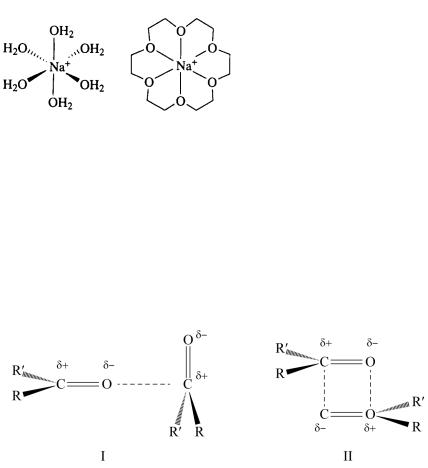
У раствора при образовании гидратов появляются новые свойства, отсутствующие у компонентов. Например: CuSO4 и вода бесцветны, а их раствор (и кристаллогидрат) голубой; уксусная кислота и вода очень плохо проводят ток, а их раствор – гораздо лучше и т.д.
|
|
На рис. 1.5 приведены |
|
|
структурные формулы комп- |
|
|
лексов катиона натрия смоле- |
|
|
кулами воды и краун-эфиром, |
|
|
связанные ион-дипольным вза- |
|
|
имодействием. Вкраун-эфирах |
а |
б |
при образовании комплексов |
эфирные атомы кислорода иг- |
||
Рис. 1.5. Na+ -комплексы с молекулами |
рают ту же роль, что и поляр- |
|
воды (а) и краун-эфиром (б) |
ныемолекулыводы. |
|
|
|
|
Диполь-дипольные взаимодействия
Диполь-дипольные взаимодействия (энергия связи 5–50 кДж/моль) могут возникать при ориентации одного диполя относительно другого. При этом притягиваются либо два полюса соседних молекул (I тип), либо два диполя (II тип). Такое поведение характерно, в частности, для органическихкарбонильныхсоединений(рис. 1.6).
Рис. 1.6. Диполь-дипольные взаимодействия в карбонилах
14
Водородная связь
Водородную связь относят к числу слабых химических взаимодействий (энергия связи 4–120 кДж/моль), тем не менее она играет исключительную роль в стабилизации конденсированных состояний многих простых молекулярных систем, например воды, и в стабилизации биополимеров (нуклеиновых кислот, белков). Водородную связь можно рассматривать как особый вид диполь-дипольного взаимодействия, заключающийся в том, что атом водорода, присоединенный к электроотрицательному атому (или к группе атомов), притягивается к диполю соседней молекулы или функциональной группы. Благодаря такой направленной и относительно сильной своей природе водородная связь считается ключевым видом взаимодействия в супрамолекулярной химии.
Водородные связи позволяют полимерным цепям соединяться в специфические трехмерные структуры, приобретающие при этом функциональную биологическую активность. Эти структуры, с одной стороны, достаточно прочные (за счет образования большого числа водородных связей), а с другой − достаточно чутко реагирующие на изменение внешних условий (например, приближение той или иной молекулы) именно из-за того, что эти взаимодействия являются слабыми. Разрыв таких связей лишает белки или нуклеиновые кислоты их биологических функций.
Современные расчеты показывают, что суммарный заряд на атоме водорода, участвующем в образовании водородной связи, практически не меняется по сравнению с зарядом в мономерной молекуле, что говорит о том, какую заметную роль в образовании водородной связи должна играть поляризация, перераспределение электронного заряда вотдельных областях пространства. Таким образом, водородная связь по своему происхождению не представляет собой нечто отличающееся от того, что характерно для химических связей вообще. Ее определяют главным образом поляризация электронного распределения в мономерных звеньях (в общем случае – вмолекулах, образующих такую связь) и отличная от мономерных звеньев динамика колебательного движенияатомоввводородно-связанном фрагменте.
15
Расстояние между соседними атомами, участвующими в образовании водородной связи, значительно меньше суммы их вандерваальсовых радиусов. Так, в воде расстояние между атомами кислорода
всистеме О–Н…О составляет 0,276 нм. Если принять, что длина ковалентной связи О–Н равна 0,1 нм, то длина связи Н…О составит 0,176 нм, т.е. она значительно (примерно на 70 %) длиннее ковалентной связи между этими атомами. Тем не менее связь Н…О оказывается значительно короче суммы вандерваальсовых радиусов, составляющих для водорода и кислорода соответственно 0,12 и0,14 нм. Последнее обстоятельство является одним из критериев, указывающих на образование между молекуламиводородныхсвязей.
Водородная связь увеличивает длину связи Х–Н, что приводит
ксмещению соответствующей полосы валентных колебаний в ИКспектре в сторону более низких частот. Метод ИК-спектроскопии является главным методом изучения водородной связи. Протоны, участвующие в водородной связи, характеризуются более низкой электронной плотностью, поэтому они деэкранируются, что приводит к существенному смещению соответствующих резонансных сигналов в спектрах ЯМР.
Водородные связи широко представлены в органической химии. Все органические соединения за самым редким исключением содержат водород, т.е. являются кислотами Бренстеда, а наиболее часто входящие в их состав элементы-органогены (O, N, S, галогены) содержат неподеленные пары электронов и могут выступать
вкачестве основных центров. Учитывая это, можно сказать, что
большинство органических соединений потенциально способно к образованию водородных связей. По структурной формуле (природа взаимодействующих групп и их взаимное расположение) можно предсказать силу водородных связей и их характер (внутриили
межмолекулярные). При |
оценке взаимного влияния атомов |
в молекулах обязательно |
учитывается возможность образования |
водородных связей и их последующее влияние на скорость, механизм и направление реакций. Оценить влияние среды (растворителя) на ход химического процесса часто становится возможным лишь с учетом образования водородных связей.
16

Катион-π -взаимодействия
Взаимодействия катионов щелочных и щелочноземельных металлов с двойной связью С = С (рис. 1.7) носят название «катион-π - взаимодействия» (энергия связи 5–80 кДж/моль). Они играют очень важную роль в биологических системах.
Рис. 1.7. Катион-π -взаимодействие катиона натрия с бензолом
π -π -Стэкинг-взаимодействия
Это слабое электростатическое взаимодействие (энергия связи 0–50 кДж/моль) часто наблюдается между ароматическими кольцами, если одно из них богато электронами, а второе испытывает их недостаток. На рис. 1.8 приведены два основных типа взаимодействия: «плоскость к плоскости» и «торец к плоскости». Кроме этих двух типов существует большое количество промежуточных вариантов.
|
|
Рис. 1.8. Основные |
|
|
типы π -π -стэкинг- |
|
|
взаимодействия: |
|
|
а – «плоскость |
|
|
к плоскости»; |
а |
б |
б – «торец |
к плоскости» |
||
|
|
17 |
Силы Ван-дер-Ваальса
Взаимодействия Ван-дер-Ваальса (энергия связи менее 5 кДж/моль) возникают благодаря поляризации электронного облака из-за соседства близлежащих ядер. Эти силы не являются направленными.
Обычно их разделяют на три вида: силы, зависящие от ориентации электрических диполей (ориентационный эффект); силы, зависящие от электростатической индукции; силы, зависящие от взаимодействия между флуктуирующими диполями (дисперсионный эффект). Ориентационный эффект и соответствующие силы связаны с тем, что молекулы, обладающие постоянным дипольным моментом, взаимодействуя между собой, ориентируются друг относительно друга, как только межмолекулярное расстояние r становится достаточно малым. Если молекула, имеющая постоянный электрический момент µ, приближается к молекуле с нулевым электрическим моментом, то в последней индуцируется электрический момент, пропорциональный ее поляризуемости α.
Дисперсионный эффект, впервые отмеченный Лондоном, заключается в том, что вследствие флуктуаций дипольных моментов между нейтральными атомами возникают силы взаимного притяжения (дисперсионные силы Лондона). Дипольный момент появляется тогда, когда центр тяжести электронного заряда не совпадает с центром положительного заряда ядра атома. Величина и направление этого момента будут периодически меняться, причем, поскольку все направления для изолированного атома равновероятны, среднее по времени значение дипольного момента равно нулю.
В супрамолекулярной химии силы Ван-дер-Ваальса наиболее важны при образовании соединений включения, когда небольшие органические молекулы встраиваются внутрь кристаллических решеток или молекулярных полостей. За счет сил Ван-дер-Ваальса обеспечивается:
1. Ориентация: полярные молекулы располагаются таким образом относительно друг друга, что больше не возникает вращения.
18

2.Индукция: молекулы поляризуются в электростатическом поле другой молекулы.
3.Дисперсия: флуктуация электронов в нейтральной молекуле является причиной временной асимметрии распределения заряда, следствием которой является притяжение между молекулами.
На рис. 1.9 приведено относительное распределение энергии связи супрамолекулярных взаимодействий.
Рис. 1.9. Энергия связи супрамолекулярных взаимодействий
В супрамолекулярной химии наибольшее значение имеют слабые химические взаимодействия, обеспечивающие достаточно прочные, но очень чутко реагирующие на изменения внешней среды связи. Именно поэтому ключевыми, наиболее распространенными взаимодействиями являются водородная связь и силы Ван- дер-Ваальса.
19

1.2. Основные разновидности молекул-хозяев
Одним из определений супрамолекулярной химии является ее определение как химии соединений «хозяин – гость». В таком контексте обычно рассматривают молекулу («хозяина»), связывающую другую молекулу («гостя»). Хозяином выступает большая молекула или агрегат с полостью, способной заключать в себя небольшую молекулу или ион. На рис. 1.10 приведены основные встречающиеся в литературе термины, описывающие взаимоотношения между хозяином и гостем.
Рис. 1.10. Основные встречающиеся в литературе термины, описывающие взаимоотношения между хозяином и гостем
Соединения-хозяева могут быть разделены на два главных класса в соответствии с топологической взаимосвязью между хозяином и гостем (рис. 1.11). Кавитандами называются молекулы-хозяева с внутримолекулярными полостями. Способность полости связывать молекулу-гостя в этом случае – неотъемлемое свойство хозяина и проявляется как в твердом состоянии, так и в растворе. Клат-
20
