
Физика металлов
..pdfДиполи разделяют на жесткие и наведенные. Под жесткими диполями понимают молекулы, которые имеют два электрических полюса как при отсутствии внешнего электрического поля, так под его воздействием. А наведенными диполями называют атомы или молекулы, которые приобретают электрическую полярность только во внешнем электрическом поле.
Вклад сил Ван-дер-Ваальса в энергию решетки u определяется выражением [16]:
|
u = 3=ν 0− |
3=ν 0α |
2 |
, |
|
4d 6 |
|
||
где = – |
приведенная постоянная Планка; |
|||
ν0 – |
частота колебаний двух атомов или молекул; |
|||
α– |
константа, связаннаясполяризуемостьюатомовимолекул; |
|||
d – |
расстояние между атомами. |
|
|
|
Первый член в этом уравнении представляет энергию изолированных атомов, а второй – характеризует энергию взаимодействия между соседними атомами в кристалле.
При образовании связей Ван-дер-Ваальса не происходит обмена электронами или их обобществления, структура этих кристаллов главным образом определяется геометрическими факторами. Связь Ван-дер-Ваальса является очень слабой, в 10–100 раз меньше ионной, а также короткодействующей силой, так как она резко убывает с увеличением расстояния.
Кристаллы, образованные силами Ван-дер-Ваальса, – хорошие изоляторы, так как все электроны прочно связаны, а электрические свойства слабо изменяются при переходе от твердого кжидкому илигазообразному состоянию.
Связь Ван-дер-Ваальса встречается во всех веществах, но играет важную роль лишь при образовании структур благородных (He, Ne, Ar) и двухатомных газов (H2, N2, O2) в твердом состоянии, поскольку она является единственной силой, задерживающей атомы или молекулы в кристалле.
21

Рис. 14. Схема кристалла графита [17]
Представленные типы связи в чистом виде встречаются довольно редко. В реальных веществах мы имеем дело с комбинацией разных связей между атомами, ионами или молекулами. Наиболее наглядным примером этого положения является кристалл графита (рис. 14), где каждый атом углерода связан ковалентными связями с тремя ближайшими соседями в одном слое. При этом происходит обобществление трех из четырех валентных электронов углерода. Четвертый валентный электрон коллективизируется для всего кристалла, что приводит к высокой электропроводности графита. Между слоями графита действует как металлическая связь, так и силы Ван-дер-Ваальса.
Вопросы по главе 1
1.Как исторически развивалось представление о строении материи?
2.Какиесуществуютэнергетическиехарактеристикиатомов?
3.В чем заключается правило октета?
4.Какова природа ионной связи?
5.Как определить координационное число у ковалентных кристаллов?
6.Каковы свойства кристаллов с металлической связью?
7.В каких веществах встречается связь Ван-дер-Ваальса?
22
2. СТРОЕНИЕ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ МЕТАЛЛИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СВОЙСТВА
ВЗАВИСИМОСТИ ОТ ПОЛОЖЕНИЯ
ВПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА
Для рассмотрения кристаллического строения металлов и их свойств удобно использовать развернутую периодическую систему Д.И. Менделеева (рис. 15). Эта таблица содержит длинные периоды, и благодаря этому в левой части располагаются элементы с типичными металлическими свойствами, а в правой – неметаллы.
Межмолекулярные или межатомные силы сцепления, связывающие между собой частицы в кристалле, очень трудно измерить экспериментально. Однако общую характеристику сил сцепления в кристалле можно получить при анализе данных по таким свойствам, как температура плавления, теплота сублимации, сжимаемость, коэффициент термического расширения и периоды решетки [16].
Большие силы сцепления, как правило, обнаруживаются в кристаллах с высокой температурой плавления и высокой теплотой сублимации, причем периодическая зависимость этих двух величин носит аналогичный характер, поэтому достаточно привести только периодическую зависимость для температуры плавления элементов (рис. 16).
Под температурой плавления понимают температуру, при которой происходит разрушение кристаллической решетки твердого тела во время нагрева и смена агрегатного состояния на жидкое. Теплотой сублимации является количество энергии, необходимое на перевод электрически нейтрального атома из твердого тела в газообразное состояние.
23

24

Рис. 16. Зависимость температуры плавления кристалла от номера подгруппы элемента [16]
Очевидно, что в рамках одного периода на зависимости температуры плавления от номера подгруппы наблюдается два максимума: один максимум в области металлов – подгруппа VIA – здесь такие металлы, как вольфрам, молибден, хром; вто-
25
рой максимум – в области неметаллов, а именно ковалентных кристаллов – подгруппа IVВ – в этой подгруппе находятся углерод (алмаз), кремний и германий.
Высокое значение сил межатомного сцепления наблюдается у элементов с низкими значениями сжимаемости
икоэффициента термического расширения. Сжимаемость твердого тела χ – это удельное уменьшение объема при увеличении гидростатического давления на единицу.
Коэффициент термического расширения твердого тела характеризует изменение размеров тела при изменении его температуры на 1 ° С, другими словами, выступает мерой возможности увеличения амплитуды тепловых колебаний при повышении температуры [16]. Низкий коэффициент термического расширения указывает на значительные силы сцепления между атомами.
Периодический закон изменения сжимаемости и коэффициента термического расширения твердого тела качественно совпадают, поэтому можно ограничиться рассмотрением зависимости сжимаемости элемента от номера подгруппы (рис. 17). Зависимости температуры плавления и сжимаемости от номера подгруппы элемента свидетельствуют о том, что вещества с высокой температурой плавления, как правило, обладают низкой сжимаемостью, и наоборот.
Электронное облако вокруг атома может менять размеры
иформу в зависимости от вида межатомного взаимодействия, в котором участвуют внешние электроны. Эта величина также может быть принята за величину прочности связи. Периодическая зависимость атомного радиуса элементов в кристалле от номера подгруппы качественно совпадет с зависимостью для сжимаемости.
26
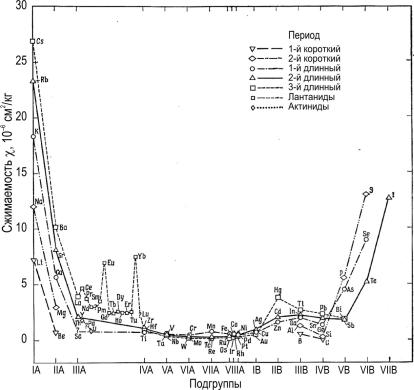
Рис. 17. Зависимость сжимаемости кристалла от номера подгруппы элемента [16]
Приведенные выше физические свойства, характеризующие силы сцепления между атомами или ионами в химических элементах, свидетельствуют о возрастании этих сил в коротких периодах от элементов подгруппы IA до максимальных значений подгруппы IVB, что связано с изменением вида связи от металлической к ковалентной. Последующее снижение при переходе к элементам других подгрупп B обусловлено тем, что возможное число ковалентных связей недостаточно для формирования пространственной кристаллической структуры, и свойства кристаллов в этом случае определяют силы Ван-дер-
27
Ваальса, которые в твердых телах элементов VB, VIB, VIIB и нулевой подгрупп соединяют слои, цепочки, двухатомные молекулы или отдельные атомы.
Уметаллов подгрупп IA и IIA наблюдается тенденция
кувеличению сил межатомного взаимодействия при увеличении атомного номера, что вызвано экранированием валентных электронов нарастающим числом заполненных внутренних электронных оболочек.
ЭлементыподгруппIIВ иIIIВобладают более выраженными металлическими свойствами посравнению сэлементами IB.
Уэлементов подгруппы VIB снижение температуры плавления и рост сжимаемости при увеличении атомного радиуса (в ряду алмаз – кремний – германий – серое олово) является следствием уменьшения доли ковалентной связи и увеличения металлической. Однако, в противоположность сказанному, в подгруппах VB–VIIB наблюдается нарастание металлической связи с увеличением атомного номера, что приводит к увеличению прочности. Такая картина наблюдается из-за усиления связи Ван-дер-Ваальса и металлической, которые удерживают совокупность слоев, цепочек или двухатомных молекул при образовании трехмерной структуры, при этом наиболее слабая связь становится прочнее. В подгруппах IB–VIIB сжимаемость и атомные радиусы значительно увеличиваются, поскольку уменьшается роль d-орбиталей в образовании связи [16].
Аллотропия
При нагреве или охлаждении у ряда металлических элементов можно наблюдать переход от одной кристаллической структуры к другой. Такое явление называется аллотропией. При наличии двух аллотропных модификаций у элементов при высоких температурах, как правило, наиболее устойчивой является ОЦК-решетка, а при низких температурах – компактные решетки ГЦК или ГК.
28
Исключение составляет железо, которое имеет две температуры полиморфного превращения: 911 и 1392 ° С:
911 °C |
-Fe (ГЦК↔ |
1392 °C |
-Fe (ОЦК). Ниже 911 ° С железо |
α -Fe (ОЦК)↔ γ |
)δ |
существует в форме Feα. При постоянной температуре 911 ° С α-Fe, обладающее объемно-центрированной кубической решеткой, превращается в γ-Fe с гранецентрированной решеткой, кото-
рая при нагреве до 1392 ° С вновь |
переходит в состояние |
с объемно-центрированной решеткой – |
δ-Fe. |
Переход из одной кристаллической модификации в другую |
|
при аллотропии обусловливает изменение физических и механических свойств металла. Полиморфные модификации имеют такие элементы, как железо, олово, кобальт, марганец, теллур, титан, цирконий, уран и другие металлы.
Аллотропные модификации наблюдаются у металлов, у которых энергия электронов ns, np, (n–1) d, (n–2) f близки, т.е. для металлов группы IIА, переходных металлов, элементов с начала лантанидного и актинидного рядов [16].
Для оценки относительной стабильности двух возможных структур при данной температуре (Т, ºС) необходимо сравнить их свободные энергии F, которые можно получить из следующего выражения (рис. 18) [16]:
|
T |
T |
CP |
|
|
F = E0 − ∫dT |
∫ |
dT , |
|
|
|
|||
|
0 |
0 |
T |
|
|
|
|
||
где E0 – |
внутренняя энергия при 0 К; |
|
|
|
CP – |
теплоемкость при постоянном давлении соответст- |
|||
вующей аллотропической модификации. |
||||
При повышении температуры у вещества изменяется уро- |
||||
вень свободной энергии, что определяется его теплоемкостью. При высоких температурах у аллотропической модификации с низкой теплоемкостью уровень свободной энергии будет более высокий (Fα), а у модификации с большей теплоемкостью – более низкий (Fβ), следовательно, такая модификация будет более
29
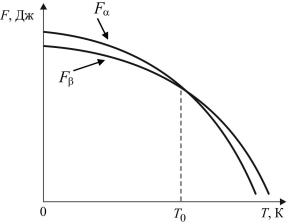
Рис. 18. Зависимость свободной энергии двух аллотропных модификаций от температуры
стабильной (см. рис. 18). Существует температура, при которой уровень свободной энергии F двух аллотропических модификаций одинаковый – такая температура Т0 называется температурой фазового равновесия, а фазовый переход развивается выше или ниже этой температуры.
Вопросы по главе 2
1.При анализе каких характеристик кристалла можно оценить силу межатомного сцепления?
2.Какую зависимость имеет величина температуры плавления и сжимаемости от положения элемента в периоде системы Д.И. Менделеева?
3.Чтотакоеаллотропияиукакихэлементовонавстречается?
30
