
Микробиология и основы биотехнологии
..pdf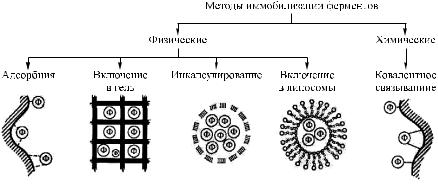
В настоящее время создано огромное количество разнообразных носителей для иммобилизации ферментов. Однако в конкретном технологическом процессе для каждого индивидуального фермента необходимо подбирать оптимальные варианты как носителя, так и условий и способов иммобилизации.
Методы иммобилизации ферментов. Существуют два принципиально различных метода иммобилизации ферментов: без возникновения ковалентных связей между ферментом и носителем (физические методы иммобилизации) и с образованием ковалентной связи между ними (хими- ческие методы иммобилизации). Каждый из этих методов осуществляется различными способами. Методы иммобилизации ферментов представлены на рис. 7.3 [19].
Рис. 7.3. Методы иммобилизации ферментов
Физические методы реализуются посредством адсорбции фермента на нерастворимом носителе, путем включения энзимов в поры поперечносшитого геля, в полунепроницаемые структуры или двухфазные системы.
При адсорбции ферментов на нерастворимых носителях белковая молекула удерживается на поверхности носителя в результате электростатических, гидрофобных, дисперсионных взаимодействий и водородных связей. Метод адсорбции не потерял своего значения и широко используется в настоящее время для получения иммобилизованных ферментов в промышленности. В качестве носителей используются главным образом кремнезем, активированный уголь, графитовая сажа,
121
различные глины, пористое стекло, полисахариды, синтетические полимеры, оксиды алюминия, титана и других металлов.
Эффективность адсорбции молекулы белка на носителе определяется удельной поверхностью (плотностью центров сорбции) и пористостью носителя. Процесс отличается крайней простотой и достигается при контакте водного раствора фермента с носителем (статическим способом с использованием колонок). С этой целью раствор фермента смешивают со свежим осадком (например, гидроокиси титана) и высушивают в мягких условиях. При таком варианте иммобилизации активность фермента сохраняется практически на 100 %, а удельная концентрация белка достигает 64 мг на 1 г носителя.
Êнедостаткам метода относятся невысокая прочность фермента
ñносителем, десорбция фермента при изменении условий иммобилизации, его потеря и загрязнение продуктов реакции.
Повысить прочность связывания фермента с носителем позволяет его обработка ионами металлов, полимерами, белками, гидрофобными соединениями, монослоем липидов и др. Иногда модификация ферментов приводит к снижению его активности.
Способ иммобилизации фермента путем его включения в трехмерную структуру полимерного геля (полиакриламид, силикагель) широко распространен благодаря своей простоте и уникальности. Метод применяется для иммобилизации не только индивидуальных ферментов, но и мультиэнзимных комплексов и даже интактных клеток. Иммобилизация осуществляется двумя способами.
По первому способу фермент вводится в водный раствор мономера, после чего проводится полимеризация, в результате которой возникает пространственная структура полимерного геля с включенными в его ячейки молекулами фермента.
По второму способу фермент вводят в раствор уже готового полимера (геля крахмала, агар-агара, каррагината, агарозы, фосфата кальция), который впоследствии переводят в гелеобразное состояние.
Иммобилизация ферментов в гелях обеспечивает равномерное распределение энзима в объеме носителя. Гелевые матрицы обладают высокой механической, химической, тепловой и биологической стойкостью
и обеспечивают многократное использование фермента, включенного в его структуру. Метод непригоден для иммобилизации ферментов, действующих на водонерастворимые субстраты.
122
Иммобилизация ферментов в полупроницаемые структуры. Сущность этого способа заключается в отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов и кофакторов, но задерживающей большие молекулы энзима. Разработано несколько модификаций этого метода, из которых интерес представляет микрокапсулирование и включение ферментов в липосомы.
Первый способ состоит в том, что водный раствор фермента включа- ется внутрь замкнутой микрокапсулы, стенки которой образованы полупроницаемым полимером. Достоинства метода микрокапсулирования — простота, универсальность, возможность многократного использования нативного фермента. Недостатком метода является невозможность инкапсулированных ферментов осуществлять превращения высокомолекулярных субстратов.
Ферменты, иммобилизованные путем включения в структуру липосом, используют преимущественно в медицинских и научных целях, т. к. значительная часть ферментов в клетке локализована в составе липидного матрикса биологических мембран. Изучение липосом имеет большое значение для понимания закономерностей процессов жизнедеятельности в клетке.
Химические методы иммобилизации ферментов. Иммобилизация происходит путем образования ковалентных связей между ферментом и носителем — это наиболее массовый способ получения промышленных биокатализаторов.
В отличие от физических методов этот способ иммобилизации обеспечивает прочную и необратимую связь энзима с носителем и сопровождается стабилизацией молекулы фермента.
Количество методических приемов, разработанных для осуществления ковалентной иммобилизации ферментов, исключительно велико. Все методы химической иммобилизации классифицируют в зависимости от природы реакционной группы носителя, вступающей во взаимодействие с молекулой фермента. К способам химической иммобилизации ферментов относят: иммобилизацию ферментов на носителях, обладающих гидроксогруппами (полисахаридный носитель); иммобилизацию ферментов на носителях, обладающих аминогруппами; иммобилизацию на носителях, обладающих активированными производными карбоксильной группы; иммобилизацию на носителях, обладающих сульфгидрильными группами.
123
Методы ковалентной иммобилизации ферментов малодоступны для промышленного использования в связи со сложностью и дороговизной их применения. Однако они остаются неизменным инструментом в практике проведения научных и лабораторных исследований по созданию энзимов с контролируемыми свойствами.
7.8. Иммобилизация клеток
Методы иммобилизации универсальны для всех видов иммобилизованных биокатализаторов — индивидуальных ферментов, клеток, субклеточных структур, комбинированных препаратов.
Âпоследнее время все большее внимание уделяется методам иммобилизации клеток и субклеточных структур, т. к. отпадает необходимость выделения и очистки ферментных препаратов, применения кофакторов; создается возможность получения полиферментных систем, осуществляющих многостадийные непрерывно действующие процессы.
Âпромышленных процессах чаще используются покоящиеся клетки. Многие хозяйственно ценные продукты синтезируются главным образом в стационарной фазе развития клеточных культур. Растущие клетки нарушают структуру носителя, дочерние клетки, образующиеся при делении, загрязняют целевой продукт. Для подавления роста иммобилизованных клеток растений используют дефицит фитогормонов, а рост бактериальных клеток ограничивают добавлением антибиотиков.
Иммобилизованные клетки микроорганизмов применяют для биотрансформации органических соединений, разделения рацемических смесей, гидролиза сложных эфиров, инверсии сахарозы, восстановления
èгидроксилирования стероидов. На основе иммобилизованных клеток дрожжей разрабатывается технология c целью получения этанола из мелассы, в котором дрожжи сохраняли бы способность к спиртовому брожению в течение 1800 ч [20].
Иммобилизованные ферментные системы функционируют в биореакторе в виде неподвижной фазы, через которую протекает среда с субстратом, подлежащим биохимическому превращению (гетерогенный катализ). В таких реакторах наряду с непрерывным режимом используется
èпериодический. Для эффективного перемешивания и газообмена биореактор снабжают мешалкой. Во внутреннем объеме трубчатых реакторов рыхло расположены полые волокна, заполненные биокатализатором. Степень превращения субстрата в продукт в таких реакторах достигает 90 %.
124
7.9. Применение иммобилизованных ферментов
Сочетание уникальных каталитических свойств энзимов с преимуществами иммобилизованных ферментов как гетерогенных катализаторов позволило создать новые промышленные технологические процессы. Все они относятся к производству пищевых продуктов и лекарственных препаратов. Список ряда биотехнологических процессов с применением иммобилизованных биокатализаторов, разработанных на уровне промышленных и опытных установок, представлен в табл. 7.3 [19].
Ферментативная конверсия целлюлозы в глюкозу
Âсвязи со значительным потреблением углеводородного сырья
èего исчерпаемостью насущной проблемой для дальнейшего развития биотехнологии является освоение новых сырьевых источников.
К таким неисчерпаемым и одновременно возобновляемым источ- никам сырья относится растительная биомасса (многолетние растения, вторичные продукты и отходы их промышленной и сельскохозяйственной переработки).
|
|
Ò à á ë è ö à 7 . 3 |
|
Применение иммобилизованных ферментов |
|
||
|
|
|
|
Название и шифр |
Источник фермента, способ иммобилизации |
Биотехнологический |
|
фермента |
процесс |
|
|
|
|
||
Ацилнейтраминат-9- |
Фермент E. coli. |
Синтез сиаловых кислот |
|
фосфат-синтаза |
Включение в полиакриламидный гель |
|
|
(ÊÔ 4.1.3.20) |
|
|
|
-Галактозидаза |
Фермент Kluyveromyces fragilis, |
Гидролиз лактозы; полу- |
|
(ÊÔ 3.2.1.23) |
K. lactis, Aspergillus niger, A. oryzae. |
чение безлактозного мо- |
|
|
Включение в нити ацетата целлюлозы, |
лока, глюкозы и галакто- |
|
|
полиакриламидного геля; адсорбция на |
çû |
|
|
фенолформальдегидной смоле, моди- |
|
|
|
фицированных керамике и кремнеземе |
|
|
Глюкоамилаза |
Фермент Aspergillus niger. Хелатирова- |
Превращение |
олигоса- |
(ÊÔ 3.2.1.33) |
ние целлюлозой, стеклом, нейлоном; |
харидов в глюкозу |
|
|
ковалентное связывание с клетками |
|
|
|
B. subtilis, E. coli |
|
|
5-3-Кетостероид- |
Клетки Mycobacterium globiformis. |
Трансформация |
гидро- |
дегидрогеназа |
Включение в полиакриламидный гель |
кортизона в преднизо- |
|
|
|
ëîí |
|
125
Î ê î í ÷ à í è å ò à á ë . 7 . 3
Название и шифр |
Источник фермента, способ иммобилизации |
Биотехнологический |
||
фермента |
процесс |
|||
|
||||
Протеазы |
Фермент B. subtilis, B. licheniformis, |
Получение белковых |
||
(ÊÔ 3.4) |
B. thermoproteolyticus, Mucor pusillus. |
гидролизатов |
||
|
Включение в полиакриламидный гель, |
|
|
|
|
силикагель; хелатирование на поверх- |
|
|
|
|
ности стекла, микроорганизмов |
|
|
|
Пероксидаза |
Фермент из хрена, сополимеризован- |
Окисление фенола |
||
(ÊÔ 1.11.1.7) |
ный с тирозином. Включение в гель |
в сточных водах |
||
|
альгината |
|
|
|
Пулуназа |
Клетки Aureobacidium pullulan, |
Расщепление -1,6-гли- |
||
(ÊÔ 3.2.1.9) |
Arthrobacter. |
козидных связей в ами- |
||
|
Ковалентное связывание с биогелем |
лопектине. |
Получение |
|
|
|
декстринов |
|
|
Термолизин |
Клетки Bacillus thermoproteolyticus/ |
Реакция |
конденсации |
|
(ÊÔ 3.4.24.4) |
Включение в полиуретан |
L-аспарагиновой кисло- |
||
|
|
ты и метилового эфира |
||
|
|
L-фенилаланина с обра- |
||
|
|
зованием аспаркама |
||
Тирозинфноллиаза |
Клетки Erwinia herbicola, E. intermedia. |
Синтез тирозина из |
||
(ÊÔ 4.1.99.2) |
Включение в полиакриламидный гель |
ÏÂÊ, NH3 и фенола; се- |
||
|
|
рина и фенола. Синтез |
||
|
|
ÄÎÔÀ èç ÏÂÊ, NH3 |
||
|
|
и пирокатехина |
||
Триптофаназа |
Клетки E. coli. Включение в нити три- |
Получение |
триптофана |
|
(ÊÔ 4.1.99.1) |
ацетата целлюлозы и гель каррагинана |
из L-серина и индола |
||
Основным компонентом растительной биомассы является целлюлоза (клетчатка). Ежегодно в биосфере создается около 100 млрд т целлюлозы.
Благодаря плотной структуре линейно построенных полигликозидных цепей целлюлоза устойчива к действию большинства растворителей и химических агентов, в том числе сильных кислот. В природе гидролиз клетчатки до глюкозы осуществляется с помощью микроорганизмов (бактерии, плесневые грибы) и некоторых видов насекомых, содержащих полиферментативные комплексы целлюлаз. Целлюлитический комплекс ферментов включает эндо-1,4 -глюконазу, экзоцеллобиогидролазы, целлобиазы, экзо-1,4 -глюкогидролазу, механизм действия которых
126
на клетчатку оказался одинаковым для всех целлюлазных комплексов независимо от их происхождения. Попадая на целлюлозосодержащие материалы, микроорганизмы выделяют целлюлазы, которые, сорбируясь (иммобилизируясь) на субстрате, постепенно расщепляют его до глюкозы.
В последние годы разработаны технологические схемы для непрерывного ферментативного гидролиза целлюлозы на уровне опытных установок. Процесс протекает в противоточных реакторах колонного типа, плотно заполненных целлюлозой. Расчеты показывают, что перевод процесса на промышленный уровень обеспечивает получение 24 т глюкозы в сутки. Дальнейшее совершенствование эффективности метода конверсии целлюлозосодержащего сырья в глюкозу и далее в этанол и углеводороды позволит создать альтернативные пути получения ценных моносахаридов и жидкого топлива из возобновляемого сырья и решить важную проблему — утилизацию экологически опасных отходов производства.
Вопросы для самоконтроля
1.Перечислите основные этапы и операции аэробного микробиологического процесса.
2.Какие факторы необходимо учитывать при подборе среды для микрофлоры?
3.Назовите элементный органический и минеральный состав питательной среды для микроорганизмов.
4.Какие органические вещества используются хемосинтетиками в качестве источников углерода и энергии?
5.Назовите промышленные источники азота для микроорганизмов, продуцирующих протеолитические ферменты.
6.С какой целью в биотехнологическом производстве применяются полупродукты и предшественники?
7.Какие асептические требования предъявляются при ведении аэробного микробиологического процесса?
8.Охарактеризуйте стадии подготовки и получения посевного материала.
9. Объясните различия в терминах «генетическая инженерия» и «генная инженерия». Что является предметом их изучения?
127
10.Приведите примеры практического применения генной инженерии?
11.Дайте определение иммобилизованным ферментам и клеткам.
12.Перечислите основные методы иммобилизации и носители, применяемые для иммобилизации ферментов и клеток.
Глава 8 БИОХИМИЧЕСКИЕ ПРОИЗВОДСТВА
В качестве иллюстрации общих технологических принципов ферментативных процессов могут служить такие производства, как пивоварение, виноделие, дрожжевое производство.
8.1. Производство пива
Сырьем для производства пива является ячмень. Процесс производства пива включает несколько стадий.
Первая стадия — соложение. Ячмень замачивают и инкубируют в те- чение 2–6 суток до прорастания зерен. На этой стадии образуются - и -амилазы, а также протеолитические ферменты (разлагающие белки).
Вторая стадия — высушивание зерна. Она заключается в тщательном высушивании при температуре 110–140 °С, после которой солод приобретает темный цвет.
Третья стадия — затирание солода (проросшее и высушенное зерно ячменя размалывают). На этой стадии готовится пивное сусло, которое является питательной средой для дрожжевых клеток. Процессы нагревания смеси солода, крахмала и воды тщательно контролируют. Успех процесса гидролиза зависит от множества превращений в сложной смеси субстратов и ферментов. В смеси солод — крахмал белки и углеводы должны быть гидролизованы до простых сахаров и аминокислот, т. к. штаммы дрожжей, используемые в производстве пива, способны утилизировать в качестве питательных веществ только простые сахара и аминокислоты. В этой операции полный гидролиз нежелателен, т. к. декстрины и пептоны придают пиву специфический вкус и консистенцию. Гидролитические ферменты осложняют процесс.
С целью оптимизации сложного процесса гидролиза используют тщательно подобранные методики, включающие изменение температуры от 40 до 100 °С по определенной программе. Полученный таким спо-
129
собом продукт (сусло) содержит смесь вкусовых веществ и питательных веществ для дрожжевых клеток.
Четвертая стадия — осветление сусла и его кипячение с периоди- ческим добавлением хмеля. Осветленное сусло подвергают стерилизации кипячением в течение двух часов. Хмель придает пиву специфический вкус, аромат, окраску и одновременно оказывает антибактериологиче- ское действие. Простерилизованное сусло охлаждают и инокулируют соответствующим штаммом дрожжей (Saccharamóces cerevisia).
Дрожжи культивируют вначале в аэробных условиях, а затем — в анаэробных, обеспечивающих в процессе брожения образование этанола и диоксида углерода.
Конечные стадии — полученное пиво осветляют, пастеризуют и расфасовывают.
8.2. Производство вина
Сырьем для производства вина могут служить практически любые спелые фрукты или растительные экстракты, содержащие от 12 до 30 г сахара в соке. Процесс ферментации проводят с участием дикого штамма дрожжей, содержащихся в кожуре винограда или фруктов или путем внесения определенной культуры дрожжей в пастеризованные фруктовые соки.
Во многих анаэробных процессах брожения культуру дрожжей вна- чале выращивают в соке до необходимой плотности в аэробных условиях, в которых кроме биомассы образуется диоксид углерода. Последующая ферментация проводится в анаэробном режиме. Процесс ферментации в этих условиях приводит к получению 7–15 % раствора этанола и выделению дополнительного количества диоксида углерода.
Некоторые органические кислоты, образующиеся в процессе брожения, разрушаются бактериями, что придает винам характерный вкус
èаромат («букет»). Тип полученного вина зависит:
–îò сырья — различных сортов винограда, абрикосов, персиков и т. д.;
–штаммов дрожжей и бактерий, участвующих в процессе броже-
íèÿ;
–послеферментационной обработки — крепления вина, т. е. добавления спирта;
–операций, предшествующих розливу,— механических воздействий (прессование, фильтрование, перегонка, нагревание, охлаждение);
130
