
Параметры термодинамического сродства бинарных систем полимер – растворитель (90
..pdfФедеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования
«Казанский государственный технологический университет»
ПАРАМЕТРЫ ТЕРМОДИНАМИЧЕСКОГО СРОДСТВА БИНАРНЫХ СИСТЕМ ПОЛИМЕР – РАСТВОРИТЕЛЬ
Методические указания к лабораторным работам
Казань
КГТУ
2 0 0 5
Составители: проф. А.М.Кочнев доц. К.Г.Четвериков ассист. Д.Д.Исхакова
Параметры термодинамического сродства бинарных систем полимер – растворитель: Метод. указания/ Казан. гос.
технол. ун-т; Сост.: А.М. Кочнев и др. Казань, 2005, 27 с.
Содержат сведения об основных понятиях и параметрах, используемых при описании термодинамики растворов полимеров.
Предназначены для студентов и магистров, обучающихся по специальности «Химическая технология высокомоле- кулярных соединений», а также может быть полезна для аспирантов и научных работников.
Печатается по решению методической комиссии института полимеров.
Рецензенты: канд. хим. наук, проф. А.М.Ярошевская канд. хим. наук, доц. О.А.Исхаков
Параметры термодинамического сродства бинарных систем полимер – растворитель
Процессы взаимодействия полимеров с низкомолекулярными жидкостями имеют большое значение при синтезе полимеров, их переработке в изделия и в условиях эксплуатации этих изделий в различных жидких средах. При взаимодействии полимера с низкомолекулярными жидкостями могут образовываться истинные растворы, коллоидные системы и студни. Одной из основных задач при получении истинных растворов полимеров является оценка сродства между исходными компонентами, возможность предсказания получения гомогенных, термодинамически устойчивых систем «полимер - низкомолекулярная жидкость».
В прикладном смысле знание закономерностей растворимости полимеров и их взаимодействия с низкомолекулярными жидкостями имеет большое значение в технологии формирования волокон и пленочных материалов, производстве и применении лаков, эмалей и покрытий на их основе, в производстве клеев и различного рода пластифицированных полимерных материалов, включая пластикаты, пластизоли, органозоли. пластигели и др. Немаловажным является и тот факт, что растворение полимеров является единственным способом разделения их до молекулярного уровня. Это открывает возможности определения и изучения многих молекулярных параметров полимеров - средних молекулярных масс, молекулярно- массового распределения (ММР), среднеквадратичного расстояния между концами цепи, неоднородности по составу и т.п.
Особенность растворения полимера состоит в том, что смешиваются компоненты, размеры молекул которых различаются в тысячи раз; отсюда и разная подвижность
3
молекул. Подвижность молекул низкомолекулярной жидкости очень велика. При соприкосновении полимера с низкомолекулярной жидкостью ее молекулы начинают быстро проникать в фазу полимера, а огромные макромолекулы за это время не успевают перейти в фазу растворителя: прежде чем раствориться, высокомолекулярный полимер набухает. Растворение полимера - медленный процесс, который происходит в две стадии. Сначала молекулы растворителя, медленно диффундируют в полимер, образуя набухающий гель. Это обусловлено тем, что силы межмолекулярного взаимодействия достаточно велики. Но если эти силы преодолеваются более сильным взаимодействием с растворителем, наступает вторая стадия - растворение. В этом случае гель постепенно переходит в состояние истинного раствора.
Истинные растворы, характеризуются следующими признаками:
-наличие сродства между компонентами, -самопроизвольное образование, -молекулярная или ионная дисперсность, -термодинамическая устойчивость, -увеличение степени дисперсности во времени, -агрегативная устойчивость, -однофазность, -отсутствие поверхностей раздела, -обратимость.
Самопроизвольно образующиеся истинные растворы полимеров обладают всеми перечисленными выше признаками истинных растворов. Но вследствие огромной разницы в размерах молекул полимера и растворителя истинные растворы полимеров имеют свои специфические особенности, к которым относятся явление набухания и высокая вязкость даже разбавленных растворов.
4
На способность полимеров образовывать гомогенные, термодинамически устойчивые системы влияют следующие факторы:
•природа полимера и растворителя - (не)полярные полимеры растворяются в (не)полярных растворителях;
•гибкость цепи полимера - гибкая цепь легче отделяется oт соседней цепи под воздействием теплового движения звеньев
идиффундирует в растворитель последовательным перемещением звеньев;
•молекулярная масса полимера - чем больше молекулярная масса полимера, тем больше энергия взаимодействия между цепями;
•химический состав полимеров (композиционная неоднородность по составу) - такие полимеры обладают различной растворимостью, так как их цепи содержат разные количества функциональных групп;
•фазовая структура полимера - наличие кристалл- лической формы обусловливает больший уровень межмолекулярного взаимодействия, и поэтому при комнатных температурах такие полимеры, как правило, не растворяются даже в жидкостях, близких им по полярности;
•температура - для большинства полимеров растворимость с повышением температуры увеличивается; однако известны и системы с нижней критической температурой смешения;
•мостичные химические связи - наличие даже небольшого количества мостичных (поперечных) химических связей между цепями препятствует отделению цепей друг от друга и переходу их в раствор.
По величине термодинамического сродства к полимерам растворители делят на термодинамически хорошие и термодинамически плохие. Термодинамически хорошими называют растворители, смешение которых с полимерами
5
сопровождается большими изменениями химических потенциалов компонентов и свободной энергии всей системы. В хороших растворителях контакты между звеньями цепей полимера и молекулами растворителя энергетически более выгодны, чем контакты между собой полимерных звеньев и молекул растворителя. Термодинамически плохими считают растворители, при взаимодействии которых с высокомолекулярными соединениями наблюдаются небольшие изменения химических потенциалов компонентов и свободной энергии системы. В плохих растворителях предпочтительнее взаимодействие между звеньями макромолекул.
При оценке степени термодинамического сродства полимера и растворителя принято пользоваться следующими параметрами.
Свободная энергия Гиббса. Процессы, происходящие при постоянных давлении и температуре (а растворение обычно происходит при этих условиях), идут самопроизвольно в направлении уменьшения свободной энергии Гиббса G, т. е. конечное состояние системы должно характеризоваться меньшими значениями этого параметра, чем начальное. Следовательно, раствор должен обладать меньшей свободной энергией, чем сумма свободных энергий компонентов:
Gp-pa<ΣG0ini,
где G0i – свободная энергия 1 моля и ni – число молей i-го компонента.
Разность между этими величинами называется свободной энергией смешения
GM=Gp-pa - ΣG0ini,
и при самопроизвольном растворении она должна быть отрицательной ( GM<0).
Химический потенциал. Мерой направленности процесса служит также изменение парциальной мольной свободной энергии каждого i-го компонента Gi или его химического
6

потенциала μi, равного приращению свободной энергии раствора данной концентрации при добавлении к нему бесконечно малого количества i-го компонента при постоянных давлении Р, температуре Т и постоянном числе молей всех остальных компонентов nj
|
∂G |
|
|
|
μi ≡ Gi= |
|
|
|
|
|
|
∂ni |
|
|
|
P,T ,n j |
|||
|
|
|
||
Химический потенциал компонента в растворе μi должен
быть меньше его химического потенциала до растворения μi0
μi, < μi0
и, следовательно, разность этих величин должна быть отрицательна (Δμi< 0).
Процесс идет в направлении соединения компонентов только в том случае, если между ними имеется сродство. Поэтому критерии сродства и направленности одни и те же ( G < 0; Δμi< 0), чем больше абсолютное значение этих разностей, тем больше термодинамическое сродство между компонентами, тем полнее идет процесс их взаимодействия.
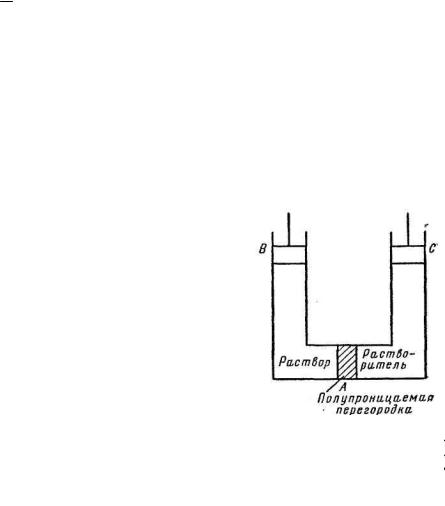
Осмотическое давление растворов полимеров. Осмосом
называется явление проникновения растворителя в раствор через полупроницаемую перегородку (мембрану), которая проницаема для молекул растворителя и непроницаема для молекул растворенного вещества, в частности для больших молекул полимеров.
Стремление молекул растворителя к самопроизвольному проникновению в раствор, вызванное неравенством μi < μi0, количественно оценивается величиной осмотического давления
(π), которое непосредственно связано с величиной Δμi:
μi, - μi0 ≡ Δμi = -Vi π,
где Vi - парциальный объем полимера.
Осмотическое давление раствора равно добавочному давлению, которое необходимо приложить к раствору для того,
7
чтобы химический потенциал компонента в растворе стал равным химическому потенциалу чистого растворителя:
π= Р - Р0.
Сучетом сжимаемости реальных растворов, учитывая
изменение парциального объема растворителя с давлением:
|
Vi0 |
Δμi = π Vi0 (1+βТ π/2), |
где |
– парциальный объем растворителя при Р=0 (или |
|
Р = |
0,1 |
МПа), βТ – коэффициент термической сжимаемости |
растворителя в растворе, обычно принимаемый равным βТ чистого растворителя.
Таким образом, осмотическое давление – это термодинамическое сродство между компонентами, отнесенное к единице объема растворителя. Оно имеет размерность давления, но по своей природе не имеет ничего общего с газовым давлением, являющимся результатом ударов молекул о стенки сосуда. Чем больше осмотическое давление, тем больше абсолютное значение Δμi, тем
больше термодинамическое сродство между компонентами, тем более хороший раство- ритель.
Осмотическое давление растворов полимеров опреде- ляют прибором, называемым осмометром (рис.1). Это прибор, в котором осмотическая ячейка с раствором отделена полупро- ницаемой перегородкой от чистого растворителя и соединена с узким капилляром. По мере проникновения растворителя внутрь ячейки раствор поднимается по
8
капилляру до тех пор, пока осмотическое давление не уравновесится весом гидростатического столба в капилляре. Чем больше концентрация раствора, тем больше проникает растворителя, тем больше осмотическое давление. Однако с увеличением концентрации полимера значительно повышается вязкость раствора, вследствие чего затрудняется подъем раствора по капилляру осмометра. Поэтому обычно ограничиваются определением осмотического давления очень разбавленных растворов (концентрацией <1 г/100 см3).
Давление набухания. При больших концентрациях полимера образуется, по существу, раствор низкомолекулярного компонента в полимере, или набухший полимер. Набухание полимера можно осуществить в условиях, в которых его объем не увеличивается (ограничить образец со всех сторон жесткими стенками и оставить отверстие для проникновения растворителя). При этом набухающий образец будет оказывать на ограничивающие его стенки давление, называемое давлением набухания.
Природа давления набухания и осмотического давления одна и та же. И то, и другое – результат взаимодействия низкомолекулярного компонента с полимером. При ограниченном набухании или на первой стадии неограниченного набухания полимер одновременно играет роль полупроницаемой перегородки и осмотической ячейки, внутри которой находится раствор. Молекулы низкомолекулярного компонента проникают в этот раствор вследствие того, что μi, < μi0; молекулы полимера не могут перейти из раствора в растворитель. В разбавленных растворах измеряют осмотическое давление, в более концентрированных растворах –
давление набухания πнаб.
= π0Сk,
где С- концентрация полимера, π0 и k - эмпирические константы.
Давление набухания связано с величиной Δμi теми же
9
уравнениями, что и осмотическое давление, по которым, зная πнаб, можно рассчитать термодинамическое сродство компонентов.
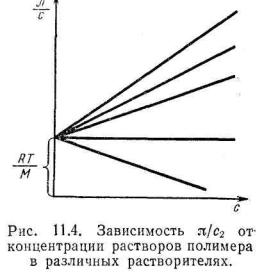
Второй вириальный коэффициент. Важным параметром,
оценивающим качество растворителя, является второй вириальный коэффициент. Он связан с осмотическим давлением раствора и величиной Δμi. Концентрационная зависимость осмотического давления выражается уравнением:
|
|
π = RT (A1 c + A2 c2 + A3 c3 + …) , |
|
|
||||
где с - концентрация полимера в растворе; A1, A2, A3 и т.д. - так |
|
|||||||
называемые вириальные коэффициенты, значения которых |
|
|||||||
можно вычислить по экспериментальной зависимости π/с= f(c). |
|
|||||||
Для малых значений с можно ограничиться двумя первыми |
|
|||||||
членами уравнения. Первый вириальный коэффициент А1 |
|
|||||||
непосредственно связан с молекулярной массой полимера (М2) |
|
|||||||
соотношением: А1 = 1/М2. Поэтому можно записать: |
|
|
||||||
|
|
π/с= RТ (1/M2 + A2c). |
|
|
||||
Для растворов одной |
|
|
|
|
||||
фракции |
полимера |
в |
|
|
|
|
||
различных |
растворителях |
|
|
|
|
|||
зависимость π/с= f(c) |
|
|
|
|
||||
выражается серией вееро- |
|
|
|
|
||||
образных прямых (рис.2). |
|
|
|
|
||||
Отрезок, |
отсекаемый |
на |
|
|
|
|
||
оси ординат, равен RT/M2. |
|
|
|
|
||||
И не зависит от природы |
|
|
|
|
||||
растворителя. |
Второй |
|
|
|
|
|||
вириальный коэффициент |
|
|
|
|
||||
характеризует |
наклон |
|
|
|
|
|||
Рис.2 Зависимость π/с от концент- |
||||||||
прямых. Для эквиконцен- |
||||||||
трированных |
растворов |
рации |
растворов |
полимера |
в |
|||
он тем больше, чем |
различных растворителях |
|
||||||
больше π и |
абсолютное |
|
|
|
|
|||
|
|
|
|
|||||
10
