
- •1.Понятие об эквиваленте. Эквивалент сложного вещества. Изменение эквивалентов, при вступлении их в химические реакции. Закон эквивалентов.
- •2.Теоретические основы объемного анализа. Классификация объёмного анализа, по реакции, лежащей в их основе и по способу титрования. Расчёты, применяемые в объёмном анализе.
- •3.Кислотно-основной метод титрования. Индикаторы, применяемые в этом методе. Кривые титрования. Точка эквивалентности. Стандартные и рабочие растворы. Определение общей кислотности желудочного сока.
- •4.Перманганатометрия. Определение активности каталазы крови.
- •5.Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине с.
- •6. Окислительно-восстановительные реакции. Зависимость эквивалентного окислителя и восстановителя от реакции среды.
- •7.Типы окислительно-восстановительных реакций.
- •8.Агрентометрия. Методы Мора и Фольгарда
- •9.Термохимические уравнения и расчёты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •10. Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Влияние концентрации
- •Влияние температуры
- •Влияние давления
- •11.Химическая кинетка, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •12. Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •13. Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •14.Типы сложных химических реакций (параллельные, последовательные, сопряжённые, обратные, цепные).
- •15.Уравнение кинетики реакции первого порядка. Период полупревращения.
- •16.Уравнения кинетики реакций второго порядка.
- •17.Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •18. Энергия активации. Уравнение Аррениуса.
- •19. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Микрогетерогенный катализ.
- •20.Ферменты как биологические катализаторы и их классификация.
- •21. Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •22. Способы выражения концентрации растворов.
- •23. Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •24. Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •25. Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •26. Повышение температуры кипения растворов. Эбулиоскопическая постоянная.
- •27. Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •28.Теория кислот и оснований. Сильные и слабые электролиты, степень диссоциации.
- •29. Константа диссоциации. Закон разведения Освальда.
- •30. Электролиты в организме человека.
- •31. Протолитическая теория кислот и оснований.
- •32. Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •33. Гидролиз солей. Степень гидролиза.
- •34. Константа гидролиза солеи образованной сильным основанием и слабой кислотой (вывод уравнения).
- •35. Константа гидролиза соли образованной слабым основанием и сильной кислотой (вывод уравнения).
- •36. Константа гидролиза соли образованной слабым основанием и слабой кислотой (вывод уравнения).
- •37. Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •38. Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •39. Уравнения Гендерсона Гассельбаха для расчёта рН буферных систем (вывод).
- •40. Буферные системы крови.
- •41. Методы получения коллоидных растворов.
- •42. Методы очистки коллоидных растворов. Искусственная почка.
- •43. Строение коллоидных частиц. Строение мицеллы.
- •44. Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
- •47. Металлы и сплавы. Применение металлов и сплавов в стоматологии. Коррозия металлов.
- •45. Состав и свойства гипса. Применение в стоматологии.
- •46. Цементы. Их состав и свойства. Применение в стоматологии.
7.Типы окислительно-восстановительных реакций.
1. Межмолекулярные – изменяются С.О. атомов элементов, входящих в состав разных веществ:
![]()
2. Внутримолекулярные – окислитель и восстановитель - атомы одной молекулы:
tº
![]()
3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент повышает и понижает С.О.
![]() .
.
Cl2 - является окислителем и восстановителем.
8.Агрентометрия. Методы Мора и Фольгарда
АРГЕНТОМЕТРИЯ
титриметрич. метод определения анионов (Hal-, CN-, PO43-, CrO42- и др.), образующих малорастворимые соед. или устойчивые комплексы с ионами Ag+ Исследуемый р-р титруют стандартным р-ром AgNO3 или избыток последнего, введенный в анализируемый р-р, оттитровывают стандартным р-ром NaCl
Метод Мора. Прямая аргентометрия.
Только для Cl–, Br–; (не исп для I–).
Титрант – AgNO3, индикатор – K2CrO4, среда: pH=6–8.
NaBr + AgNO3 → AgBr↓ + NaNO3,
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3.
fэкв(NaBr)=1,![]() .
.
Недопустимо:
рН<6: CrO72– + 2H+ → Сr2O72– + H2O,
рН>8: 2Ag+ + 2OH– → Ag2O + H2O.
Присутствие ионов: SO42–, S2–, PO43–, AsO33–, BO33–, CO32–; Bi3+, Ba2+, Pb2+.
Метод Фольдгарда. Обратная аргентометрия.
Титранты – 1) AgNO3, 2) NH4SCN;
Индикаторы – NH4Fe(SO4)2 (Cl–, Br–), FeCl3 (I–);
Среда – HNO3 (pH=3).
К раствору навески препарата прибавляют HNO3, точный избыточный объемAgNO3 и индикатор:
KBr + AgNO3 → AgBr↓ + KNO3,
AgNO3 + NH4SCN → AgSCN↓ + NH4NO3;
В КТТ индикатор взаимодействует с титрантом:
3NH4SCN + NH4Fe(SO4)2 → Fe(SCN)3 + 2(NH4)2SO4.
fэкв(KI)=1, ![]() .
.
Преимущества пред другими методами:
1. Сильнокислая среда,
2. Не мешают другие ионы;
Недостатки:
1. Меньшая точность (обратный метод),
Особенности титрования хлоридов:
1. Низкая скорость титрования [Ks(AgCl)>Ks(AgCNS)],
2. Очень слабое перемешивание,
3. Добавление толуола или бензола для экстракции AgCl.
Особенности титрования йодидов:
После добавления нитрата серебра ждут полного осаждения AgI, второй индикатор добавляют перед самым титрованием:
2KI + 2FeCl3 → I2 + 2FeCl2 + 2KCl.
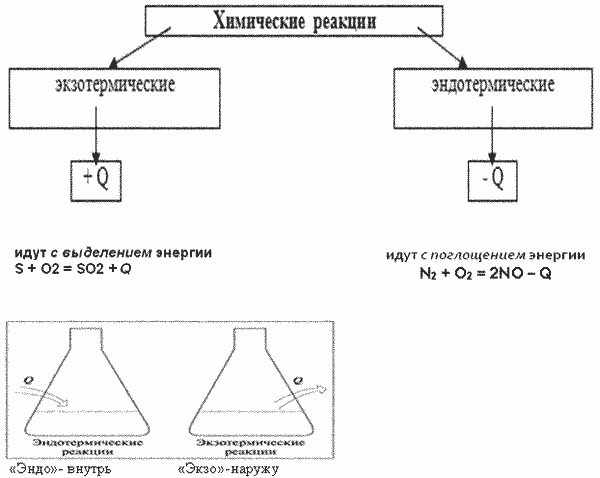
9.Термохимические уравнения и расчёты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
Термохимические уравнения – уравнения в которых указывается количество поглощенной или выделенной теплоты.
2HgO —> 2Hg + O2 – 180 кДж, С(тв) + O2(г) —> СO2(г) + 394 кДж
По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
В основе термохимических расчетов лежит закон Гесса. Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) не зависит от пути ее протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции.
ΔНх.р. = ∑ ΔНпрод обр - ∑ ΔНисх обр
Следствия из закона Гесса
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (так называемый закон Лавуазье – Лапласа).
2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое.
3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
Теплотой образования соединения называется тепловой эффект реакции образования одного моля соединения из соответствующих простых веществ, находящихся в той модификации и том агрегатном состоянии, которые устойчивы при данной температуре и давлении 1 атм.
Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
![]()
Теплотой сгорания соединения называется тепловой эффект реакции взаимодействия 1 моль химического соединения и кислорода с образованием высших стабильных оксидов (Н2О (жидк.), СО2 и т.д.) или других строго выбранных соединений (N2, SO2, HCl, HBr, HI и т.д.).
