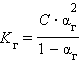- •1.Понятие об эквиваленте. Эквивалент сложного вещества. Изменение эквивалентов, при вступлении их в химические реакции. Закон эквивалентов.
- •2.Теоретические основы объемного анализа. Классификация объёмного анализа, по реакции, лежащей в их основе и по способу титрования. Расчёты, применяемые в объёмном анализе.
- •3.Кислотно-основной метод титрования. Индикаторы, применяемые в этом методе. Кривые титрования. Точка эквивалентности. Стандартные и рабочие растворы. Определение общей кислотности желудочного сока.
- •4.Перманганатометрия. Определение активности каталазы крови.
- •5.Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине с.
- •6. Окислительно-восстановительные реакции. Зависимость эквивалентного окислителя и восстановителя от реакции среды.
- •7.Типы окислительно-восстановительных реакций.
- •8.Агрентометрия. Методы Мора и Фольгарда
- •9.Термохимические уравнения и расчёты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •10. Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Влияние концентрации
- •Влияние температуры
- •Влияние давления
- •11.Химическая кинетка, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •12. Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •13. Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •14.Типы сложных химических реакций (параллельные, последовательные, сопряжённые, обратные, цепные).
- •15.Уравнение кинетики реакции первого порядка. Период полупревращения.
- •16.Уравнения кинетики реакций второго порядка.
- •17.Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •18. Энергия активации. Уравнение Аррениуса.
- •19. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Микрогетерогенный катализ.
- •20.Ферменты как биологические катализаторы и их классификация.
- •21. Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •22. Способы выражения концентрации растворов.
- •23. Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •24. Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •25. Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •26. Повышение температуры кипения растворов. Эбулиоскопическая постоянная.
- •27. Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •28.Теория кислот и оснований. Сильные и слабые электролиты, степень диссоциации.
- •29. Константа диссоциации. Закон разведения Освальда.
- •30. Электролиты в организме человека.
- •31. Протолитическая теория кислот и оснований.
- •32. Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •33. Гидролиз солей. Степень гидролиза.
- •34. Константа гидролиза солеи образованной сильным основанием и слабой кислотой (вывод уравнения).
- •35. Константа гидролиза соли образованной слабым основанием и сильной кислотой (вывод уравнения).
- •36. Константа гидролиза соли образованной слабым основанием и слабой кислотой (вывод уравнения).
- •37. Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •38. Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •39. Уравнения Гендерсона Гассельбаха для расчёта рН буферных систем (вывод).
- •40. Буферные системы крови.
- •41. Методы получения коллоидных растворов.
- •42. Методы очистки коллоидных растворов. Искусственная почка.
- •43. Строение коллоидных частиц. Строение мицеллы.
- •44. Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
- •47. Металлы и сплавы. Применение металлов и сплавов в стоматологии. Коррозия металлов.
- •45. Состав и свойства гипса. Применение в стоматологии.
- •46. Цементы. Их состав и свойства. Применение в стоматологии.
34. Константа гидролиза солеи образованной сильным основанием и слабой кислотой (вывод уравнения).
Константа гидролиза — константа равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
![]()
![]()
Уравнение константы равновесия для данной реакции будет иметь вид:
![]() или
или ![]()
Так
как концентрация молекул воды в растворе
постоянна, то произведение двух
постоянных ![]() можно
заменить одной новой — константой
гидролиза:
можно
заменить одной новой — константой
гидролиза:
![]()
Численное
значение константы гидролиза получим,
используя ионное произведение воды ![]() и
константу диссоциации азотистой
кислоты
и
константу диссоциации азотистой
кислоты![]() :
:
![]()
![]()
подставим в уравнение константы гидролиза:
![]()
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]()
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе
35. Константа гидролиза соли образованной слабым основанием и сильной кислотой (вывод уравнения).
36. Константа гидролиза соли образованной слабым основанием и слабой кислотой (вывод уравнения).
для соли, образованной слабой кислотой и слабым основанием:
![]()
37. Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
Ступенчатому гидролизу подвергаются соли, образованные:
многоосновной слабой кислотой,
многоосновным слабым гидроксидом,
тем и другим одновременно.
Вариант1
Na2CO3
I ступень

По первой ступени гидролиза образуется кислая соль.
II ступень
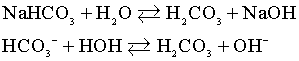
По второй ступени образуется слабая кислота.
Рассмотрим взаимосвязь первой и второй константы диссоциации слабой кислоты с первой и второй константой гидролиза рассмотренной соли.
I ступень
![]()
II ступень
![]()
I ступень гидролиза
![]()
II ступень гидролиза
![]()
Из приведённых уравнений диссоциации слабой кислоты и гидролиза соли видно, что первая константа диссоциации связана со второй константой гидролиза соли, и наоборот.
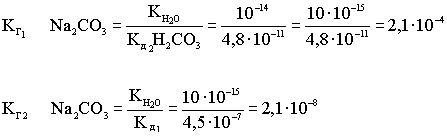
Вывод
По I ступени соли гидролизуются гораздо глубже, чем по второй ступени.
Кг по II ступени становится заметным при повышении температуры.
Кг1 > Кг2 > Кг3
Связь константы гидролиза со степенью гидролиза выводится подобно закону разбавления Оствальда и записывается так:
|
|
|
|
C – концентрация соли в моль/л.
38. Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
Буферными называют растворы, рН которых практически на изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении. Простейший буферный раствор – это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион (например, смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa), либо смесь слабого основания и соли, имеющей с этим основанием общий катион (например, смесь гидроксида аммония NH4OH с хлоридом аммония NH4Cl). С точки зрения протонной теории1 буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа: Воснование + Н+ Û ВН+сопряженная кислота НАкислота Û Н+ + А-сопряженное основание
Способность буферного раствора сохранять рН по мере прибавления сильной кислоты или приблизительно на постоянном уровне далеко небеспредельна и ограничена величиной так называемой буферной емкости В. За единицу буферной емкости обычно принимают емкость такого буферного раствора, для изменения рН которого на единицу требуется введение сильной кислоты или щелочи в количестве 1 моль эквивалента на 1л раствора. Т. е. это величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении сильных кислот или сильных оснований.
|
В = |
N |
|
рН2 – рН1 |
Буферная емкость, как следует из ее определения, зависит от ряда факторов: 1. Чем больше количества компонентов кислотно-основной пары основание/ сопряженная кислота в растворе, тем выше буферная емкость этого раствора (следствие закона эквивалентов). 2. Буферная емкость зависит от соотношения концентраций компонентов буферного раствора, а следовательно, и от рН буферного раствора. При рН = рКа отношение с (соль)/ с (кислота) = 1, т. е. в растворе имеется одинаковое количество соли и кислоты. При таком соотношении концентраций рН раствора изменяется в меньшей степени, чем при других, и, следовательно, буферная емкость максимальна при равных концентрациях компонентов буферной системы и уменьшается с отклонением от этого соотношения. Буферная емкость раствора возрастает по мере увеличения концентрации его компонентов и приближения соотношения [HAn]/ [KtAn] или [KtOH]/ [KtAn] к единице. Рабочий участок буферной системы, т. е. способность противодействовать изменению рН при добавлении кислот и щелочей, имеет протяженность приблизительно одну единицу рН с каждой стороны от точки рН = рКа. Вне этого интервала буферная емкость быстро падает до 0. Интервал рН = рКа ± 1 называется зоной буферного действия. Общая буферная емкость артериальной крови достигает 25, 3 ммоль/ л; у венозной крови она несколько ниже и обычно не превышает 24, 3 ммоль/ л.