
- •1.Понятие об эквиваленте. Эквивалент сложного вещества. Изменение эквивалентов, при вступлении их в химические реакции. Закон эквивалентов.
- •2.Теоретические основы объемного анализа. Классификация объёмного анализа, по реакции, лежащей в их основе и по способу титрования. Расчёты, применяемые в объёмном анализе.
- •3.Кислотно-основной метод титрования. Индикаторы, применяемые в этом методе. Кривые титрования. Точка эквивалентности. Стандартные и рабочие растворы. Определение общей кислотности желудочного сока.
- •4.Перманганатометрия. Определение активности каталазы крови.
- •5.Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине с.
- •6. Окислительно-восстановительные реакции. Зависимость эквивалентного окислителя и восстановителя от реакции среды.
- •7.Типы окислительно-восстановительных реакций.
- •8.Агрентометрия. Методы Мора и Фольгарда
- •9.Термохимические уравнения и расчёты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •10. Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Влияние концентрации
- •Влияние температуры
- •Влияние давления
- •11.Химическая кинетка, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •12. Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •13. Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •14.Типы сложных химических реакций (параллельные, последовательные, сопряжённые, обратные, цепные).
- •15.Уравнение кинетики реакции первого порядка. Период полупревращения.
- •16.Уравнения кинетики реакций второго порядка.
- •17.Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •18. Энергия активации. Уравнение Аррениуса.
- •19. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Микрогетерогенный катализ.
- •20.Ферменты как биологические катализаторы и их классификация.
- •21. Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •22. Способы выражения концентрации растворов.
- •23. Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •24. Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •25. Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •26. Повышение температуры кипения растворов. Эбулиоскопическая постоянная.
- •27. Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •28.Теория кислот и оснований. Сильные и слабые электролиты, степень диссоциации.
- •29. Константа диссоциации. Закон разведения Освальда.
- •30. Электролиты в организме человека.
- •31. Протолитическая теория кислот и оснований.
- •32. Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •33. Гидролиз солей. Степень гидролиза.
- •34. Константа гидролиза солеи образованной сильным основанием и слабой кислотой (вывод уравнения).
- •35. Константа гидролиза соли образованной слабым основанием и сильной кислотой (вывод уравнения).
- •36. Константа гидролиза соли образованной слабым основанием и слабой кислотой (вывод уравнения).
- •37. Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •38. Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •39. Уравнения Гендерсона Гассельбаха для расчёта рН буферных систем (вывод).
- •40. Буферные системы крови.
- •41. Методы получения коллоидных растворов.
- •42. Методы очистки коллоидных растворов. Искусственная почка.
- •43. Строение коллоидных частиц. Строение мицеллы.
- •44. Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
- •47. Металлы и сплавы. Применение металлов и сплавов в стоматологии. Коррозия металлов.
- •45. Состав и свойства гипса. Применение в стоматологии.
- •46. Цементы. Их состав и свойства. Применение в стоматологии.
29. Константа диссоциации. Закон разведения Освальда.
Как уже было
сказано выше, ЭД слабых электролитов
– обратимый процесс. Поэтому
силу электролита также можно
охарактеризовать с помощью константы
химического равновесия процесса
диссоциации электролита – константы
диссоциации.
Так, например, диссоциация
уксусной кислоты протекает по
уравнению:
СН3СООН
↔ СН3СОО–+Н+
характеризуется
константой диссоциации:
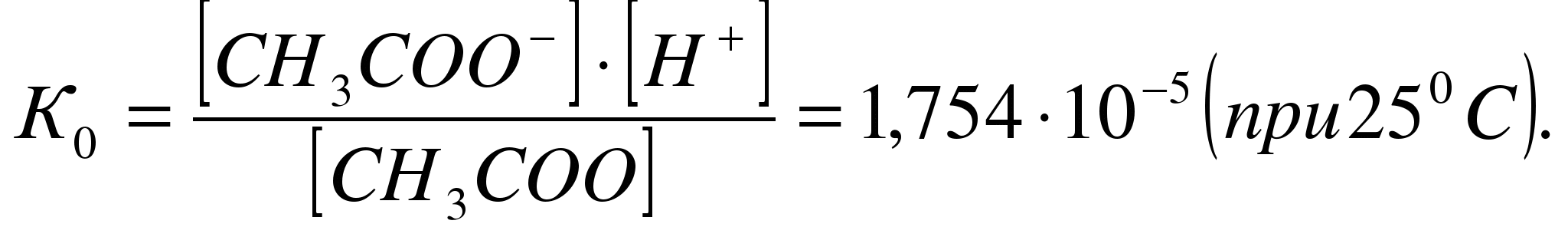 Зависимость
между степенью диссоциации и константой
диссоциации слабого электролита
определяется законом
разбавления Оствальда:
Зависимость
между степенью диссоциации и константой
диссоциации слабого электролита
определяется законом
разбавления Оствальда:
![]()
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
![]()
где α — степень диссоциации.
Константа диссоциации зависит от температуры, но не зависит от концентрации электролита. В этом ее преимущество по сравнению со степенью электролитической диссоциации. Чем больше значение константы диссоциации, тем сильнее электролит.
30. Электролиты в организме человека.
Коллоидные растворы клеток и биологических жидкостей находятся в соприкосновении с электролитами. Поэтому при введении в организм какого-либо электролита надо учитывать не только его концентрацию, но и заряд ионов. Так, физиологический раствор хлорида натрия нельзя заменить изотоничным раствором хлорида магния, поскольку в этой соли имеется двухзарядный ион магния, обладающий высоким коагулирующим действием. С явлением коагуляции эритроцитов вследствие уменьшения их дзета-потенциала врачи постоянно имеют дело в клинических лабораториях (метод определения СОЭ скорости оседания эритроцитов). Это явление объясняется тем, что при патологии в крови увеличивается содержание некоторых видов белков, место ионов электролитов на поверхности эритроцитов занимают белки, заряд которых ниже, чем у суммы замещенных ими ионов. Заряд эритроцитов понижается, они быстрее объединяются и оседают. Организм обладает концентрационным гомеостазом, физиологический механизм регуляции которого связан во многом с функцией почек. Электролиты выполняют в организме важную роль: отвечают за осмолярность и величину ионной силы биосред, образуют биоэлектрический потенциал, катализируют процессы обмена веществ, стабилизируют определенные ткани (костная), служат в качестве энергетических депо (фосфаты), участвуют в свертывающей системе крови. Для практики полезно запомнить, что физиологическими растворами являются 1 / 6 моль/л растворы солей, молекулы которых полностью диссоциируют на 2 иона, и 1/3 моль/л растворы растворов неэлектролитов (например, 1/3 моль/л раствор глюкозы). Физико-химические параметры гомеостаза таких растворов, а следовательно и параметры гомеостаза плазмы - важнейшей биосреды человеческого организма составляют: п плазмы = 7.6 – 8.1атм. п онкотическое – 0.03 – 0.04 атм, д Т зам. плазмы = 0.560С, I внутриклет = 0.35, Iплазмы= 0.15
