
- •Раздел 1. Общие методические указания по изучению дисциплины
- •Часть I – основы физической и коллоидной химии;
- •Часть II – биохимия сельскохозяйственных животных.
- •Список литературы
- •1.2. Введение
- •Раздел 2. Методические указания по изучению отдельных тем дисциплины
- •Часть I.
- •Вопросы для самоподготовки
- •Вопросы для самоподготовки по теме
- •Или в ионном виде:
- •Косн [основание]
- •Вопросы для самоподготовки по теме
- •Вопросы для самоподготовки по теме
- •Мицеллярная формула иодида серебра для первого случая ( когда
- •Молекула стабилизатора диссоциирует по уравнению
- •Вопросы для самоподготовки по теме
- •Часть II
- •Фосфорная
- •Дезоксирибоза фосфорная
- •Синтез белков в животном организме.
- •Вопросы для самоподготовки по теме.
- •Вопросы для самоподготовки по теме
- •Аэробная фаза распада углеводов в тканях
- •Вопросы для самоподготовки по теме
- •Химия и обмен липидов
- •Вопросы для самоподготовки по теме
- •2.1.2.7. Витамины
- •Вопросы для самоподготовки по теме
- •2.1.2.8 Гормоны
- •Вопросы для самоподготовки по теме
- •Биологическая роль минеральных веществ.
- •Вопросы для самоподготовки по теме
- •Раздел 3. Указания для выполнения контрольной работы.
- •Образец титульного листа контрольной работы
- •Воронеж
- •Оглавление Раздел 1. Общие методические указания по изучению дисциплины 2
- •Раздел 2. Методические указания по изучению отдельных тем дисциплины 5
- •Раздел 3. Указания для выполнения контрольной работы 68
Молекула стабилизатора диссоциирует по уравнению
F eOCl FeO++ Cl‾
Таким образом, ядро коллоидной мицеллы гидроксида железа Fe(OH)3 состоит из большого числа молекул Fe(OH)3. Потенциалопределяющим ионом является FeO+, так как ион Cl‾ не входит в состав ядра. Исходя из этого мицеллярная формула золя гидроксида железа (III) может быть изображена следующим образом:
{m[Fe(OH)3] nFeO+ (n-x) Cl-}+xCl-
На рис.1 приведено схематическое изображение мицеллы гидроксида железа (III).
Состояние коллоидной системы, при котором суммарный заряд коллоидной частицы (электрокинетический потенциал) равен 0, называется изоэлектрическим состоянием. В таком состоянии коллоидная система наименее устойчива и легко коагулирует.
В водных растворах белков, являющихся амфотерными электролитами, изоэлектрическое состояние наступает при определенной реакции среды (рН), которая называется изоэлектрической точкой.
Белки, аминокислоты, полипептиды и другие вещества способны к двоякого рода диссоциации – кислотной и основной, то есть представляют собой амфолиты.
Белковый амфолит может быть в состоянии, в котором его молекулы электронейтральны вследствие того, что они находятся в виде амфионов:
N H3+ R COO-
Такое состояние называется изоэлектрическим состоянием, и для каждого белка, в зависимости от его химических свойств, оно наблюдается при определенной концентрации водородных ионов, которая и является изоэлектрической точкой данного белка.
При другой рН белок уже не будет электронейтральным. В более кислой среде, чем это соответствует изоэлектрической точке, молекулы белка будут представлять собой катионы и белок будет обладать основным характером:
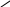
 NH3+
NH3+
NH3+
NH3+
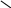
 R + H+
+ A
R + A
R + H+
+ A
R + A
COO- COOH
В более щелочной среде белок будет представлять собой анионы и иметь кислый характер:
NH3+ NH2
R + B+ + OH- R + H2O + B+
COO- COO-
Иными словами, состояние белковой молекулы может быть различным при различных рН среды.
Определение изоэлектрической точки является необходимым для суждения о том, в каком из трех возможных состояний
NH3+ NH2
 R + A
NH3+
R
COOH R + B+
+ H2O
R + A
NH3+
R
COOH R + B+
+ H2O
COOH COO-
Находится белок в среде с той или иной концентрацией водородных ионов.
Изоэлектрическая точка белка желатины лежит при рН=4,7, глобулина – 5,2, гемоглобина – 6,8 и т.д.
В изоэлектрической точке белок, как и другие коллоиды, наименее устойчив, т.к. его молекулы электронейтральны и не отталкиваются друг от друга. Некоторые белки в этой точке самопроизвольно коагулируют.
Отличной чертой коллоидных систем является их неустойчивость, ведущая во многих случаях к выделению осадков. При этом осадки имеют химический состав дисперсной фазы. Причиной неустойчивости золей является непостоянство их дисперсности.
При добавлении к такому раствору электролита коллоидные частицы теряют заряд и происходит коагуляция суспензоидов.
Эмульсоиды, в отличии от суспензоидов, более устойчивы, так как обладают двумя факторами устойчивости:
зарядом частиц и
водной оболочкой частиц.
Для коагуляции гидрофильных коллоидов необходимо, кроме нейтрализации заряда частиц, разрушить окружающую их водную оболочку добавлением водоотнимающих средств (спирта, ацетона, танина). Водоотнимающие вещества, разрушая водную оболочку гидрофильных частиц, превращают их в гидрофобные, после чего, происходит процесс коагуляции в присутствии электролита.
Прибавление гидрофильного золя к гидрофобному повышает устойчивость последнего по отношению к электролитам вследствие адсорбции гидрофильных частиц на поверхности гидрофобных – защитное действие. Гидрофильные коллоиды при этом как бы передают свои свойства гидрофобным частицам.


 Белок
Белок
Различные гидрофильные коллоиды обладают различной защищающей способностью, поэтому возникла необходимость определения их защитной силы. Мерой защитного действия является золотое число.
«Золотое число» есть минимальное количество миллиграммов сухого гидрофильного вещества, которое нужно прибавить к 10 мл коллоидного раствора золота, чтобы задержать переход красного цвета золя в фиолетовый под действием 1 мл 10%-ного раствора поваренной соли.
«Золотое число» показывает границу двух концентраций защищающего коллоида, из которых одна создает защиту, а другая вызывает коагуляцию, внешне выражающуюся в переходе красной окраски в фиолетовую. Вместо определения золотого числа часто производят определение рубинового и железного числа путем наблюдения начала коагуляции Fe(OH)3.
Обратите особое внимание на свойства водных растворов белков, влияние на них реакции среды (рН) и на так называемое равновесие Доннана, которое возникает в этих растворах при наличии полупроницаемой мембраны, не пропускающей крупные белковые ионы.
