
- •2.Регуляция обмена железа в организме человека:системаIre/irPи ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
- •3.Задача.
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •1. Присоединение irp к мРнк рецептора трансферрина ближе к ее 3'-концу защищает мРнк от разрушения рнКазами, действующими с 3'-конца мРнк:
- •3.Задача.Ответ:в результате одноэлектронного восстановления кислорода образуются высокореакционные свободные радикалы: — супероксидный анион радикал, — гидроксильный радикал
- •Активные формы кислорода инициируют в мембранах процессы пол
- •2.К железосодержащим белкам относятся:
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •3.Задача.Ответ:
- •1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
- •2. Всасывание
- •3.Задача.Ответ.А)Воспаление.
- •3.Задача.Ответ:
- •3.Задача.Ответ:
- •В пространстве
- •1) Антитромбин III (основной)
- •3. Ферритин и гемосидерин внутренних органов;
- •3.Задача.
- •3. Ферритин и гемосидерин внутренних органов;
- •3.Задача.Ответы:Образование и обезвреживание активных форм кислорода вэритроците
- •11 Билет.
- •1. Присоединение irp к мРнк рецептора трансферрина ближе к ее 3'-концу защищает мРнк от разрушения рнКазами, действующими с 3'-конца мРнк:
3.Задача.Ответ:
а) Разрушение клеток при механической травме и инфаркте миокарда сопровождается экспозицией на поверхности их плазматических мембран тканевого фактора и отрицательнозараженных фосфолипидов и инициации каскада реакций внешнего пути свертывания крови. Контакт фактора XII с субэндотелием поврежденных сосудов запускает реакции внутреннего пути свертывания крови.
б) Инициирующий мембранный комплекс включает отрицательнозаряженныефофсолипиды модифицированной плазматической мембраны клеток, протеолитический фермент - фактор VIIа, белок-активатор - тканевой фактор и ионы Са 2+ .

1.





2.Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Негемовое железо (III) захватывается интегрином, восстанавливается до Fe (II) параферритином, и при помощи мобилферрина перемещается к месту использования, роль этого пути невысока.
2. Негемовое железо (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты, соляной кислоты или при участии ферроредуктазы (DcytB, дуоденального цитохрома B) и далее переносится внутрь белком DMT-1 (divalentmetalion transporter-1).
3. Гемовое железо связывается с белком НСР1 (hemecarrierprotein 1), и в цитозоле высвобождается из гема при действии гемоксигеназы, и далее переносится по клетке.
После всасывания формируется пул внутриклеточного железа. Далее железо может
остаться в клетке в составе ферритина (Fe3+),
выходить из клетки при помощи ферропортина, окисляться гефестином (феррооксидазой) и связываться с трансферрином (Fe3+).
3.Задача.Ответ:
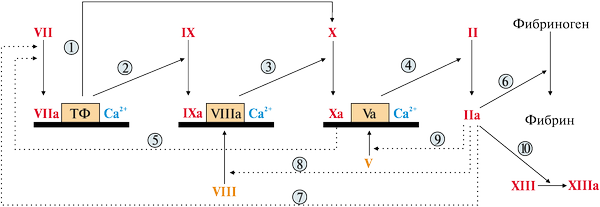
Рис. 78 Прокоагулянтный путь свертывания крови
б) Протромбин синтезируется в печени, его молекула содержит остатки γ-карбоксиглутаминовой кислоты. Он фиксируется на мембранном ферментном комплексе Ха-Vа-Са2+. Фактор Ха, активированный этинилэстрадиолом, гидролизует пептидные связи в молекуле протромбина. В результате образуется тромбин, который частичным протеолизом превращает фибриноген в фибрин, активирует факторы VII, VIII, V по принципу положительной обратной связи, а также фактор XIII.
в) В процессе формирования фибринового тромба выделяют следующие этапы:
• превращение фибриногена в мономер фибрина в результате отщепления тромбином А- и В-фибринопептидов;
• образование нерастворимого геля фибрина. В результате изменения конформации в доменах фибрина-мономера открываются комплементарные участки – центры связывания. Из-за чего возникают нековалентные связи между молекулами фибрина и его дальнейшие полимеризации;
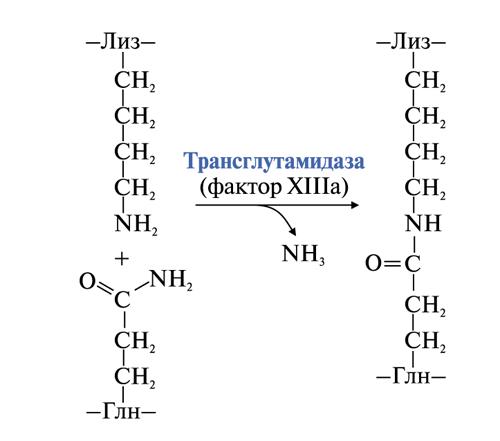
Рис. 79 Образование амидной связи между молекулами фибрина
• стабилизация геля фибрина. Фермент трансглутаминаза (фактор XIIIа) катализирует образование амидных связей между радикалами глутамина и лизина мономеров фибрина, а также между фибрином и фибринонектином.
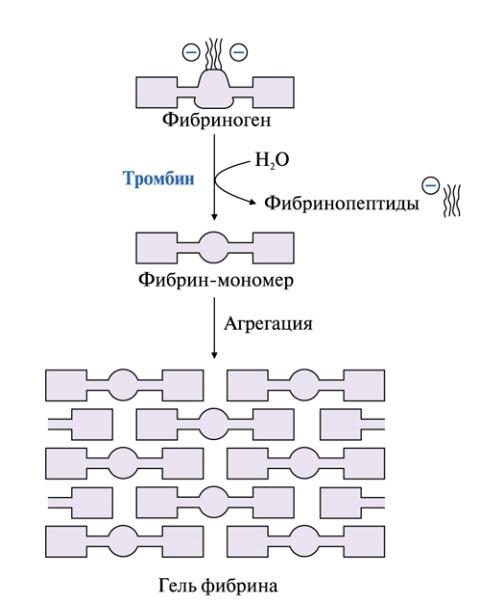
Рис. 80 Образование геля фибрина
• ретракция фибринового сгустка. Сжатие геля обеспечивает актомиозин тромбоцитов – сократительный белок тромбостенин, обладающий АТФ-азной активностью. Тромбостенин участвует в активации и агрегации тромбоцитов. Ретракция кровяного сгустка предупреждает полную закупорку сосудов, создавая возможность для восстановления кровотока.
Таким образом, на фоне длительного применения препарата «Диане-35» возможно развитие тромбоза маточных артерий вследствие активации II, X факторов прокоагулянтного пути свертывания крови.

Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком - контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидинакоординационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащийпротомер.



Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).

2![]() .
.
Второй мембранный комплекс включает в себя протеин С и его активатор - белокS, и Са2+.
Протеин С - профермент, содержит остатки глутаминовой кислоты, активируется частичным протеолизом под действие первого мембранного комплекса.
Под действием тромбина протеин С (циркулирующий в крови) присоединяется к неповрежденным мембранам и в присутствии белка S активируется и расщепляет (инактивирует) V и VIII факторы, которые являются белками-активаторами ферментов.
