
- •2.Регуляция обмена железа в организме человека:системаIre/irPи ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
- •3.Задача.
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •1. Присоединение irp к мРнк рецептора трансферрина ближе к ее 3'-концу защищает мРнк от разрушения рнКазами, действующими с 3'-конца мРнк:
- •3.Задача.Ответ:в результате одноэлектронного восстановления кислорода образуются высокореакционные свободные радикалы: — супероксидный анион радикал, — гидроксильный радикал
- •Активные формы кислорода инициируют в мембранах процессы пол
- •2.К железосодержащим белкам относятся:
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •3.Задача.Ответ:
- •1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
- •2. Всасывание
- •3.Задача.Ответ.А)Воспаление.
- •3.Задача.Ответ:
- •3.Задача.Ответ:
- •В пространстве
- •1) Антитромбин III (основной)
- •3. Ферритин и гемосидерин внутренних органов;
- •3.Задача.
- •3. Ферритин и гемосидерин внутренних органов;
- •3.Задача.Ответы:Образование и обезвреживание активных форм кислорода вэритроците
- •11 Билет.
- •1. Присоединение irp к мРнк рецептора трансферрина ближе к ее 3'-концу защищает мРнк от разрушения рнКазами, действующими с 3'-конца мРнк:
1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
Например,
при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы (КК-MB), изоферментов лактатдегидрогеназы 1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы,
нарушения скелетных мышц – мышечного изофермента креатинкиназы (КК-MM), алкогольдегидрогеназы,
костной ткани – щелочной фосфатазы (ЩФ), альдолазы (АЛД),
предстательной железы – кислой фосфатазы,
гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы,
желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП).
2. Ферменты, экскретируемые в выводные протоки желчных путей, панкреатические и слюнные протоки. В норме активность таких ферментов в плазме намного ниже, чем в клетках и имеет постоянное значение (α-амилаза, липаза поджелудочной железы). Изучение активности этих ферментов позволяет судить о функционировании соответствующего органа.
2.
Рефлекторный (кратковременный) спазм сосудов, который возникает при травме. Он значительно уменьшает объем кровотока через поврежденный сосуд или даже прекращает в нем движение крови. Затем спазм сосудов поддерживается действием серотонина, адреналина, тромбоксана, эндотели- нов, которые выделяются из тромбоцитов или клеток поврежденных сосудов
Продукцией под влиянием мембранной фосфолипазы и фермента тромбоксан-синтетазы мощного вазодилататора и ингибитора агрегации тромбоцитов – простагландина(простациклина)
3.Задача.Ответ:а)Заболевание – серповидноклеточная анемия.
б) В гемоглобине S мутантными оказались 2β-цепи, в которых Глу, высокомолекулярная отрицательно заряженная аминокислота в положении 6, была заменена Вал, содержащим гидрофобный радикал.
HbS 2β-цепь Вал-Гли-Лей-Тре-Про-Вал-Глу-Лиз
в) Гемоглобин S
В дезоксигемоглобине S имеется участок, комплиментраный другому участку таких же молекул, содержащему изменённую. В результате молекулы дезоксигемоглобина начинают слипаться, образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
Нарушение доставки кислорода в ткани вызывает боли и даже некроз клеток в данной области.

1.



2.
Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Негемовое железо (III) захватывается интегрином, восстанавливается до Fe (II) параферритином, и при помощи мобилферрина перемещается к месту использования, роль этого пути невысока.
2. Негемовое железо (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты, соляной кислоты или при участии ферроредуктазы (DcytB, дуоденального цитохрома B) и далее переносится внутрь белком DMT-1 (divalentmetalion transporter-1).
3. Гемовое железо связывается с белком НСР1 (hemecarrierprotein 1), и в цитозоле высвобождается из гема при действии гемоксигеназы, и далее переносится по клетке.
После всасывания формируется пул внутриклеточного железа. Далее железо может
остаться в клетке в составе ферритина (Fe3+),
выходить из клетки при помощи ферропортина, окисляться гефестином (феррооксидазой) и связываться с трансферрином (Fe3+).

3.Задача ОТВЕТ:а)Гемоглобин,
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
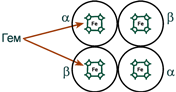
Строение гемоглобина А
Б)На связывание кислорода гемоглобином сильное влияние оказывает pH и CO2. Связывание CO2 и H+снижает способность гемоглобина связывать O2.
В)

Строение и синтез гема
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
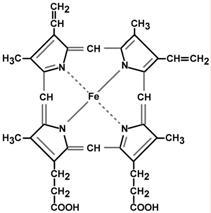
Строение гема
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ - "дельта") происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле. Здесь из двух молекул δ‑аминолевулиновой кислоты образуется циклический порфобилиноген (монопиррол).
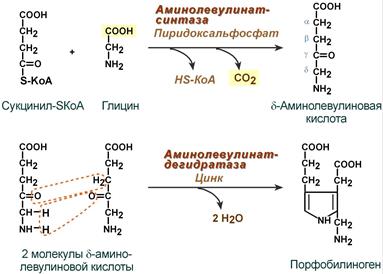
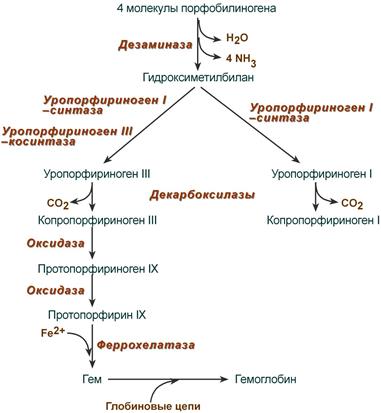
Синтез гема из порфобилиногена
Регуляция синтеза гема
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
1. Гем :
влияет на транскрипцию фермента. После взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается.
напрямую оказывает отрицательный аллостерический эффект на фермент.
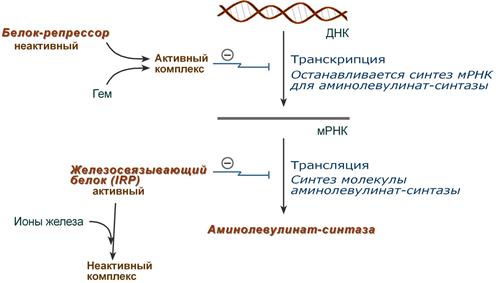
Регуляция синтеза аминолевулинатсинтазы
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsiveelement-bindingproteins – белок, связывающий железочувствительный элемент), который в отсутствии ионов железа обладает сродством к железочувствительному участку IRE (англ. iron-responsiveelement ) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи. Ионы железа связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и инициируют синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышение активности аминолевулинатсинтазы вызывают различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
