
- •2.Регуляция обмена железа в организме человека:системаIre/irPи ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
- •3.Задача.
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •1. Присоединение irp к мРнк рецептора трансферрина ближе к ее 3'-концу защищает мРнк от разрушения рнКазами, действующими с 3'-конца мРнк:
- •3.Задача.Ответ:в результате одноэлектронного восстановления кислорода образуются высокореакционные свободные радикалы: — супероксидный анион радикал, — гидроксильный радикал
- •Активные формы кислорода инициируют в мембранах процессы пол
- •2.К железосодержащим белкам относятся:
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •3.Задача.Ответ:
- •1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
- •2. Всасывание
- •3.Задача.Ответ.А)Воспаление.
- •3.Задача.Ответ:
- •3.Задача.Ответ:
- •В пространстве
- •1) Антитромбин III (основной)
- •3. Ферритин и гемосидерин внутренних органов;
- •3.Задача.
- •3. Ферритин и гемосидерин внутренних органов;
- •3.Задача.Ответы:Образование и обезвреживание активных форм кислорода вэритроците
- •11 Билет.
- •1. Присоединение irp к мРнк рецептора трансферрина ближе к ее 3'-концу защищает мРнк от разрушения рнКазами, действующими с 3'-конца мРнк:
Тут билеты которые смог найти.№8,21,22,7,9,5,1,2,4,3,20,13,16,6,19,15,17,10(теория+задачи решенные)№12,11(теория)

1.Миоглобин:строение,функции,отличие
от гемоглобина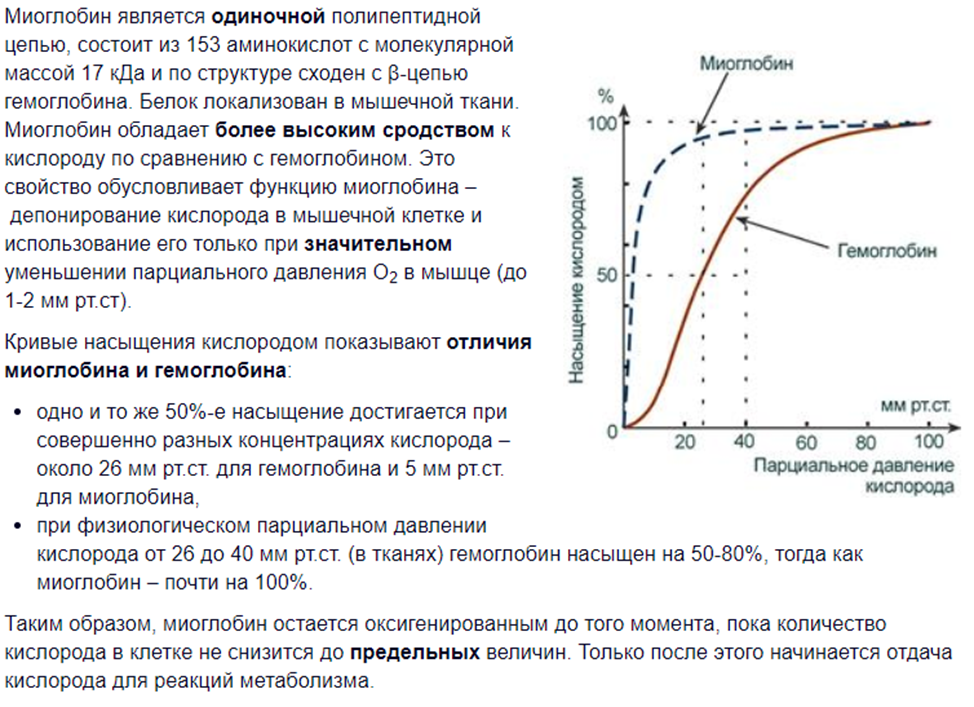
2.Регуляция обмена железа в организме человека:системаIre/irPи ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
Система IRE/IRP
Регуляцию поступления железа в клетку обеспечивает система IRE/IRP (англ. IRE, iron-responsiveelement - железочувствительный элемент и IRP, iron-responsiveelement-bindingproteins - белок, связывающийся с железочувствительным элементом). Основой регуляции является наличие особого участка на матричной РНК - железочувствительного элемента IRE, связывающего специфичный к нему белок IRP.
В данном случае используется способность молекул IRP связываться с участком IRE соответствующих мРНК для двух белков – рецептора трансферрина и ферритина. При этом в комплексе с железом IRP не активен и не присоединяется к мРНК, без железа - может присоединяться.
1. Присоединение IRP к мРНК рецептора трансферрина ближе к ее 3'-концу защищает мРНК от разрушения РНКазами, действующими с 3'-конца мРНК:
при низкой концентрации железа в клетке белок IRP является активным, присоединяется к мРНК и, как следствие, мРНК рецепторов трансферрина существует дольше, образуется больше белков-рецепторов и повышается поток железа в клетки.
при высоком содержании железа в клетке белок IRP присоединяет железо, становится неактивным, с мРНК связаться не может и, соответственно, не защищает ее от разрушения. Синтез рецепторов к трансферрину не происходит, дополнительное железо клеткой не захватывается.

Регуляция синтеза рецепторов к трансферину
2. Взаимодействие IRP с мРНК ферритина происходит ближе к 5'-концу, т.е. там где начинается трансляция:
при низком содержании железа в клетке присоединение "пустого" активного белка IRP к мРНК для ферритина со стороны 5'-конца не позволяет ей участвовать в процессе трансляции и синтезе новых молекул ферритина,
когда концентрация железа в клетке возрастает, оно присоединяется к IRP, снижает его сродство к мРНК и позволяет синтез ферритина.

Регуляция синтеза ферритина
Конечным результатом при наличии железа в клетке является исчезновение рецепторов к трансферрину с мембраны и увеличение синтеза молекул ферритина, депонирующего железо. При отсутствии железа активируется синтез рецепторов к трансферрину и захват железа из крови, и подавление синтеза запасающего белка ферритина.
3.Задача.
Ответ:а) 2,3-бисфосфоглицерат (2,3-БФГ) – вещество, синтезируемое из промежуточного продукта окисления глюкозы – 1,3-бисфосфоглицерата.
б) В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость – место присоединения БФГ.
В молекуле дезоксигемоглобина по сравнению с оксигемоглобином есть дополнительные ионные связи, соединяющие протомеры, поэтому размеры центральной полости больше в дезоксигемоглобине, следовательно 2,3-БФГ может присоединиться только к дезоксигемолглобину.
В тканях 2,3-БФГ присоединяется к дзоксигемоглобину и снижает сродство гемоглобина к кислороду.
лёгкие
в) HbO2 + 2,3-БФГ ↔ Hb*2,3-БФГ + O2
ткани
В результате взаимодействия 2,3-БФГ с дезоксигемоглобином образуется 5 дополнительных ионных связей, что снижает сродство гемоглобина в кислороду.

1.Альбумины сыворотки крови:местобиосинтеза,особенностисостав,структуры,физико-химических свойств,функций.
Альбумин - белок плазмы крови
Глобулярный белок плазмы крови, синтезируется исключительно в печени. Хотя по классификации его относят к простым белкам, отмечается широкая микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Значение альбумина в плазме крови заключается:
1. В поддержании коллоидно-осмотического (онкотического) давления крови (благодаря высокой гидрофильности);
2. Транспортная – благодаря большому количеству заряженных и гидрофобных участков альбумин переносит
пигменты – (билирубин), одна молекула альбумина может одновременно связать 25-50 молекул билирубина,
длинноцепочечные жирные кислоты – основная физиологическая функция, 6-8 штук на одну молекулу альбумина,
катионы (например, Ca2+ и Mg2+) благодаря большому количеству глутамата, другие металлы (Hg+) также способен связать анионы (Cl–),
соли желчных кислот,
витамины,
гормоны (альдостерон, прогестерон, гидрокортизон),
органические красители,
лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота, сердечные гликозиды).
Изменения количества белка в крови могут иметь как абсолютный (истинный), так и относительный характер. Сдвиги абсолютного характера являются следствием колебаний содержания белка в крови. В свою очередь, относительные изменения зависят от объема крови, т.е. наблюдаются при обезвоживании или гипергидратации.
2. Фибринолитическая система крови компоненты,биологическая роль.



3.Задача.Ответ:а) 2,3-бисфосфоглицерат (2,3-БФГ) – вещество, синтезируемое из промежуточного продукта окисления глюкозы – 1,3-бисфосфоглицерата.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость – место присоединения БФГ.
Б)Влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином называется Эффектом Бора.
Hb + O2 ↔ HbO2
Ионная форма реакции объясняет влияние концентрации H+ на связывание O2 Hb-ион.
HHb+ + O2 ↔ HbO2 + H+
Уменьшение pH и увеличение H+ приводит к высвобождению O2 из HbO2.
В)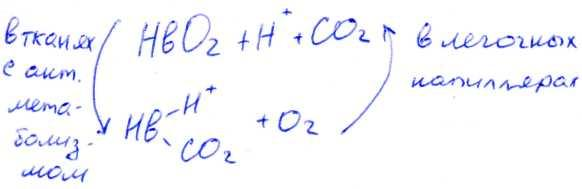

1.

2.К железосодержащим белкам относятся:
Гемопротеины – гемоглобин, миоглобин, цитохромы, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза.
Железофлавопротеины – сукцинатдегидрогеназа, НАДФ-оксидаза (в гранулоцитах), ацил-S-КоА-дегидрогеназа, ксантиноксидаза, пролил-гидроксилаза и др.
Железосвязывающие белки – трансферрин, ферритин, гемосидерин, мобилферрин, лактоферрин и др.
Суточная потребность
С пищей в сутки должно поступать для мужчин 10 мг, для женщин детородного возраста в связи с регулярной кровопотерей – 20 мг, у женщин при беременности – 40-50 мг и при лактации – 30-40 мг.

Существует точная регуляция обмена железа,этапы.
Основными факторами, влияющими на обмен железа, являются потребности гемопоэза, пищевой фактор и уровень запаса металла в тканях. Количество железа в организме поддерживается тремя основными путями:
