
- •1. Предмет и задачи неорганической химии. Роль в системе естественных наук
- •3. Основные стехиометрические законы
- •4. Важнейшие классы и номенклатура неорганических веществ
- •5. Развитие учения о строении атома
- •6. Строение электронных оболочек атомов
- •7. Периодическая система элементов как форма отражения периодического закона
- •8. Периодичность свойств химических элементов
- •9. Основные типы химической связи
- •10. Ковалентная химическая связь. Основные положения метода валентных связей
- •11. Геометрия структур с ковалентным типом связи
- •12. Основы метода молекулярных орбиталей
- •13. Ионная и металлическая связь
- •14. Водородная связь
- •15. Кристаллическое, жидкое и аморфное состояние веществ
- •16. Скорость химических реакций. Константа скорости и ее физический смысл
- •17. Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса
- •18. Влияние катализатора на скорость химической реакции
- •19. Химическое равновение. Принцип Ле-Шаталье
- •20. Основы химической термодинамики. Энтальпия системы
- •21. Понятие об энтропии
- •22. Соотношение между величиной изменения энергии Гиббса и величинами энтропии и энтальпии
- •23. Дисперсные системы. Коллоидные растворы
- •24. Растворимость веществ
- •25. Состав растворов. Способы выражения состава растворов
- •26. Основные положения теории электролитической диссоциации
- •27. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации
- •28. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов
- •29. Основания, кислоты и соли с точки зрения теории электролитической диссоциации
- •30. Обменные реакции в растворах электролитов
- •31. Условия образования и растворения осадков
- •1) Условие выпадения осадка:
- •2) Условие растворения осадка:
- •32. Диссоциация воды. Константа диссоциации, ионное произведение воды
- •33. Гидролиз солей. Механизм гидролиза
- •34. Окислительно-восстановительные реакции. Основные типы окислительно-восстановительных реакций
- •35. Принцип электронного баланса
- •36. Метод полуреакций
- •37. Электрохимические процессы. Эдс гальванического элемента
- •38. Стандартные электродные потенциалы. Уравнение Нернста
- •39. Электрохимический ряд напряженности металлов
- •40. Электролиз водных растворов и расплавов
- •41. Химические процессы, протекающие на электродах
- •42. Основные положения координационной теории
- •43. Строение комплексного соединения
- •44. Устойчивость комплексных соединений
- •45. Водород и его свойства
- •46. Элементы VII а группы. Их характеристика
- •47. Галогены. Общая характеристика галогенов
- •48. Характер химической связи в молекулах галогенов. Их физические и химические свойства
- •49. Галогенводороды. Физические и химические свойства
- •50. Кислородсодержащие соединения галогенов
- •51. Общая характеристика элементов via группы (халькогены)
- •52. Физические свойства халькогенов
- •53. Химические свойства простых веществ (халькогенов)
- •54. Физические и химические свойства гидридов типа h2э в ряду h2o – h2Te
- •55. Соединения кислорода с водородом. Их свойства, общие принципы получения, применение
- •56. Кислые и средние халькогениды. Их свойства, общие принципы получения, применение
- •57. Оксиды халькогенов, их свойства, принципы получения, применение
- •58. Сернистая, селенистая, теллуристая кислоты. Строение, свойства и их солей
- •59. Серная, селеновая, теллуровая кислоты. Строение, свойства и их солей
- •60. Свойства разбавленной и концентрированной серной кислоты. Олеум. Соли и их практическое применение
- •61. Сульфаты и гидросульфаты. Купоросы и квасцы. Их применение
- •62. Полисерные, перексосерные, политионовые кислоты. Химические свойства. Соли и их практическое применение.
- •63. Общая характеристика элементовVa группы.
- •65. Гидриды типа эн3 элементов va группы.
- •66. Аммиак, его физические и химические свойства.
- •67. Оксиды азота, строение их молекул, химические свойства, способы получения, применение.
- •68. Азотистая кислота, ее соли.
- •69. Азотная кислота и ее соли.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •70. Кислородсодержащие соединения фосфора.
- •71. Кислородсодержащие кислоты фосфора и их соли.
- •Метафосфорная кислота
- •Ортофосфорная кислота h3po4
- •Полифосфорная кислота
- •Фосфористая кислота h3po3
- •72. Общая характеристика элементов ivа группы.
- •73. Строение и свойства простых веществ элементов ivа группы
- •74. Гидриды типы эн4 в ряду сн4 – PbH4
- •75. Кислород содержащие соединения углерода
- •76. Угольная кислота и ее соли
- •77. Кислородсодержащие соединения кремния
- •78. Кремневые кислоты и их соли
- •79. Общая характеристика металлов
- •80. Щелочные металлы. Их физические и химические свойства
- •81. Общая характеристика и свойства оксидов, пероксидов, гидроксидов и солей щелочных металлов.
- •82. Щелочноземельные металлы. Общая характеристика элементов. Физические и химические свойства простых веществ.
- •83. Общая характеристика оксидов, гидроксидов, солей элементов iiа группы.
- •84. Алюминий, его физические и химические свойства. Амфотерность алюминия. Алюминаты. Получение алюминия и его солей.
- •85. Металлы ivа группы. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •86. Общая характеристика p- элементов. Физические и химические свойства простых веществ.
- •87. Общая характеристика элементов групп меди и цинка.
- •88. Общая характеристика элементов группы хрома.
- •89. Общая характеристика элементов группы марганца.
- •90. Общая характеристика элементов семейства железа.
72. Общая характеристика элементов ivа группы.
Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих элементов имеют 4 электрона: ns 2 np 2. В подгруппе с ростом порядкового номера элемента увеличивается атомный радиус, неметаллические свойства ослабевают, а металлические усиливаются: углерод и кремний – неметаллы; германий, олово, свинец амфотерные металлы. Элементы этой подгруппы проявляют как положительную, так и отрицательную степени окисления: -4, 0, +2, +4.
Высшие оксиды углерода и кремния (С0 2, Si0 2) обладают кислотными свойствами, оксиды остальных элементов подгруппы - амфотерны (Ge0 2, Sn0 2, Pb0 2). Угольная и кремниевая кислоты (Н 2 СО 3, H 2 SiO 3) слабые кислоты. Гидроксиды германия, олова и свинца амфотерны, проявляют слабые кислотные и основные свойства: H 2 GeO 3 = Ge(OH) 4, H 2 SnO 3 = Sn(ОН) 4, Н 2 РЬО 3 = Pb(OH) 4. Водородные соединения: СН 4 ; SiH 4, GeH 4. SnH 4, PbH 4. Метан CH 4 прочное соединение, силан SiH 4 - менее прочное соединение, остальные же неустойчивые. Химические свойства соединений олова и свинца. Оксиды олова (II) и свинца (II), SnО и РbО амфотерны, так же как и соответствующие им гидроксиды Sn(ОН)2 и Рb(ОН)2. Соли Рb2+ -- ацетат, нитрат -- хорошо растворимы в воде, малорастворимы хлорид и фторид, практически нерастворимы сульфат, карбонат, хромат, сульфид. Все соединения свинца (II), в особенности растворимые, ядовиты. Биологическая активность свинца определяется его способностью проникать в организм и накапливаться в нем. Свинец и его соединения относятся к ядам, действующим преимущественно на нервно-сосудистую систему и непосредственно на кровь. Химизм токсического действия свинца весьма сложен. Ионы Рb2+ являются сильными комплексообразователями по сравнению с катионами остальных р-элементов IVА-группы. Они образуют прочные комплексы с биолигандами.
73. Строение и свойства простых веществ элементов ivа группы
Углерод в природе распространен и в виде простых веществ (алмаз, графит), и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2
1s
![]() 2s
2p
2s
2p
![]()
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s
2s
![]() 2p
2p
![]()
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.
Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
Кремний — второй по распространенности элемент на Земле после кислорода. Чаще всего в природе кремний встречается в виде соединений на основе SiO2 (речной и кварцевый песок, кварц и кварциты, кремень, полевые шпаты), силикатов и алюмосиликатов.
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si
1s22s22p63s23p2
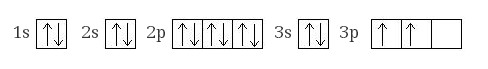
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3
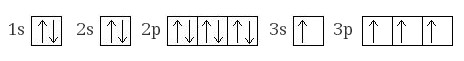
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Углерод
Химические свойства углерода
Качественные реакции
Обнаружить карбонат-ионы CO32- — можно при помощи взаимодействия солей-карбонатов с сильными кислотами. При этом выделяется углекислый газ — газ без цвета и запаха, не поддерживающий горение:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Качественная реакция на углекислый газ CO2– помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
При дальнейшем пропускании углекислого газа осадок CaCO3 растворяется:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Углекислый газ СО2 не поддерживает горение.
Угарный газ CO горит голубым пламенем.
Взаимодействие углерода с простыми веществами
С кислородом
Горит в недостатке кислорода с образованием угарного газа:
2C + O2 = 2CO
в избытке кислорода – с образованием углекислого газа:
C + O2 = CO2
С галогенами (F, Cl, Br, I)
Углерод реагирует со фтором при нагревании до 900ºС с образованием фторида углерода (IV):
C + 2F2 → CF4
Раскаленный углерод реагирует с другими галогенами:
C + 2Cl2→ CCl4
С водородом
При нагревании в присутствии катализатора (Ni) углерод взаимодействует с водородом с образованием метана:
С + 2Н2 → СН4
С серой
При сильном нагревании углерод взаимодействует с серой с образованием сероуглерода:
C + 2S → CS2
С азотом
С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
С углеродом
При нагревании около 2000оС кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
C + Si → SiC
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами углерод выступает в качестве окислителя, образуя карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
Взаимодействие со сложными веществами
С водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2
С кислотами
Углерод как восстановитель взаимодействует с кислотами-окислителями:
С концентрированной азотной кислотой
3C + 4HNO3 = 3CO2+ 4NO + 2H2O
C концентрированной серной кислотой:
С+2H2SO4=CO2 +2SO2 +2Н2О
С солями
В расплавах KNO3 и NaNO3 измельченный уголь интенсивно сгорает:
5С + 4KNO3 = 2К2СO3 + ЗСO2↑+ 2N2↑
С оксидами
Углерод взаимодействует с многими основными и амфотерными оксидами, с образованием металла и угарного газа:
C + 2ZnO → 2Zn + CO
4С + Fe3O4 → 3Fe + 4CO
Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
При взаимодействии углерода с оксидами активных металлов образуются карбиды:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
Кремний
Способы получения кремния
В промышленности основным сырьем для получения кремния служит кремнезем (диоксид кремния):
Восстановление SiO2 углеродом в электропечах при температуре 1800ºС:
SiO2 + 2C → Si + 2CO
Таким способом получают технический кремний.
Особо чистый кремний из технического продукта получают следующим образом:
Si + Cl2 = SiCl4
SiCl4 + 2H2 = Si + 4HCl
или:
Si + 2Mg = Mg2Si
Mg2Si + 4HCl = SiH4 + 2MgCl2
SiH4 → Si + 2H2
В лаборатории кремний можно получить:
при прокаливании смеси металлического магния с мелко измельченным кремнеземом:
SiO2 + 2Mg → Si + 2MgO
восстановление кремния из его оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
Химические свойства кремния
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами.
При этом выделяется белый гелеобразный осадок:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
Взаимодействие кремния с простыми веществами
С кислородом
Взаимодействует с кислородом при температуре более 400°С с образованием диоксида кремния:
Si + O2 → SiO2
С галогенами (F, Cl, Br, I)
При обычных условиях кремний реагирует только со фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
С остальными галогенами реакция идет при нагревании до 300-500ºС:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
С водородом
Не взаимодействует
С серой
При температуре выше 600°С кремний взаимодействует с серой с образованием сульфида кремния:
Si + 2S → SiS2
С азотом
С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2→ Si3N4
С углеродом
При нагревании около 2000оС кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
C + Si → SiC
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами кремний выступает в качестве окислителя, образуя силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
Взаимодействие кремния со сложными веществами
С водой
Непосредственно с водой не взаимодействует, однако аморфный кремний реагирует с перегретым водяным паром при температуре 400-500°С:
Si + 2H2O = SiO2 + 2H2
С кислотами
Кремний не взаимодействует с водными растворами кислот.
Аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным HF комплекс не образуется:
Si(тв.) + 4HF(г.) = SiF4 + 2H2
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот (травление кремния кислотами):
3Si + 4HNO3+ 12HF → 3SiF4 + 4NO + 8H2O
С водными растворами щелочей
В водных растворах щелочей при нагревании выше 60ºС кремний растворяется с образованием солей силикатов (травление щелочами):
Si + 2NaOH + H2O → Na2SiO3 + 2H2
С оксидами
При восстановлении SiO2 кремнием при температурах свыше 1200 ºC образуется оксид кремния (II) — SiO.
Si+SiO2 = 2SiO
Si + SiO2 = SiO
