
- •1. Предмет и задачи неорганической химии. Роль в системе естественных наук
- •3. Основные стехиометрические законы
- •4. Важнейшие классы и номенклатура неорганических веществ
- •5. Развитие учения о строении атома
- •6. Строение электронных оболочек атомов
- •7. Периодическая система элементов как форма отражения периодического закона
- •8. Периодичность свойств химических элементов
- •9. Основные типы химической связи
- •10. Ковалентная химическая связь. Основные положения метода валентных связей
- •11. Геометрия структур с ковалентным типом связи
- •12. Основы метода молекулярных орбиталей
- •13. Ионная и металлическая связь
- •14. Водородная связь
- •15. Кристаллическое, жидкое и аморфное состояние веществ
- •16. Скорость химических реакций. Константа скорости и ее физический смысл
- •17. Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса
- •18. Влияние катализатора на скорость химической реакции
- •19. Химическое равновение. Принцип Ле-Шаталье
- •20. Основы химической термодинамики. Энтальпия системы
- •21. Понятие об энтропии
- •22. Соотношение между величиной изменения энергии Гиббса и величинами энтропии и энтальпии
- •23. Дисперсные системы. Коллоидные растворы
- •24. Растворимость веществ
- •25. Состав растворов. Способы выражения состава растворов
- •26. Основные положения теории электролитической диссоциации
- •27. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации
- •28. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов
- •29. Основания, кислоты и соли с точки зрения теории электролитической диссоциации
- •30. Обменные реакции в растворах электролитов
- •31. Условия образования и растворения осадков
- •1) Условие выпадения осадка:
- •2) Условие растворения осадка:
- •32. Диссоциация воды. Константа диссоциации, ионное произведение воды
- •33. Гидролиз солей. Механизм гидролиза
- •34. Окислительно-восстановительные реакции. Основные типы окислительно-восстановительных реакций
- •35. Принцип электронного баланса
- •36. Метод полуреакций
- •37. Электрохимические процессы. Эдс гальванического элемента
- •38. Стандартные электродные потенциалы. Уравнение Нернста
- •39. Электрохимический ряд напряженности металлов
- •40. Электролиз водных растворов и расплавов
- •41. Химические процессы, протекающие на электродах
- •42. Основные положения координационной теории
- •43. Строение комплексного соединения
- •44. Устойчивость комплексных соединений
- •45. Водород и его свойства
- •46. Элементы VII а группы. Их характеристика
- •47. Галогены. Общая характеристика галогенов
- •48. Характер химической связи в молекулах галогенов. Их физические и химические свойства
- •49. Галогенводороды. Физические и химические свойства
- •50. Кислородсодержащие соединения галогенов
- •51. Общая характеристика элементов via группы (халькогены)
- •52. Физические свойства халькогенов
- •53. Химические свойства простых веществ (халькогенов)
- •54. Физические и химические свойства гидридов типа h2э в ряду h2o – h2Te
- •55. Соединения кислорода с водородом. Их свойства, общие принципы получения, применение
- •56. Кислые и средние халькогениды. Их свойства, общие принципы получения, применение
- •57. Оксиды халькогенов, их свойства, принципы получения, применение
- •58. Сернистая, селенистая, теллуристая кислоты. Строение, свойства и их солей
- •59. Серная, селеновая, теллуровая кислоты. Строение, свойства и их солей
- •60. Свойства разбавленной и концентрированной серной кислоты. Олеум. Соли и их практическое применение
- •61. Сульфаты и гидросульфаты. Купоросы и квасцы. Их применение
- •62. Полисерные, перексосерные, политионовые кислоты. Химические свойства. Соли и их практическое применение.
- •63. Общая характеристика элементовVa группы.
- •65. Гидриды типа эн3 элементов va группы.
- •66. Аммиак, его физические и химические свойства.
- •67. Оксиды азота, строение их молекул, химические свойства, способы получения, применение.
- •68. Азотистая кислота, ее соли.
- •69. Азотная кислота и ее соли.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •70. Кислородсодержащие соединения фосфора.
- •71. Кислородсодержащие кислоты фосфора и их соли.
- •Метафосфорная кислота
- •Ортофосфорная кислота h3po4
- •Полифосфорная кислота
- •Фосфористая кислота h3po3
- •72. Общая характеристика элементов ivа группы.
- •73. Строение и свойства простых веществ элементов ivа группы
- •74. Гидриды типы эн4 в ряду сн4 – PbH4
- •75. Кислород содержащие соединения углерода
- •76. Угольная кислота и ее соли
- •77. Кислородсодержащие соединения кремния
- •78. Кремневые кислоты и их соли
- •79. Общая характеристика металлов
- •80. Щелочные металлы. Их физические и химические свойства
- •81. Общая характеристика и свойства оксидов, пероксидов, гидроксидов и солей щелочных металлов.
- •82. Щелочноземельные металлы. Общая характеристика элементов. Физические и химические свойства простых веществ.
- •83. Общая характеристика оксидов, гидроксидов, солей элементов iiа группы.
- •84. Алюминий, его физические и химические свойства. Амфотерность алюминия. Алюминаты. Получение алюминия и его солей.
- •85. Металлы ivа группы. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •86. Общая характеристика p- элементов. Физические и химические свойства простых веществ.
- •87. Общая характеристика элементов групп меди и цинка.
- •88. Общая характеристика элементов группы хрома.
- •89. Общая характеристика элементов группы марганца.
- •90. Общая характеристика элементов семейства железа.
60. Свойства разбавленной и концентрированной серной кислоты. Олеум. Соли и их практическое применение
Химические свойства разбавленной серной кислоты. Разбавленная серная кислота — сильный электролит, она проявляет общие свойства кислот: меняет цвет индикаторов и образует соли в реакциях с металлами, основными и амфотерными оксидами, гидроксидами металлов, другими солями. Рассмотрим конкретные примеры.
1. Индикаторы лакмус и метилоранж окрашивают раствор серной кислоты в красный цвет. В разбавленных растворах серная кислота диссоциирует согласно схеме:
![]()
2. Образование солей:
а) металлы, расположенные в ряду активности до водорода, вытесняют его из разбавленных растворов серной кислоты:
Zn + Н2SO4 = ZnSO4 + H2↑; Fe + Н2SO4 = FeSO4 + H2↑;
б) реакции серной кислоты с основными и амфотерными оксидами, как правило, требуют небольшого нагревания для увеличения скорости:
СuO + Н2SO4 = CuSO4 + H2O; Al2O3 + 3Н2SO4 = Al2(SO4)3 + 3H2O;
в) в реакциях со щелочами и нерастворимыми основаниями образуются соли и вода (нейтрализация):
2NaOH + Н2SO4 = Na2SO4 + 2H2O или NaOH + Н2SO4 = NaНSO4 + H2O; Сa(OH)2 + Н2SO4 = СаSO4↓ + 2H2O.
Отметим, что при мольном соотношении щёлочи NaOH и кислоты Н2SO4 2 : 1 или избытке NaOH образуется средняя соль (сульфат), а при их соотношении 1 : 1 — кислая соль (гидросульфат). Следовательно, избыток многоосновной (двухосновной) кислоты Н2SO4 приводит к образованию кислых солей;
г) реакции растворов серной кислоты с солями протекают в полном соответствии с условиями реакций ионного обмена:
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑; H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3↓.
Концентрированная серная кислота — более сильный окислитель, чем разбавленная. Её окислительные свойства проявляются прежде всего в реакциях с металлами. Отметим несколько важных моментов.
Во-первых, происходит восстановление не водорода, а атомов серы. Продуктами восстановления являются SO2, S и Н2S. Состав преимущественно образующихся продуктов зависит как от концентрации кислоты, так и от активности металла как восстановителя. Чем меньше концентрация кислоты и выше активность металла, тем сильнее восстанавливаются атомы серы. В общем виде взаимодействие концентрированной серной кислоты с металлами можно представить схемой:

Так, в реакции с металлами, находящимися в ряду активности после водорода (кроме золота и платины), образуется оксид серы(IV) SO2, например:
![]()
В реакциях с металлами, расположенными в ряду активности до водорода, могут образовываться и SO2, и S, и Н2S. Например, cхемы реакций, протекающих при взаимодействии цинка с серной кислотой по мере увеличения её концентрации, выглядят так:
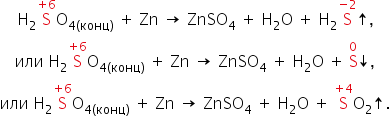
Во-вторых, некоторые сравнительно активные металлы (например, железо, алюминий, хром) концентрированной серной кислотой при комнатной температуре пассивируются: на поверхности металла образуется плотная оксидная плёнка. Благодаря пассивации железа возможна перевозка кислоты в стальных цистернах.
Среди других особенностей концентрированной серной кислоты можно отметить следующие. Она способна вытеснять менее сильные или более летучие кислоты (НСl, HNO3, H3PO4, CH3COOH) из их солей:
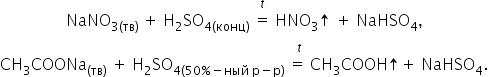
Концентрированная кислота окисляет сложные органические вещества: обугливает бумагу, древесину, кожу, поэтому необходимо крайне осторожное обращение.
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют «контактной» (концентрация 92-94 %).
2SO2 + O2 = 2SO3
H2O + SO3 = H2SO4
{\displaystyle {\mathsf {H_{2}O+SO_{3}=H_{2}SO_{4}}}}
О́леум – это масляный раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. Входит в состав серной кислоты, сера – основной компонент кислоты. Олеум – крайне едкое вещество: оставляет сильные ожоги на коже, быстро разъедает многие материалы, за исключением наименее реакционноспособных. Тем не менее, вследствие эффекта пассивации может храниться в стальных ёмкостях. Олеум нельзя разбавлять водой или выливать его в воду из-за сильно экзотермической реакции. Разбавление олеума производится прибавлением его к серной кислоте. При приливании в воду жидкость закипает, образуя туман из серной кислоты. Применяется в промышленности при производстве серной кислоты, капролактама и многих других веществ. В органической химии применяется как сульфирующий, водоотнимающий или окисляющий реагент.
