
- •1. Предмет и задачи неорганической химии. Роль в системе естественных наук
- •3. Основные стехиометрические законы
- •4. Важнейшие классы и номенклатура неорганических веществ
- •5. Развитие учения о строении атома
- •6. Строение электронных оболочек атомов
- •7. Периодическая система элементов как форма отражения периодического закона
- •8. Периодичность свойств химических элементов
- •9. Основные типы химической связи
- •10. Ковалентная химическая связь. Основные положения метода валентных связей
- •11. Геометрия структур с ковалентным типом связи
- •12. Основы метода молекулярных орбиталей
- •13. Ионная и металлическая связь
- •14. Водородная связь
- •15. Кристаллическое, жидкое и аморфное состояние веществ
- •16. Скорость химических реакций. Константа скорости и ее физический смысл
- •17. Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса
- •18. Влияние катализатора на скорость химической реакции
- •19. Химическое равновение. Принцип Ле-Шаталье
- •20. Основы химической термодинамики. Энтальпия системы
- •21. Понятие об энтропии
- •22. Соотношение между величиной изменения энергии Гиббса и величинами энтропии и энтальпии
- •23. Дисперсные системы. Коллоидные растворы
- •24. Растворимость веществ
- •25. Состав растворов. Способы выражения состава растворов
- •26. Основные положения теории электролитической диссоциации
- •27. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации
- •28. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов
- •29. Основания, кислоты и соли с точки зрения теории электролитической диссоциации
- •30. Обменные реакции в растворах электролитов
- •31. Условия образования и растворения осадков
- •1) Условие выпадения осадка:
- •2) Условие растворения осадка:
- •32. Диссоциация воды. Константа диссоциации, ионное произведение воды
- •33. Гидролиз солей. Механизм гидролиза
- •34. Окислительно-восстановительные реакции. Основные типы окислительно-восстановительных реакций
- •35. Принцип электронного баланса
- •36. Метод полуреакций
- •37. Электрохимические процессы. Эдс гальванического элемента
- •38. Стандартные электродные потенциалы. Уравнение Нернста
- •39. Электрохимический ряд напряженности металлов
- •40. Электролиз водных растворов и расплавов
- •41. Химические процессы, протекающие на электродах
- •42. Основные положения координационной теории
- •43. Строение комплексного соединения
- •44. Устойчивость комплексных соединений
- •45. Водород и его свойства
- •46. Элементы VII а группы. Их характеристика
- •47. Галогены. Общая характеристика галогенов
- •48. Характер химической связи в молекулах галогенов. Их физические и химические свойства
- •49. Галогенводороды. Физические и химические свойства
- •50. Кислородсодержащие соединения галогенов
- •51. Общая характеристика элементов via группы (халькогены)
- •52. Физические свойства халькогенов
- •53. Химические свойства простых веществ (халькогенов)
- •54. Физические и химические свойства гидридов типа h2э в ряду h2o – h2Te
- •55. Соединения кислорода с водородом. Их свойства, общие принципы получения, применение
- •56. Кислые и средние халькогениды. Их свойства, общие принципы получения, применение
- •57. Оксиды халькогенов, их свойства, принципы получения, применение
- •58. Сернистая, селенистая, теллуристая кислоты. Строение, свойства и их солей
- •59. Серная, селеновая, теллуровая кислоты. Строение, свойства и их солей
- •60. Свойства разбавленной и концентрированной серной кислоты. Олеум. Соли и их практическое применение
- •61. Сульфаты и гидросульфаты. Купоросы и квасцы. Их применение
- •62. Полисерные, перексосерные, политионовые кислоты. Химические свойства. Соли и их практическое применение.
- •63. Общая характеристика элементовVa группы.
- •65. Гидриды типа эн3 элементов va группы.
- •66. Аммиак, его физические и химические свойства.
- •67. Оксиды азота, строение их молекул, химические свойства, способы получения, применение.
- •68. Азотистая кислота, ее соли.
- •69. Азотная кислота и ее соли.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •70. Кислородсодержащие соединения фосфора.
- •71. Кислородсодержащие кислоты фосфора и их соли.
- •Метафосфорная кислота
- •Ортофосфорная кислота h3po4
- •Полифосфорная кислота
- •Фосфористая кислота h3po3
- •72. Общая характеристика элементов ivа группы.
- •73. Строение и свойства простых веществ элементов ivа группы
- •74. Гидриды типы эн4 в ряду сн4 – PbH4
- •75. Кислород содержащие соединения углерода
- •76. Угольная кислота и ее соли
- •77. Кислородсодержащие соединения кремния
- •78. Кремневые кислоты и их соли
- •79. Общая характеристика металлов
- •80. Щелочные металлы. Их физические и химические свойства
- •81. Общая характеристика и свойства оксидов, пероксидов, гидроксидов и солей щелочных металлов.
- •82. Щелочноземельные металлы. Общая характеристика элементов. Физические и химические свойства простых веществ.
- •83. Общая характеристика оксидов, гидроксидов, солей элементов iiа группы.
- •84. Алюминий, его физические и химические свойства. Амфотерность алюминия. Алюминаты. Получение алюминия и его солей.
- •85. Металлы ivа группы. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •86. Общая характеристика p- элементов. Физические и химические свойства простых веществ.
- •87. Общая характеристика элементов групп меди и цинка.
- •88. Общая характеристика элементов группы хрома.
- •89. Общая характеристика элементов группы марганца.
- •90. Общая характеристика элементов семейства железа.
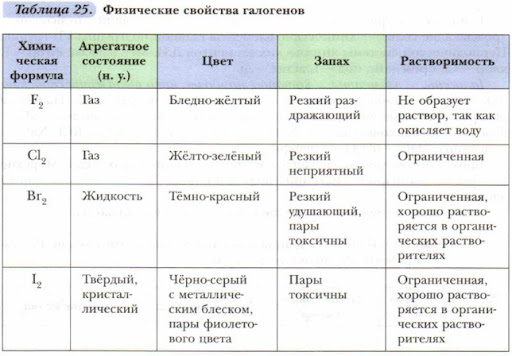
47. Галогены. Общая характеристика галогенов
Электронная конфигурация внешнего энергетического уровня галогенов ns2np5. Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом. Молекулы галогенов двухатомны: F2, Cl2, Br2, I2.
48. Характер химической связи в молекулах галогенов. Их физические и химические свойства
Связь галогенов в бинарных соединениях с типичными металлами (щелочными и щелочноземельными) имеет преимущественно ионный характер. В бинарных соединениях с неметаллами галогены образуют преимущественно ковалентные полярные свзяи.
Фтор – самый электроотрицательный элемент, проявляет степень окисления -1. Газ желтого цвета, при обычных условиях не сжижается, имеет резкий запах, очень ядовит, не взаимодействует с He, Ne, Ar.
Химические свойства:
1) реагирует с водородом в темноте со взрывом (образуется плавиковая кислота)
2) с кислородом
F2 + O2 = 2OF2
3) Вытесняет кислород из воды и оксида кремния
H2O + 2F2 = 4HF + O2
SiO2 + 2F2 = SiF4 + O2
3) галогены могут соединяться между собой, образуя интергалогениды
Хлор – при стандартных условиях желто-зеленый газ с неприятным, удушливым запахом, ядовит. Раствор хлора в воде называется хлорной водой.
Химические свойства:
1) Не реагирует с благородными газами, O2, C, N2
2) С большинством металлов и с остальными неметаллами реагирует с образованием солей
3) Реагирует с водой в зависимости от температуры:
Cl2
+ H2O
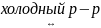 HCl + HClO
HCl + HClO
3Cl2
+ 3H2O
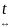 5HCl + HClO3
5HCl + HClO3
4) Реакция со щелочами зависит от температуры:
Cl2
+ 2KOH
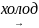 KCl + KClO + H2O
KCl + KClO + H2O
3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
5) Каждый галоген вытесняет другой нижестоящий галоген из его солей
2KBr + Cl2 = 2KCl + Br2
6) Реагирует с угарным газом с образованием фосгена (ядовитый газ удушающего действия)
CO + Cl2 = COCl2
Бром – красно-бурая жидкость, имеет вонючий запах, ядовит, при попадании на кожу вызывает ожоги
Йод – черно-серо-фиолетовые кристаллы, легко возгоняется
2Al
+ 3I2
 2AlI3
2AlI3
49. Галогенводороды. Физические и химические свойства
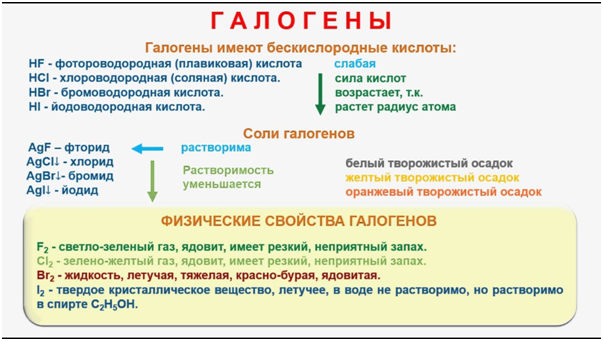
Галогенводороды – это газы с резким запахом, хорошо растворимые в воде, водные растворы которых – кислоты. HF выше 19 градусов – газ, ниже – жидкость (объясняется образованием прочных водородных связей).
Химические свойства:
SiO2 + 4HF = SiF4 + 2H2O
Соляная кислота реагирует с:
1) основными и амфотерными оксидами
4HI+MnO2 = I2+MnI2+2H2O
2) щелочами, слабыми и амфотерными гидроксидами
3) солями, если образуется осадок, газ или слабый электролит
4) металлами, расположенными в электрохимическом ряду до водорода

50. Кислородсодержащие соединения галогенов
Все кислородсодержащие соединения галогенов получены косвенным путем. Наиболее устойчивы соли, меньше – оксиды и кислоты. Для галогенов характерно образование большого числа оксидов, отвечающих различным степеням окисления. Больше всего устойчивых соединений образует хлор. Из соединений кислорода с фтором существует только фторид кислорода OF2. Хлор образует четыре оксида, степень окисления хлора +1, +3, +4, +7; бром – один, степень окисления брома +4, и большое число неустойчивых оксидов; йод – один, степень окисления йода +5. Все оксиды неустойчивы, разлагаются с большим выделением тепла.
Физические свойства и способы получения некоторых оксидов галогенов приведены в таблице:
Соединение |
Агрегатное состояние |
Температура плавления,°С |
Температура кипения,°С |
Получение |
OF2 |
Бесцветный газ |
-224 |
-145 |
2F2 + 2NaOH = OF2 + 2NaF + H2O (при 0°С) |
Cl2O |
Желто-коричневый газ с резким запахом |
-116 |
2 |
3HgO + 2Cl2 = Hg3O2Cl2 + Cl2O |
ClO2 |
Желтый газ |
-60 |
10 |
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + 2ClO2 |
Cl2O7 |
Маслянистая бесцветная жидкость |
-90 |
82 |
2HClO4 + P2O5 = Cl2O7 + 2HPO3 |
Br2O4 |
Бледно-желтые кристаллы |
Разлагается при Ткомн. |
- |
Br2 + O3 Br2O4, Br2O, Br2O3, BrO3 |
I2O5 |
Бесцветные кристаллы |
400 |
- |
2HIO3 = I2O5 + H2O (при 230°С) |
В кислородсодержащих соединениях (оксидах, кислотах, солях) галогены могут проявлять степени окисления +1, +3, +5, +7. Среди кислородных соединений галогенов наибольшее значение имеют кислородные кислоты хлора и их соли.
Кислородные кислоты галогенов значительно менее устойчивы, чем их соли. Среди кислот встречаются неустойчивые, такие, как НВг02 и Нl2, или существующие только в растворах НВгО, НЮ4, НВг04. В ряду НСl – НВгО – Нl уменьшаются кислотные свойства и окислительная активность. Аналогичные тенденции наблюдаются и в рядах кислородных кислот, где галогены проявляют степени окисления +3, +5, +7.
Изменение кислотных и окислительных свойств кислородсодержащих кислот галогенов
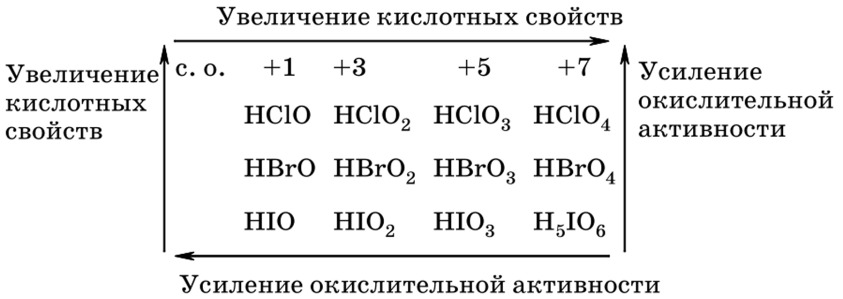
Изменение окислительной активности солей кислородсодержащих кислот галогенов происходит аналогично соответствующим кислотам.
Свойства
НСЮ, НВгО и НЮ — слабые кислоты, НСЮ4 и НВг04 — сильные кислоты. Они обладают всеми свойствами кислот: взаимодействуют с основаниями, металлами, основными оксидами и др.
![]()
Кислородсодержащие кислоты галогенов сильные окислители, особенно НСЮ и НСЮ3.
![]()
Многие кислородсодержащие кислоты галогенов и их соли неустойчивы и разлагаются при комнатной температуре или при нагревании:

Химические свойства
Кислотные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная - к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
HClO3 + NaOH → NaClO3 + H2O
HClO4 + KOH → KClO4 + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.
HClO → HCl + O2
HClO2 → ClO2 + HClO3 + HCl + O2
KClO2 → (t) KClO3 + KCl
KClO2 → KCl + O2
KClO3 → KCl + O2
NaClO3 → (t) NaCl + NaClO4
NaClO3 → (кат.) NaCl + O2↑
Окислительные свойства
KI + HClO → KIO3 + HCl
P + HClO3 → P2O5 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.
KOH + Cl2 → KCl + KClO + H2O
KOH + Cl2 → (t) KCl + KClO3 + H2O
