
МАТЕРИАЛОВЕДЕНИЕ Лабораторный практикум 1
.pdf
При наличии двух степеней свободы (бивариантной системы) существуют различные температуры и концентрации, при которых не изменяется число фаз и равновесие системы. При температуре t1 начинают выделяться кристаллы свинца. Число фаз при этом равно 2 (жидкий расплав и кристаллы свинца), тогда С=2-2+1=1.
В связи с наличием только одной степени свободы (система моновариантна) возможно дальнейшее охлаждение в двухфазной области (Ж+Рв) до температуры t2. Это охлаждение сопровождается дальнейшим образованием из жидкой фазы кристаллов свинца (см. рис. 3.2).
t, C |
|
|
|
|
|
|
540 |
I |
II |
|
|
III |
|
|
Ж |
4 |
Ж |
|
Sв |
|
|
К=2;Ф=1; C=2 |
|
|
|
||
400 |
Ж |
Э (Pв + Sв) |
|
Ж |
||
|
|
|||||
310 |
1 |
Pв |
|
Ж |
Э |
Sв |
|
|
|
|
|
||
tэвт |
2 2 |
3 |
3 |
|
5 5 |
247 |
200 |
Ж |
К=2;Ф=2; C=0 |
|
|
|
|
|
Pв |
К=2; |
|
|
Э |
|
|
Pв |
|
|
|||
100 |
Ф=2; |
|
|
Sв |
||
Э (Pв + Sв) |
|
|
||||
С=1 |
Э (Pв + Sв) |
|
||||
|
Э |
, с |
||||
|
|
|
|
|
||
|
|
|
|
|
|
|
Рисунок 3.2 – Кривые охлаждения для сплавов I, II, III системы свинец-сурьма и схемы структур, образующихся при кристаллизации
При температуре t2 сплав I состоит из кристаллов Рв и жидкости эвтектической концентрации ЖЕ (13 % Sв, 87 % Рв). В момент достижения этой температуры жидкость ЖЕ начинает кристаллизоваться путём одновременного выделения кристаллов свинца и сурьмы. Таким образом, в сплаве I при температуре tэвт (247 С) имеются три фазы: ЖЕ , Рв, Sв. Тогда С=2-3+1=0, т.е. число степеней свободы равно нулю (система нонвариантна). В равновесных условиях невозможно изменение состава фаз и температуры. Следовательно, до тех пор, пока С=0, т.е. одновременно сосуществуют три фазы, температура сплава остаётся постоянной. Кристаллизация жидкости ЖЕ с образованием механической смеси (Sв+ Рв) происходит в течение времени, показанного на рисунке 3.2 горизонтальной площадкой (остановкой на кривой охлаждения 2-2 ).
21
В точке 2 жидкая фаза исчезает: остаются первичные (крупные) кристаллы Рв и мелкокристаллическая смесь кристаллов свинца и сурьмы – эвтектика. Тогда С=2-2+1=1, т.е. число степеней свободы С=1 и возможно дальнейшее охлаждение сплава до комнатных температур без фазовых превращений.
Сплав II в исходном состоянии имеет эвтектическое соотношение компонентов (13 % Sв и 87 % Рв). Выше температуры t3 он однофазен (жидкий расплав); число степеней свободы С=2. Жидкий расплав охлаждается до tэвт . При достижении этой температуры жидкая фаза эвтектическо-
го состава начинает кристаллизоваться, образуя механическую смесь из кристаллов Рв и Sв. При наличии трёх фаз (ЖЕ , Рв, Sв) число степеней свободы равно нулю (С=0). Эвтектическая кристаллизация, как и в сплаве I, происходит при постоянной температуре (площадка 3-3 , рис. 3.2). После конца затвердевания сплав имеет структуру эвтектики, тонкой смеси кристаллов Рв и Sв.
Сплав III, состоящий из 40 % Рв и 60 % Sв, кристаллизуется аналогично сплаву I. Вначале происходит простое охлаждение жидкого расплава до температуры t4 (Ф=1, С=2). В интервале температур t4-t5 (от точки 4, см. рис. 3.2) происходит выпадение кристаллов Sв (Ф=2, С=1).
К моменту достижения температуры tэвт сплав состоит из кристаллов Sв и жидкой фазы эвтектического состава ЖЕ . В точке 5 начинается эвтектическая кристаллизация жидкой фазы с образованием эвтектики. При этом Ф=3 (ЖЕ , кристаллы Рв и Sв), а С=0. До окончания кристаллизации температура остаётся постоянной, что показывается площадкой 5-5 на кривой охлаждения сплава (см. рис. 3.2). После затвердевания в сплаве находятся две фазы: кристаллы Рв и Sв.
Таким образом, в сплавах в концентрационном интервале от Д до С (см. рис. 3.2) имеются три различного типа структуры. В интервале Д-Е (доэвтектические сплавы) структура состоит из Рв +Э; сплав концентрации точки Е (эвтектический) имеет структуру Э (Pв + Sв); сплавы с концентрацией Е -С (заэвтектические) состоят из кристаллов Sв и эвтектики.
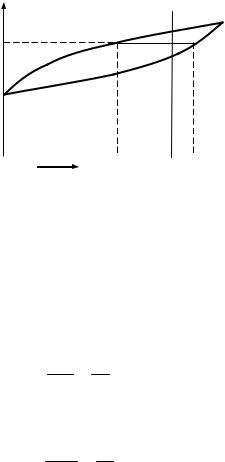
При анализе диаграмм правило отрезков применяется в двух случаях: для нахождения состава фаз в двухфазных областях диаграмм; для определения количественного соотношения фаз.
В первом случае для нахождения состава фаз через точку, характеризующую состояние системы, проводят горизонтальную линию (каноду) до пересечения с линиями, ограничивающими данную область диаграммы состояния. Проекции точек пересечения на ось концентрации показывают состав фаз. В приведённом примере (см. рис. 3.3) для сплава в состоянии точки «d», проведя линию lS , получаем, что состав твёрдой фазы соответствует проекции точки «S», состав жидкой фазы – проекции точки «l».
22
t , С |
|
|
|
|
|
|
t1 |
Ж l |
d |
|
S |
|
|
|
|
Ж+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
l |
d |
|
S |
В |
0 |
%В |
|
|
|
100 % |
|
Рисунок 3.3 – Определение состава и количественного соотношения фаз с помощью правила отрезков
Количественное соотношение фаз обратно пропорционально отрезкам, прилегающим к точкам, определяющим состав этих фаз. В данном примере отношение количества твёрдой фазы Qтв к количеству жидкой фазы Qж обратно пропорционально отношению отрезков ds и dl:
Qтв dl . Qж ds
Если требуется определить долю твёрдой (или жидкой) фазы во всём сплаве, то соотношение будет иметь следующий вид:
Qтв ld . Qспл ls
Применение сплавов обусловливается их структурой и свойствами. Сплавы-смеси применяются в качестве:
литейных, поскольку из-за наличия в их составе эвтектики они обладают хорошей жидкотекучестью;
припоев для пайки; это сплавы, близкие по составу к эвтектическим, они имеют наименьшую для данного сплава температуру плавления;
тепловых предохранителей, поскольку сплавы данных компонентов при любой концентрации имеют одинаковую температуру начала плавления, что обеспечивает точность срабатывания предохранителей при повышении температуры в помещении до заданных значений;
сплавов для изготовления типографских шрифтов, для этих целей применяют доэвтектические сплавы Pв – Sв, они мягкие, пластичные, а присутствующий в виде крупных избыточных кристаллов свинец даёт хороший отпечаток на бумаге;
23
сплавов для подшипников скольжения (баббитов), используют заэвтектические сплавы, состоящие по структуре из мягкой основы – эвтектики и твёрдых включений, например, кристаллов сурьмы в сплавах Pв – Sв, мягкая основа обеспечивает хорошую прирабатываемость подшипника к валу, а твёрдые включения – высокую
износостойкость.
Сплавы-твёрдые растворы применяются в качестве:
коррозионностойких (нержавеющих), что обеспечивается их однофазной структурой;
электросопротивлений, реостатной проволоки (Cu – Ni, Ni – Mn), нагревательных элементов электроприборов (Ni – Cr, Fe – Cr). Высокое электросопротивление имеет место из-за наличия в кристаллической решётке металла – растворителя чужеродных атомов растворённого металла.
Вопросы для самоконтроля
1.Основные сплавы, образующиеся при кристаллизации.
2.Диаграммы состояния сплавов.
3.Основные линии диаграмм состояния сплавов.
4.Закон Гиббса или правило фаз.
5.Правило отрезков и концентраций (правило рычага).
6.Построение кривых охлаждения сплавов с помощью правила фаз.
7.Схемы структур, образующихся при кристаллизации.
8.Эвтектика и эвтектическая реакция.
Лабораторная работа № 4 ИССЛЕДОВАНИЕ ФАЗОВЫХ ПРЕВРАЩЕНИЙ
ПО ДИАГРАММЕ СОСТОЯНИЯ ЖЕЛЕЗО-ЦЕМЕНТИТ
Цель работы: изучение структуры и свойств железоуглеродистых сплавов в равновесном состоянии на основе диаграммы состояния железоуглерод (Fe3C).
Задание
1.Изучить диаграмму состояния железо-цементит.
2.Вычертить диаграмму состояния железо-углерод с указанием структурных составляющих, характерных температурных и концентрационных точек.
3.Охарактеризовать фазы и структурные составляющие сталей и чугунов в равновесном состоянии.
24
4.Рассмотреть под микроскопом, зарисовать и описать микроструктуру углеродистых сталей и серого чугуна.
5.Построить кривую охлаждения для заданной преподавателем концентрации железоуглеродистого сплава с помощью правила фаз.
6.Определить с помощью правила отрезков количественное соотношение фаз заданного сплава при комнатной температуре.
7.Зарисовать и описать микроструктуру сплава при комнатной температуре.
8.Изучить классификацию железоуглеродистых сплавов по структуре в равновесном состоянии. Зарисовать схему.
9.Оформить письменный отчёт по работе.
Общие сведения из теории
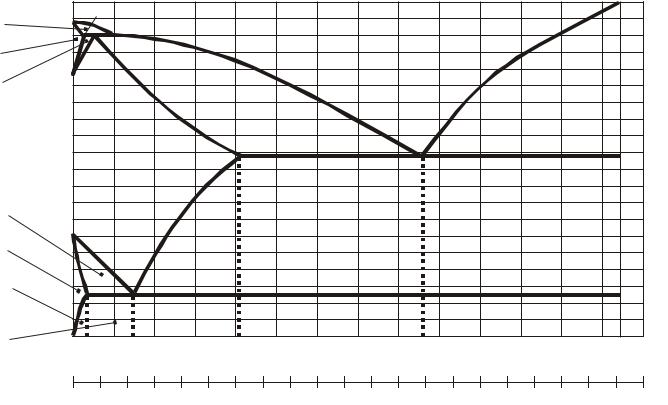
Современная диаграмма Fe -Fe3C представлена на рисунке 4.1, где фазовый состав и структуры сплавов даны для равновесного состояния. Под этим понимается, что фазовые превращения в сплавах закончились и протекали при медленном охлаждении. Диаграмма характеризует фазовый состав и превращения в сплавах с концентрацией углерода от нуля (чистое железо) до цементита (содержание углерода – 6,67 %).
Особенностью диаграммы является наличие на оси концентраций двух шкал, показывающих количество углерода (% С) и цементита (%Fe3C). Это вызвано тем, что в зависимости от внешних условий углерод в равновесии с жидкой фазой и твёрдыми растворами на основе железа может находиться в виде цементита (метастабильное равновесие) и графита (стабильное равновесие). В связи с этим имеется два варианта диаграммы Fe-C: железо-цементит (метастабильная) и железо-графит (стабильная).
Большое практическое значение имеет метастабильная диаграмма, с помощью которой объясняются превращения в сталях и белых чугунах.
Компонентами системы Fe-Fe3C являются железо Fe и цементит
Fe3C. Железо кристаллизуется при температуре 1539 С, в твёрдом состоянии претерпевает полиморфные превращения:
Feα имеет кристаллическую решётку объёмно-центрированного куба и существует при температурах ниже 911 С;
Feγ имеет кристаллическую решётку гранецентрированного куба
исохраняется в интервале температур 911–1392 С;
Feδ имеет кристаллическую решётку объёмно-центрированного
куба, является высокотемпературной модификацией Feα и существует при температурах 1392–1539 С.
При температуре 768 С (точка Кюри) железо меняет магнитное состояние: ниже 768 С – немагнитно (Feβ ).
25
26
Жидкость+ |
1600 |
А H В |
|
|
|
|
|
|
|
|
|
D |
|
|
1539 |
|
|
|
|
|
|
|
|
|
|
||||
феррит |
1500 |
|
|
|
|
|
Жидкость |
|
|
|
|
|
|
|
Феррит |
|
J |
|
|
|
|
|
|
|
|
|
|||
1400 |
|
|
|
|
|
|
|
|
|
|
|
|
||
Феррит+ |
1392 |
|
|
|
|
|
|
|
|
|
|
|
||
аустенит |
1300 |
|
|
Жидкость+ |
|
|
|
|
Жидкость+ |
|
|
|||
|
|
|
|
аустенит |
|
|
|
цементит(первичный) |
|
|||||
|
1200 |
|
|
|
E |
|
1147 |
|
|
С |
|
|
|
|
|
|
|
аустенит |
|
|
|
|
|
F |
|
||||
|
1100 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Аустенит+ |
1000 |
|
|
|
|
аустенит+цементит+ |
|
цементит+ледебурит |
|
|||||
феррит |
900 |
|
G |
|
|
ледебурит |
|
ледебуритэвт(.) |
|
|
|
|
||
Феррит |
|
аустенит+ |
|
|
|
|
|
|
|
|||||
800 |
|
|
|
|
|
|
|
|
|
|||||
Феррит+ |
|
S |
цементит |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
|
(вторичный) |
|
727 |
|
|
|
|
|
|
|
||||
цементит |
700 |
|
P |
цементит+ |
|
|
|
|
|
|
K |
|
||
(третичный) |
|
перлит+цементит+ |
|
цементит+ледебурит |
|
|||||||||
|
|
|
|
перлит |
|
|
ледебурит |
|
|
L |
|
|||
феррит+ |
600 |
|
|
|
|
|
|
|
|
|
|
|||
0 |
0.8 |
1 |
2.14 |
|
3 |
|
4 |
5 |
|
6 |
7%C |
|||
перлит |
|
|
|
|
6.67 |
|||||||||
|
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100%Fe3C |
||
|
|
|
|
4.1 – |
|
|
|
|
|
|
|
- |
|
|
|
|
|
РРиссуунокк А.15Диаграммагрфазовогоммасостоянияостоянсистемыяж лжелезозо-ццементитментит |
|
||||||||||
Второй компонент системы – цементит, он имеет сложную орторомбическую кристаллическую решётку, это химическое соединение железа с углеродом Fe3C, один из карбидов железа.
1. Фазы и структурные составляющие диаграммы
В системе Fe-Fe3C различают в твёрдом состоянии три фазы: феррит, аустенит, цементит и три структурных составляющих: перлит, ледебурит эвтектический и ледебурит превращённый.
Феррит (Ф) – твёрдый раствор внедрения углерода в Feα , при 727 С
может содержать 0,02 % углерода, при комнатной температуре – около 0,01%, пластичный, имеет твёрдость около НВ 60. При растворении в феррите марганца, кремния, фосфора твёрдость повышается до НВ 90. Феррит ферромагнитен до температуры 768 С, является чистым железом, имеет предел прочности примерно 250 МПа.
Аустенит (А) – твёрдый раствор внедрения углерода в Feγ . При
1147 С может содержать до 2,14 % углерода, при 727 С – 0,8 %. Аустенит немагнитен, вязок, имеет твёрдость до НВ 200.
Цементит (Ц) – карбид железа Fe3C, содержит 6,67 % С, хрупкий,
твёрдость НВ 800, слабомагнитный (при 217 С полностью теряет магнитные свойства). Различают цементит первичный, вторичный и третичный. Цементит первичный кристаллизуется из жидкого сплава по линии ДС. Цементит вторичный выпадает из аустенита по линии ES и располагается по границам зёрен перлита. Цементит третичный выделяется из феррита по линии PQ.
Кроме того, в эвтектическом сплаве цементит кристаллизуется (одновременно с аустенитом) из жидкого сплава эвтектической концентрации точки С (4,3 % С), а в эвтектоидном сплаве образуется (одновременно с ферритом) при распаде аустенита эвтектоидного состава точки S (0,8 % С).
Перлит (П) – эвтектоидная смесь феррита и цементита. Образуется из аустенита концентрации точки S при температуре 727 С и содержит 0,8 % С. Перлит может быть пластинчатым и зернистым. Твёрдость зернистого перлита НВ 160–220, а пластинчатого – НВ 200–250.
Ледебурит (Л) – эвтектика, представляет собой механическую смесь цементита и аустенита, предельно насыщенного углеродом. Кристаллизуется ледебурит из жидкого сплава концентрации точки С при температуре
1147 С.
Ледебурит превращённый состоит из цементита первичного и перлита, существует при температуре ниже 727 С, отличается большой твёрдостью (НВ 700) и хрупкостью.
27
2. Построение кривых охлаждения сплавов
Имея диаграмму состояния, можно построить схематическую кривую охлаждения заданного сплава, которая отобразит характер кривой охлаждения, получаемой экспериментально.
Для построения схематической кривой охлаждения заданного сплава на оси концентрации диаграммы состояния находим точку, соответствующую составу сплава, и проводим вертикальную линию.
Вместах пересечения вертикали с линиями диаграммы отмечаем критические точки 1, 2, 3, 4 (рис. 4.2) и проектируем их на ось температур координатной системы «температура-время». При построении схематической кривой следует руководствоваться соображением, что при наличии в системе процессов, сопровождающихся выделением тепла, температура понижается медленнее при одновариантном равновесии или будет температурная остановка при нонвариантном равновесии (с=0). Температура понижается быстрее, если в системе не протекает процессов с выделением тепла.
Вприводимом примере (см. рис. 4.2) охлаждение жидкого сплава происходит быстро, в процессе кристаллизации будет замедление охлаждения, так как тепло кристаллизации компенсирует теплоотдачу в окружающую среду.
После окончания кристаллизации скорость охлаждения увеличивается, температура снова будет понижаться быстро. При выделении вторичной фазы из твёрдого раствора охлаждение замедляется, но не так сильно, как при кристаллизации из жидкого расплава. При эвтектическом, эвтектоидном и перитектическом превращениях в системе из двух компонентов должны быть температурные остановки.
Углы наклона отдельных участков кривой охлаждения должны быть
вследующей зависимости:
ж т т т ж т ,
где ж т – угол наклона участка кривой охлаждения, соответствующего одновариантномуравновесию междутвёрдой и жидкой фазами;т т – угол наклона участка, соответствующего одновариантному равновесию между двумя твёрдыми фазами (скрытая теплота
кристаллизации меньше, чем в предыдущем случае);ж – угол наклона участка, соответствующего двухвариантному рав-
новесию жидкой фазы (происходит только остывание сплава без кристаллизации со скоростью, большей, чем в первых случаях);т – угол наклона участка, соответствующего двухвариантному равновесию твёрдой фазы (остывание твёрдой фазы протекает интенсивнее, чем жидкой, т.е. теплоёмкость первой меньше тепло-
ёмкости второй).
28

t°C |
|
t°C |
|
1 |
|
ж 1 |
|
m |
|
|
|
2 |
n |
ж m |
2 |
А |
Ж+А |
|
|
|
|
|
3 |
A+Fe3CII |
m |
3 |
4 |
|
m m |
4 4 |
P S |
K |
|
m m |
|
C, % |
|
|
Рисунок 4.2 – Построение схематической кривой охлаждения по диаграмме построения
Правильность построения кривой охлаждения проверяется определением вариантности по правилу фаз (С=З – Ф). Для рассмотренного выше заэвтектоидного сплава превращения, происходящие при охлаждении, можно записать так:
с понижением температуры до точки 1 – охлаждение жидкой фазы без фазовых превращений;
|
t1 |
t2 |
|
в равновесии две фазы, С=1, |
от точки 1 до точки 2 Ж A |
m 2 |
|||
|
1 п |
|
|
|
идёт процесс кристаллизации с понижением температуры;
от точки 2 до точки 3 фазовых превращений нет, идёт охлаждение аустенита. Фаза одна, число степеней свободы С=2;
|
|
t3 t4 |
AS |
, из аустенита выделяется |
|
от точки 3 до точки 4 A3 S ЦII |
|||||
|
избыточный углерод, в равновесии две фазы (А и ЦII ), число сте- |
||||
|
пеней свободы равно 1; |
t4 |
|
|
|
|
от точки 4 до точки 4 |
ЦII |
, в равновесии три фазы |
||
AS Фр |
|||||
|
|
|
|
||
перлит
(А, Ф, Ц), число степеней свободы С=0, образование перлита происходит при постоянной температуре (727 С), это эвтектоидное превращение.
29
Структура сплава при температурах ниже точки 4 будет состоять из цементита (вторичного) и перлита, фазы две (Ф, Ц), С=1, при понижении температуры системы уменьшается без фазовых превращений.
3. Структура железоуглеродистых сплавов в равновесном состоянии
Основой для определения структурных составляющих сталей и белого чугуна в равновесном состоянии является диаграмма Fe-Fe3C. Структура сплавов при этом зависит от содержания в них углерода.
Взависимости от содержащихся в сплавах структур их делят на три основных класса.
К первому классу относятся низкоуглеродистые сплавы с ферритной структурой (при содержании углерода до 0,01 %), а при концентрациях углерода от 0,01 до 0,02 % С – со структурой из феррита и цементита (третичного), располагающегося по границам зёрен феррита.
Втехнике применяют так называемые технические сорта чистого железа, имеющие название железо Армко и содержащие до 0,015 % углерода.
Ко второму классу относятся сплавы, у которых в качестве основной структурной составляющей присутствует перлит, т.е. стали. При содержании углерода в стали до 0,8 % она называется доэвтектоидной, а структура её состоит из феррита и перлита. Количество перлита увеличивается, а феррита уменьшается пропорционально возрастанию содержания углерода. Эвтектоидная сталь содержит 0,8 % углерода, а структура её состоит из чистого перлита. При содержании углерода более 0,8 % сталь называется заэвтектоидной, структура её состоит из перлита и цементита вторичного. Перлит представляет собой механическую смесь цементита в виде мелких пластинок или зёрнышек, расположенных в ферритной основе. Перлит первой разновидности называют пластинчатым, а второй – зернистым. Цементит в заэвтектоидных сталях обычно расположен в виде светлой сетки или в виде светлых вытянутых зёрен (цепочки) по границам зёрен перлита. Толщина цементитной сетки по границам перлитных зёрен равномерная.
Для третьего класса железоуглеродистых сплавов (2,14–6,67 % С) характерной структурной составляющей является ледебуритная эвтектика. Этот класс сплавов составляют чугуны.
Углерод в чугуне может быть в связанном состоянии – в карбидах и
всвободном – в виде графитовых включений различной формы. В зависимости от этого различают чугуны:
белый, в нём весь углерод находится в связанном состоянии в виде карбидов, излом чугуна имеет характерный блестящий, белый цвет;
серый, большая часть углерода в нём находится в свободном состоянии в виде графита, имеющего пластинчатую форму;
30
