
- •Часть 2. Кислородсодержащие классы органических соединений
- •Омск – 2016
- •Кандидат биологических наук, доцент и.В. Конева – доцент кафедры математических и естественнонаучных дисциплин фгбоу впо ОмГау им. П.А. Столыпина
- •Предисловие
- •Основные положения протонной теории кислот и оснований:
- •Факторы, влияющие на кислотные свойства органических соединений
- •1. Природа элемента в кислотном центре
- •2. Стабильность аниона за счёт сопряжения
- •3. Влияние радикала на стабильность аниона
- •4. Влияние растворителя на стабильность аниона
- •Гидроксисоединения
- •Классификация спиртов
- •I. По количеству –он групп спирты:
- •Классификация фенолов по количеству –он групп
- •Химические свойства спиртов
- •2. Реакция нуклеофильного замещения (sn).
- •Химические свойства фенолов
- •3. Реакция нитрования фенола:
- •4. Реакция сульфирования фенола: (sе )
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2. Карбонильные соединения
- •Химические свойства
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Электронные образовательные ресурсы
- •1.3 Карбоксильные соединения. Карбоновые кислоты. Гидроксикислоты. Кетонокислоты
- •I. По количеству карбоксильных групп
- •1. Одноосновные (монокарбоновые) кислоты:
- •2. Поликарбоновые кислоты, содержащие две или более
- •II. В зависимости от наличия младших функциональных групп в радикале карбоновой кислоты
- •1. Гидроксикислоты, содержащие группу –он:
- •Строение карбоксильной группы
- •Химические свойства карбоновых кислот
- •Реакции галогенирования (реакции в сн-кислотном центре):
- •Пути превращения ацетоуксусной кислоты в организме:
- •Медико-биологическое значение карбоновых кислот
- •Контрольные вопросы
- •Типовые задания
- •Кислота, дихлоруксусная кислота, уксусная кислота.
- •Тестовые задания для самоконтроля Выберите один правильный ответ
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Контрольная работа «кислородсодержащие классы органических веществ» Контрольные вопросы
- •Типовые задания вариант билета рубежной контрольной работы «кислородсодержащие классы органических соединений».
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант билета зачетной работы Билет № 1
- •В пятибалльную систему оценки зачетной работы
- •Заключение
- •Глоссарий
- •Ответы на тестовые задания
- •Литература Основная литература
- •Дополнительная литература
- •Приложения
Химические свойства фенолов
1. Реакции окисления фенолов
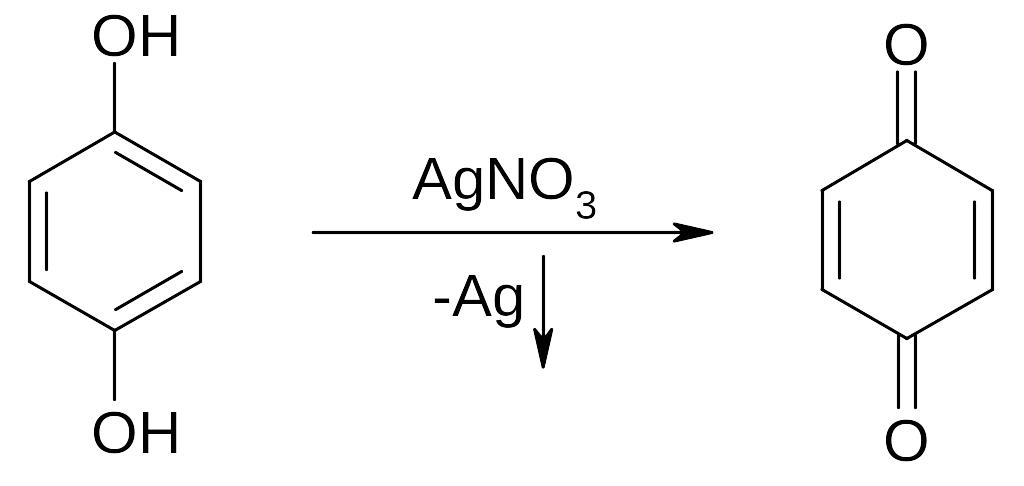
Гидрохинон Хинон
восстановленная форма окисленная форма
Окислительно-восстановительные свойства системы хинон-гидрохинон играют важную роль в организме. Эта система участвует в переносе протонов и электронов от окисляемого субстрата (белок, жир, углевод) к кислороду в процессе биологического окисления.
2. Реакции электрофильного замещения: (SЕ )
C6Н6 + Е+ С6Н5Е + Н+
Субстрат реагент продукт электрофуг
(электрофил)
Рассмотрим механизм реакции электрофильного замещения на примере реакции нитрования фенола:
а) образование электрофила (NO2+) – нитроил-катиона:
HNO3 + 2 H2SO4 NO2+ + 2 HSO4- + H3O+
б) реакция электрофила NO2+ с фенолом:
С6Н5ОН + NO2+ C6H6NO2+ C6H6NO2 C6H5NO2
Субстрат реагент -комплекс -комплекс продукт
электрофил
Образование -комплекса электрофила и бензола происходит за счёт пары электронов сопряжённой системы. Преобразование -комплекса в -комплекс сопровождается нарушением ароматичности и переходом атома углерода в состояние sp3-гибридизации. При отщеплении протона от -комплекса ароматичность восстанавливается и образуется продукт реакции нитробензол.
К реакциям электрофильного замещения относятся реакции нитрования, сульфирования фенола и другие.
3. Реакция нитрования фенола:
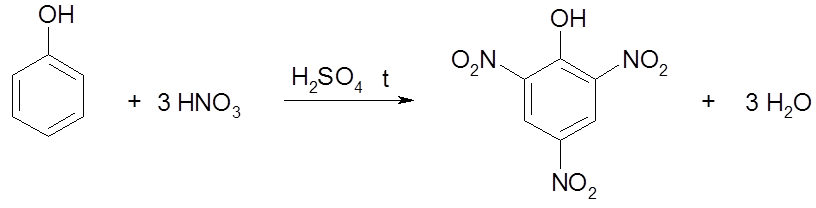
фенол 2,4,6-тринитрофенол
4. Реакция сульфирования фенола: (sе )
С6Н5ОН + 3 НО--SO3Н+ C6H2(SO3Н)3 + 3H2O
Фенол реагент 2,4,6-трисульфофенол
электрофил
Контрольные вопросы
1. Протолитическая (протонная) теория кислот и оснований (теория Бренстеда-Лоури). Основные положения теории.
2. Факторы, влияющие на кислотные свойства органических соединений (строение и природа атома в кислотном центре, стабилизации аниона за счет сопряжения, характер заместителя, связанного с кислотным центром, эффект сольватации).
3. Спирты. Классификация, номенклатура, изомерия, медико-биологическое значение.
4. Реакционная способность спиртов. Реакции окисления. Реакции нуклеофильного замещения (SN). Реакции хелатообразования многоатомных спиртов.
5. Фенолы. Классификация, номенклатура, изомерия, медико-биологическое значение.
6. Реакционная способность фенолов. Реакции электрофильного замещения (SE) с участием ароматической системы. Ориентирующее влияние заместителей в ароматическом ядре на реакционную способность в реакциях электрофильного замещения (нитрование и сульфирование фенола).
Типовые задания
Задание 1. Расположите следующие кислоты Брёнстеда: этанол, бутанол, глицерин, фенол, уксусная кислота – в порядке убывания их кислотности в водном растворе.
Решение. В данной задаче предлагается сравнить кислотность трех классов органических соединений: спиртов, фенолов, карбоновых кислот. Данные соединения являются ОН- кислотами:
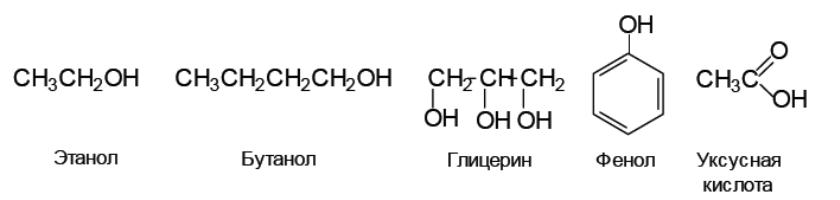
Значит, основными факторами, определяющим стабильность аниона, являются – влияние заместителя и влияние растворителя. Для сравнительной оценки кислотности предложенных соединений следует рассмотреть стабильность соответствующих анионов.

Фенолы
являются более сильными кислотами по
сравнению с алифатическими спиртами
из-за большей стабильности феноксид-иона,
в котором отрицательный заряд
делокализуется с участием атомов
углерода бензольного кольца
(р,![]() -сопряжения).
-сопряжения).
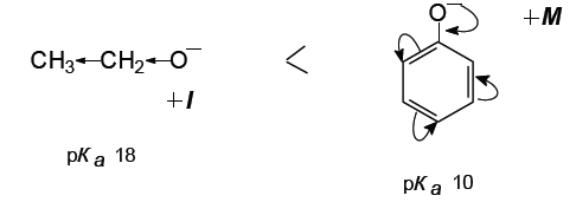
Карбоновые кислоты являются более сильными кислотами по сравнению с фенолами за счет стабилизации карбоксилат-иона, в котором отрицательный заряд за счет р, -сопряжения распределен поровну между двумя атомами кислорода:
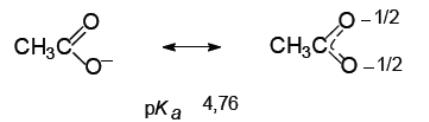
Сравним силу кислотных свойств в ряду различных спиртов, основываясь на стабильности соответствующих анионов:

Глицерин является более сильной кислотой по сравнению с этанолом, так как глицерат-ион является более стабильным, чем этоксид-ион, за счет наличия в глицерине двух электроноакцепторных гидроксильных групп (–I-эффект), которые способствуют делокализации отрицательного заряда.
Этанол является более сильной кислотой, чем бутанол, так как небольшой по размеру этоксид-ион лучше сольватирован по сравнению с бутоксид-ионом:
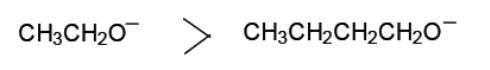
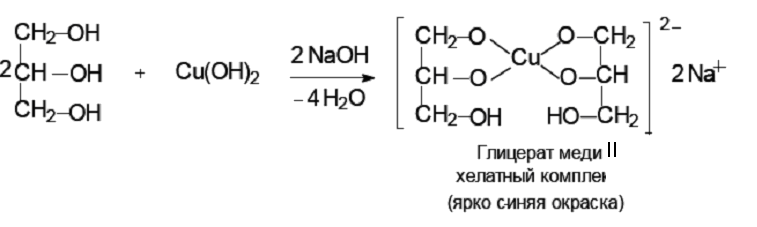
Спирты, как слабые кислоты, не реагируют с гидроксидами металлов. Однако спирты способны реагировать со щелочными металлами:

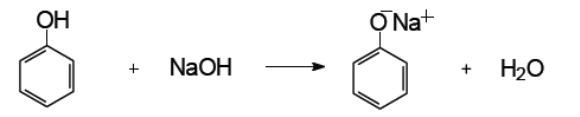
Фенолы в целом более сильные кислоты, чем спирты, реагируют со щелочами:
Карбоновые кислоты обладают более сильными кислотными свойствами, чем спирты и фенолы. Они могут взаимодействовать не только с гидроксидами металлов, но и с солями слабых кислот:

Кислотные свойства предложенных соединений возрастают в следующем порядке:
уксусная кислота > фенол > глицерин > этанол > бутанол
Задание 2. Объясните различное отношение первичных, вторичных и третичных спиртов к окислению.
Решение. Окисление происходит вследствие переноса электронов от молекулы спирта к реагенту-окислителю. При этом происходит удаление из молекулы спирта атомов водорода.
Отношение
спиртов к окислению определяется
наличием или отсутствием атома водорода
у
![]() -углеродного
атома. Первичные спирты окисляются в
альдегиды, вторичные – в кетоны; третичные
спирты, у которых
-углеродный
атом не связан с атомом водорода,
устойчивы к окислению.
-углеродного
атома. Первичные спирты окисляются в
альдегиды, вторичные – в кетоны; третичные
спирты, у которых
-углеродный
атом не связан с атомом водорода,
устойчивы к окислению.
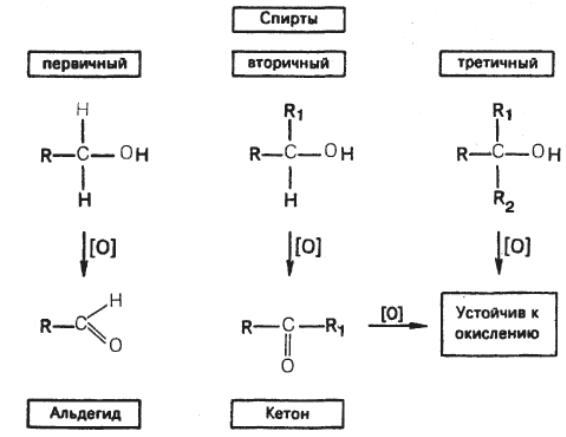
В лабораторных условиях для окисления спиртов используют хромовую кислоту Н2СrО4 из хромовой смеси (К2Сг2О7 + H2SO4). При этом Cr+6 восстанавливается до Cr+3.

Образующиеся при окислении первичных спиртов альдегиды очень легко окисляются в кислоты. Для окисления альдегидов используют мягкие окислители – аммиачный раствор оксида серебра, раствор гидроксида меди (II). С помощью этих окислителей проводят качественные реакции на альдегидную группу.
In vivo первичные и вторичные спирты соответственно окисляются до альдегидов и кетонов при участии ферментов дегидрогеназ (оксидоредуктаз), коферментом которых является никотинамидадениндинуклеотид (NAD+/ NAD·H).
Задание 3. Объясните, как осуществить нитрование фенола до пикриновой кислоты.
Решение. Фенол при взаимодействии с разбавленной азотной кислотой при комнатной температуре образует смесь орто- и пара-нитрофенолов, которая легко разделяется перегонкой с паром вследствие более высокой летучести opmo-изомера, образующего внутримолекулярную водородную связь:
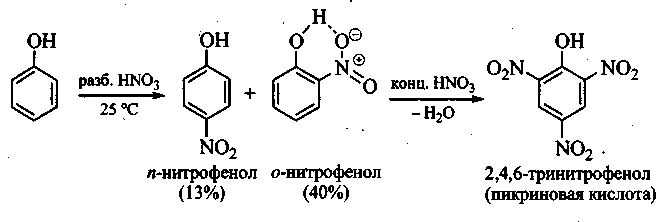
Дальнейшим нитрованием смеси действием конц. HNO3 можно получить пикриновую кислоту, о которой шла речь в предыдущей главе. Прямое нитрование фенола с помощью конц. HNO3 осложняется его окислением. Для сравнения: нитрование бензола возможно только конц. HNO3 или смесью конц. НNО3 и конц. H2SO4.
