
- •Часть 2. Кислородсодержащие классы органических соединений
- •Омск – 2016
- •Кандидат биологических наук, доцент и.В. Конева – доцент кафедры математических и естественнонаучных дисциплин фгбоу впо ОмГау им. П.А. Столыпина
- •Предисловие
- •Основные положения протонной теории кислот и оснований:
- •Факторы, влияющие на кислотные свойства органических соединений
- •1. Природа элемента в кислотном центре
- •2. Стабильность аниона за счёт сопряжения
- •3. Влияние радикала на стабильность аниона
- •4. Влияние растворителя на стабильность аниона
- •Гидроксисоединения
- •Классификация спиртов
- •I. По количеству –он групп спирты:
- •Классификация фенолов по количеству –он групп
- •Химические свойства спиртов
- •2. Реакция нуклеофильного замещения (sn).
- •Химические свойства фенолов
- •3. Реакция нитрования фенола:
- •4. Реакция сульфирования фенола: (sе )
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2. Карбонильные соединения
- •Химические свойства
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Электронные образовательные ресурсы
- •1.3 Карбоксильные соединения. Карбоновые кислоты. Гидроксикислоты. Кетонокислоты
- •I. По количеству карбоксильных групп
- •1. Одноосновные (монокарбоновые) кислоты:
- •2. Поликарбоновые кислоты, содержащие две или более
- •II. В зависимости от наличия младших функциональных групп в радикале карбоновой кислоты
- •1. Гидроксикислоты, содержащие группу –он:
- •Строение карбоксильной группы
- •Химические свойства карбоновых кислот
- •Реакции галогенирования (реакции в сн-кислотном центре):
- •Пути превращения ацетоуксусной кислоты в организме:
- •Медико-биологическое значение карбоновых кислот
- •Контрольные вопросы
- •Типовые задания
- •Кислота, дихлоруксусная кислота, уксусная кислота.
- •Тестовые задания для самоконтроля Выберите один правильный ответ
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Контрольная работа «кислородсодержащие классы органических веществ» Контрольные вопросы
- •Типовые задания вариант билета рубежной контрольной работы «кислородсодержащие классы органических соединений».
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант билета зачетной работы Билет № 1
- •В пятибалльную систему оценки зачетной работы
- •Заключение
- •Глоссарий
- •Ответы на тестовые задания
- •Литература Основная литература
- •Дополнительная литература
- •Приложения
Классификация фенолов по количеству –он групп
1. Одноатомные фенолы, содержащие одну –ОН группу (Аr-ОН).
С6Н5ОН – фенол (карболовая кислота) применяется в медицине как антисептическое средство, используется для приготовления лекарственных веществ, красителей и др.

2. Многоатомные фенолы, содержащие две и более –ОН групп.
а) Резорцин С6Н5(ОН)2. Применяется в виде водных и спиртовых растворов для лечения кожных и инфекционных заболеваний. Смесь насыщенного резорцина и формалина (40% раствор) применяется в стоматологии для пломбирования корневых зубных каналов.
б) Гидрохинон С6Н5(ОН)2. В организме является участником важного процесса – транспорта электронов от окисляемого субстрата к кислороду, участвует в биологическом окислении.
в) Пирокатехин С6Н5(ОН)2. Структурный компонент многих биологически активных соединений, в частности, катехоламинов, к которым относится адреналин. Это гормон мозгового вещества надпочечников. Участвует в регуляции сердечной деятельности, обмена углеводов. При физиологических стрессах выделяется в кровь «гормон страха».
У многоатомных фенолов проявляется структурная изомерия положения –ОН групп.
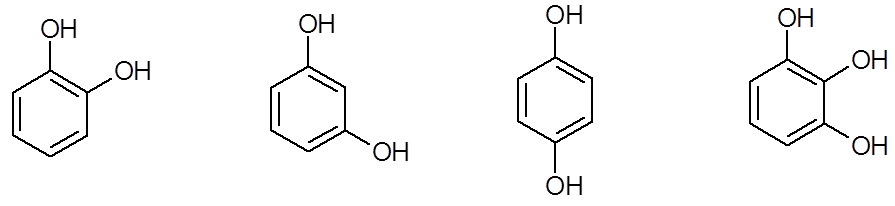
пирокатехин резорцин гидрохинон пирогаллол
Химические свойства спиртов
1. Окисление спиртов. Спирты подвергаются окислению in vitro под действием окислителей, например, К2Сr2O7, in vivo под действием ферментов, которые носят название дегидрогеназы. При этом происходит дегидрирование спирта. Субстрат (спирт) теряет два атома водорода. Это эквивалентно потере двух электронов и двух протонов водорода.
а) окисление первичных спиртов до альдегидов:
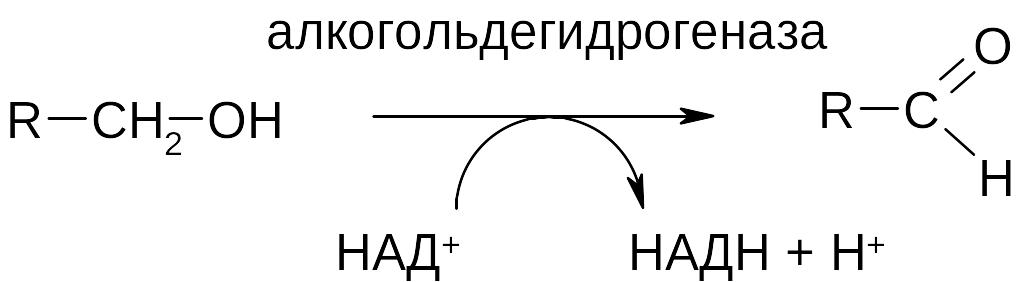
б) окисление вторичных спиртов до кетонов:
Пропанол-2 + НАД+ Пропанон + НАДН + Н+
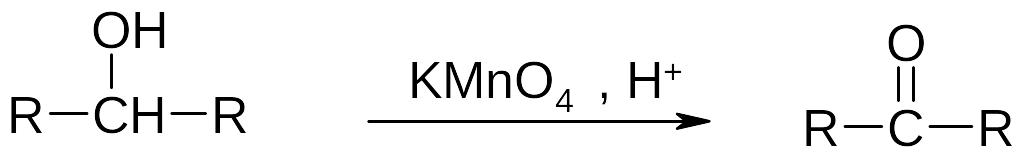
Таким образом, при окислении первичных спиртов образуются альдегиды, а вторичных – кетоны.
2. Реакция нуклеофильного замещения (sn).
В ходе реакции нуклеофильного замещения атакующий реагент (нуклеофил) отдаёт субстрату свою пару электронов, за счёт которой образуется связь между атомом углерода субстрата и нуклеофилом, а уходящая группа (нуклеофуг) отщепляется со своей парой электронов.
-C-Х + Y: → С-Y + X:
субстрат реагент–нуклеофил
Рассмотрим реакцию нуклеофильного замещения на примере получения хлорэтана из этанола:
СН3 – СН2 – ОН + НCl → СН3 - СН2 – Сl + Н2О
Поскольку –ОН группа в молекуле субстрата (этанол) является плохо уходящей группой, то прямое нуклеофильное замещение осуществить не удается. Поэтому производят преобразование плохо уходящей группы в хорошо уходящую группу. Для этого в субстрате уходящую группу –ОН (нуклеофуг) переводят в ион оксония в присутсвии Н+, чтобы она отщепилась в виде нейтральной молекулы. При этом образуется промежуточный ион этилоксония, от которого отщепляется молекула воды – хорошо уходящая группа. Реагент (нуклеофил) присоединяется за счёт своей пары электронов к атому водорода субстрата. Так получается хлорэтан, применяемый в медицине для ингаляционного наркоза.
3. Реакции дегидратации
а) Внутримолекулярная дегидратация с образованием алкенов:
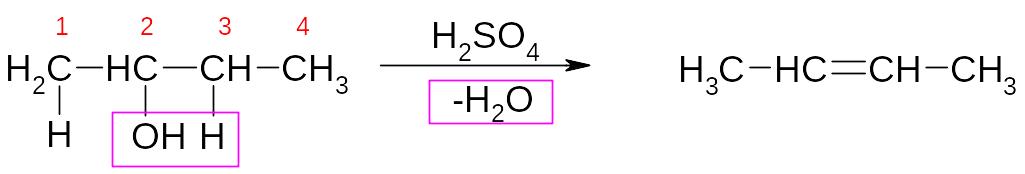
бутанол-2 бутен-2
б
<140

этанол диэтиловый эфир
4. Реакция этерификации с образованием сложных эфиров
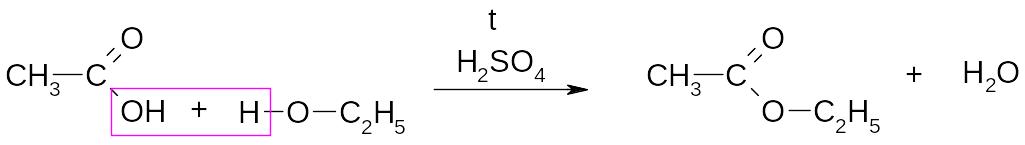
уксусная кислота этанол этилацетат
5. Качественная реакция на многоатомные спирты
Многоатомные спирты, проявляя более выраженные кислотные свойства по сравнению с одноатомными спиртами, вступают в реакцию с гидроксидом меди(II) – осадком голубого цвета в щелочной среде с образованием растворимого хелатного комплекса ярко-синего цвета:
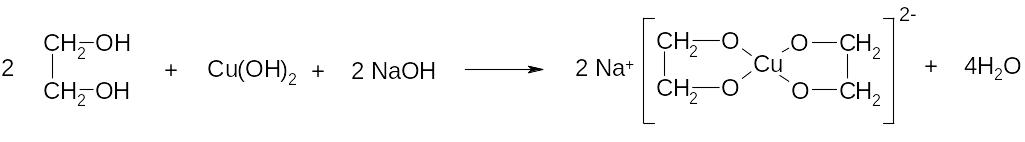
этиленгликоль анионный хелатный комплекс
этиленгликолята меди (II)
