
- •Часть 2. Кислородсодержащие классы органических соединений
- •Омск – 2016
- •Кандидат биологических наук, доцент и.В. Конева – доцент кафедры математических и естественнонаучных дисциплин фгбоу впо ОмГау им. П.А. Столыпина
- •Предисловие
- •Основные положения протонной теории кислот и оснований:
- •Факторы, влияющие на кислотные свойства органических соединений
- •1. Природа элемента в кислотном центре
- •2. Стабильность аниона за счёт сопряжения
- •3. Влияние радикала на стабильность аниона
- •4. Влияние растворителя на стабильность аниона
- •Гидроксисоединения
- •Классификация спиртов
- •I. По количеству –он групп спирты:
- •Классификация фенолов по количеству –он групп
- •Химические свойства спиртов
- •2. Реакция нуклеофильного замещения (sn).
- •Химические свойства фенолов
- •3. Реакция нитрования фенола:
- •4. Реакция сульфирования фенола: (sе )
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2. Карбонильные соединения
- •Химические свойства
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Электронные образовательные ресурсы
- •1.3 Карбоксильные соединения. Карбоновые кислоты. Гидроксикислоты. Кетонокислоты
- •I. По количеству карбоксильных групп
- •1. Одноосновные (монокарбоновые) кислоты:
- •2. Поликарбоновые кислоты, содержащие две или более
- •II. В зависимости от наличия младших функциональных групп в радикале карбоновой кислоты
- •1. Гидроксикислоты, содержащие группу –он:
- •Строение карбоксильной группы
- •Химические свойства карбоновых кислот
- •Реакции галогенирования (реакции в сн-кислотном центре):
- •Пути превращения ацетоуксусной кислоты в организме:
- •Медико-биологическое значение карбоновых кислот
- •Контрольные вопросы
- •Типовые задания
- •Кислота, дихлоруксусная кислота, уксусная кислота.
- •Тестовые задания для самоконтроля Выберите один правильный ответ
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Контрольная работа «кислородсодержащие классы органических веществ» Контрольные вопросы
- •Типовые задания вариант билета рубежной контрольной работы «кислородсодержащие классы органических соединений».
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант билета зачетной работы Билет № 1
- •В пятибалльную систему оценки зачетной работы
- •Заключение
- •Глоссарий
- •Ответы на тестовые задания
- •Литература Основная литература
- •Дополнительная литература
- •Приложения
Химические свойства карбоновых кислот
В карбоновых кислотах выделяют 4 реакционных центра:
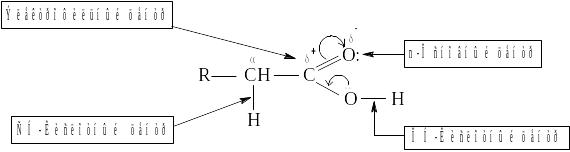
ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения;
СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
В карбоновых кислотах частичный положительный заряд на карбонильном атоме углерода меньше, чем в альдегидах и кетонах, поэтому кислота менее активна к восприятию атаки нуклеофильного реагента. Соответственно, реакции нуклеофильного присоединения более характерны для альдегидов и кетонов.
1. Реакции диссоциации (в «OH»-кислотном центре):
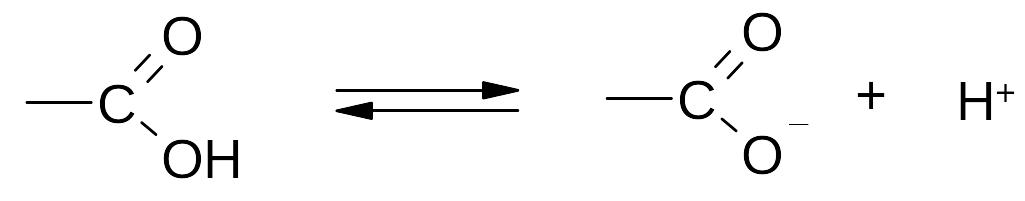
. Образование солей:
1) С активными металлами:
2 CH3COOH + Mg → (CH3COO)2Mg + H2
2) С основными оксидами:
2 CH3COOH + CaO → (CH3COO)2Ca + H2O
3) Со щелочами (реакция нейтрализации):
CH3COOH + NaOH → CH3COONa + H2O
4) С солями более слабых кислот:
CH3COOH + NaHCO3 → CH3COONa + CO2 ↑+ H2O
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 ↑+ H2O
Эти реакции используются как качественные на карбоксильную группу (по выделению пузырьков CO2).
Образование солей дикарбоновыми кислотами:
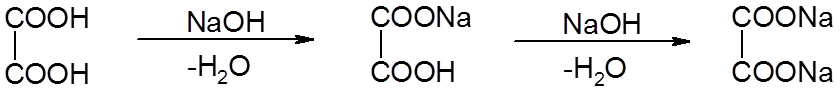
![]()
оксалат кальция
Около 80% почечных камней образуется из оксалата кальция.
Образование солей гидроксикислотами:

молочная кислота лактат кальция
Лактат кальция используется в медицине как кальциевый препарат.
Реакции галогенирования (реакции в сн-кислотном центре):
CH3 – CH2 – COOH + Br2 → CH3 – CH(Br) – COOH + HBr
α-бромпропионовая кислота
4. Реакции декарбоксилирования – реакции, в ходе которых происходит удаление углекислого газа из карбоксильной группы, приводящее к разрушению карбоксильной группы.
1) In vitro pеакции декарбоксилирования протекают при нагревании.
HOOC – COOH → HCOOH + CO2
щавелевая кислота муравьиная кислота
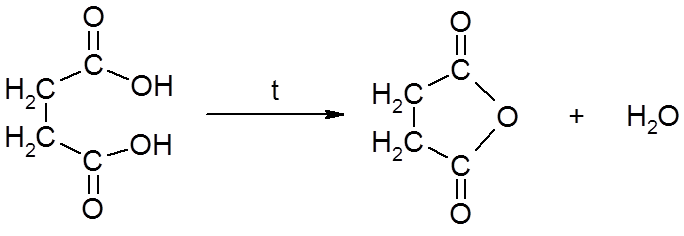
янтарная кислота ангидрид янтарной кислоты
2) In vivo реакции декарбоксилирования протекают с участием ферментов-декарбоксилаз (наибольшее значение имеют реакции декарбоксилирования гидрокси-, оксо-, аминокислот).
Пример: декарбоксилирование яблочной кислоты.
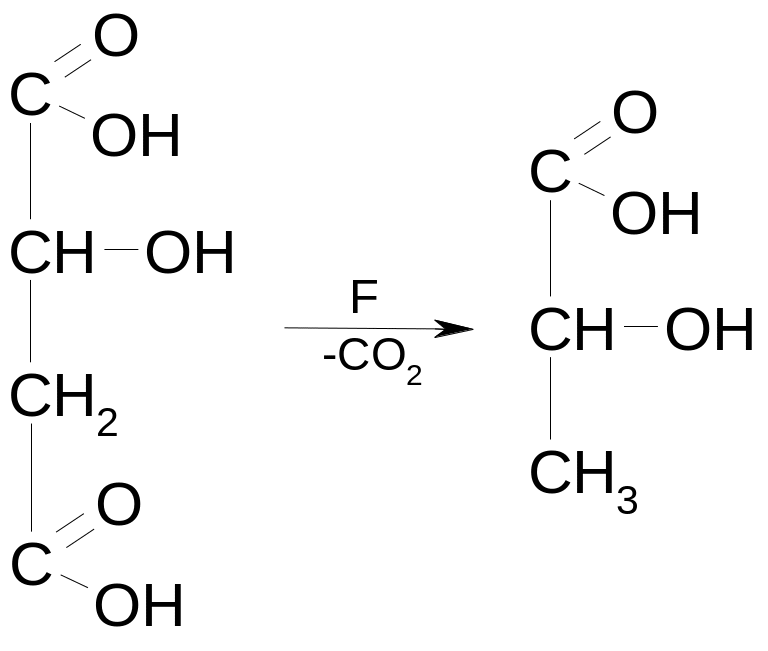
3) В организме также протекает окислительное декарбоксилирование, в частности, ПВК в митохондриях. С участием декарбоксилазы, дегидрогеназы и кофермента А (S-KoA). [ПВК= этаналь+ углекислый газ = ацетил-Ко-А+ НАДН+ Н+]
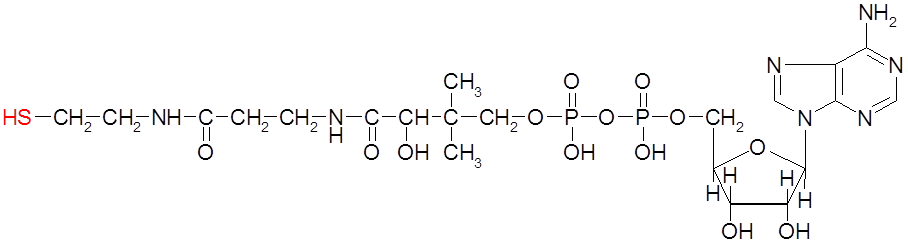
Ацетил-КоА, будучи активным соединением, вовлекается в цикл Кребса.
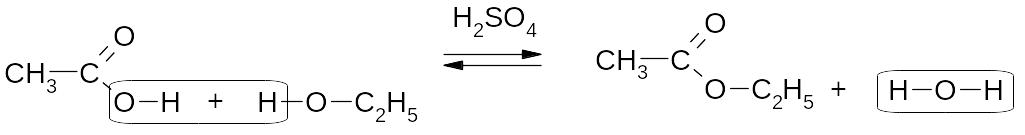
5. Реакции этерификации – нуклеофильного замещения (SN) у sр2-гибридизованного атома углерода:
6. Реакции окисления
Окисление гидроксикислот протекает аналогично окислению вторичных спиртов с участием ферментов-дегидрогеназ.
1) Окисление молочной кислоты до пировиноградной кислоты:
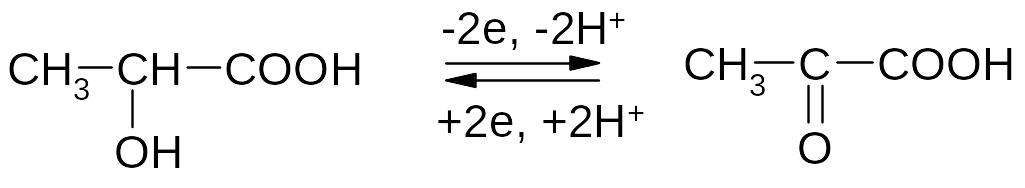
2) Окисление яблочной кислоты до щавелевоуксусной кислоты:
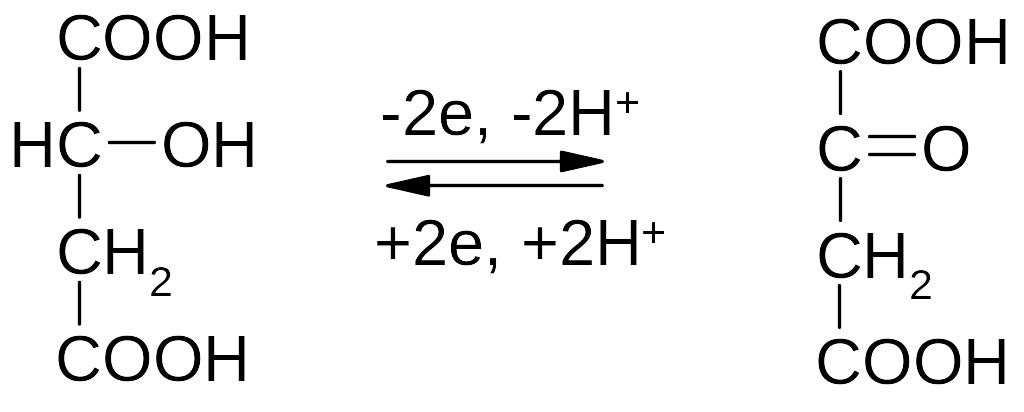
3) Окисление β-гидроксимасляной кислоты до ацетоуксусной кислоты:
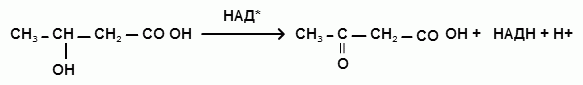
[β-гидроксимасляная кислота = ацетоуксусная кислота + НАДН + Н+]
Таким образом, при окислении гидроксикислот с участием ферментов-дегидрогеназ образуются кетонокислоты.
