- •Введение
- •1. Нервная система: общая характеристика
- •1.1. Центральная нервная система
- •1.2. Вегетативная нервная система
- •Сравнение симпатической системы с парасимпатической системой
- •Симпатическая и парасимпатическая системы: эффекты в организме
- •1.3. Нейроны
- •1.4. Синаптическая передача нервного импульса
- •Медиаторы в центральной и периферической
- •Пептиды в центральной и периферической
- •1.5. Холинергические синапсы
- •Никотиновые холинорецепторы
- •1.6. Адренергические синапсы
- •1.7. Дофаминергические синапсы
- •1.8. Серотонинергические синапсы
- •1.9. Гистаминовые синапсы
- •Гистаминовые рецепторы
- •1.10. Глутаматергические синапсы
- •Глутаматные ионотропные рецепторы
- •1.11. Гамк-ергические синапсы
- •1.12. Глицинергические синапсы
- •1.13. Принцип Дейла
- •1.14. Электрический синапс
- •2. Нейромедиаторы
- •2.2. Глицин
- •Свойства глицина
- •Получение
- •Биологическая роль
- •2.3. Глутаминовая кислота
- •Свойства глутаминовой кислоты
- •Патологии, связанные с глутаматом
- •Содержание глутамата в пище
- •2.4. Адреналин
- •Характеристика адреналина:
- •Побочное действие
- •2.5. Норадреналин
- •Свойства норадреналина
- •2.6. Дофамин
- •Свойства дофамина
- •2.7. Серотонин
- •Свойства серотонина
- •2.8. Гистамин
- •Свойства гистамина
- •Характеристика гистаминовых рецепторов
- •2.9. Ацетилхолин
- •Свойства ацетилхолина
- •2.10. Аспарагиновая кислота
- •Свойства аспарагиновой кислоты
- •2.11. Анандамид
- •Свойства анандамида
- •2.12. Аденозинтрифосфат
- •Свойства аденозинтрифосфата
- •Ингибиторы окислительного фосфорилирования
- •Стадии цикла Кребса
- •2.12. Вазоактивный интестинальный пептид
- •2.13. Окситоцин
- •2.14. Таурин
- •Характеристика таурина
- •2.15. Триптамин
- •Характеристика триптамина
- •Производные триптамина
- •2.16. Эндоканнабиноиды
- •Основные типы каннабиноидов
- •Свойства n-ацетиласпартилглутамата
- •3. Сенсорные системы
- •Характеристика рецепторов
- •Рецепторы человека Рецепторы кожи
- •3.1. Зрительная сенсорная система
- •Количество неперекрестных и перекрестных волокон в зрительном нерве у ряда млекопитающих
- •3.2. Слуховая сенсорная система
- •3.3. Вкусовая сенсорная система
- •3.4. Соматосенсорная система
- •3.5. Обонятельная сенсорная система
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
1.5. Холинергические синапсы
Ацетилхолин образуется в нервной терминали из холина и ацетил-коэнзима А под действием холинацетилтрансферазы. После экзоцитоза ацетилхолин взаимодействует с постинаптическими рецепторами (рис. 20).
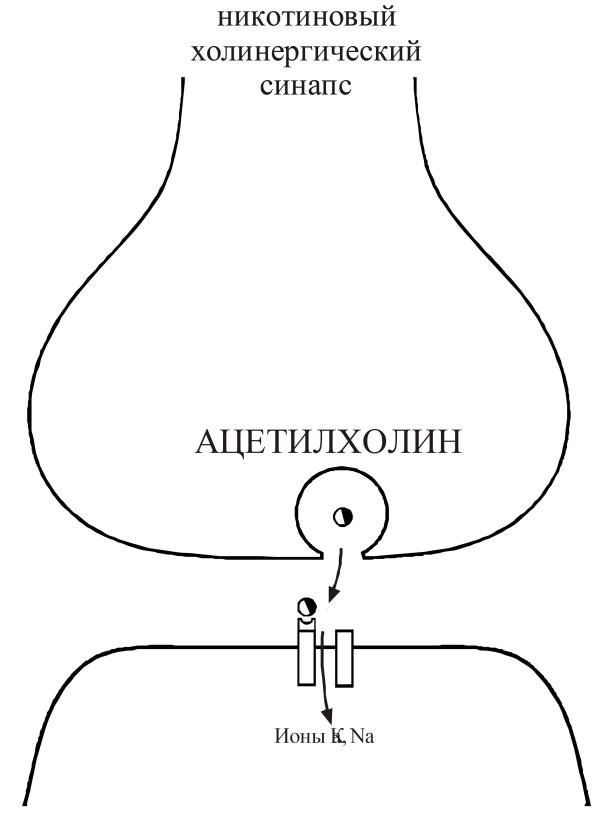
Рис. 20. Молекулярные механизмы в никотиновых холинергических синапсах. Экзоцитоз медиатора и взаимодействие ацетилхолина с никотиновым рецептором (2 молекулы: 1 рецептор), что приводит к открытию ионного канала и деполяризации постсинаптической мембраны вследствие повышения ее проницаемости для натрия и калия
Рецепторы к ацетилхолину делятся на два подтипа в зависимости от их избирательного связывания с никотином (Н-тип) или с мускарином (М-тип).
Никотиновые рецепторы бывают двух типов – мышечного и нейронального, причем существует 7 разновидностей нейрональных холинорецепторов. Связывание ацетилхолина с Н-рецепторами (рис. 20 и табл. 6) приводит к потоку катионов внутрь клетки через ионный канал, ассоциированный с рецептором, и деполяризации постсинаптической мембраны.
Таблица 6
Никотиновые холинорецепторы
Название |
Мышечный тип |
Нейрональный тип |
Селективные агонисты |
Никотин, (+)-анатоксин, цитизин |
|
Селективные антагонисты |
d-тубокурарин, лофотоксин |
|
Блокаторы каналов |
Фенклциклидин Хлорпромазин |
Фенилциклидин Хлорпромазин Гексаметоний |
Механизмы действия медиатора |
К↑, Nа↑ |
К↑, Nа↑, Са↑ |
Ацетилхолиновый никотиновый рецептор относится к рецепторам-каналоформером, так как является одновременно и ионным каналом (рис. 21).
Свое название никотиновый ацетилхолиновый рецептор получил из-за его сродства к никотину. Никотин связывается непосредственно с -субьединицей рецептора и стимулирует открывание неспецифического катионного канала, сформированного различными комбинациями 2, , гамма, дельта и эпсилон субьединиц. В нейромышечной системе ацетилхолин действует через никотиновые холинергические рецепторы и вызывает сокращение скелетной мускулатуры. Он также передает сигнал внутри нервной системы. Эти рецепторы являются неспецифическими ионными каналами, которые проводят Na+ и K+ . Антагонистом для никотиновых рецепторов является тубокурарин.
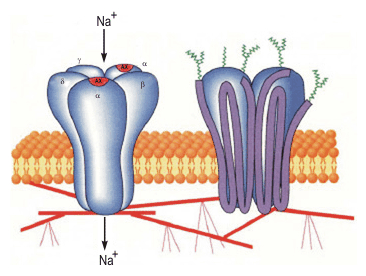
Рис. 21. Никотиновый рецептор, формирующий ионный канал
Субъединицы, полипептидные цепи которых четыре раза пронизывают липидный бислой, с внешней стороны гликозилированы, а внутри взаимодействуют с белками тубулинового и актинового цитоскелета. Связывание ацетилхолина с двумя -субъединицами холинергиеского рецептора вызывает конформационные изменения в олигомерном комплексе, в результате чего Na+ входит внутрь клетки.
Никотиновые рецепторы являются членами суперсемейства мембранных белков, включающих рецепторы серотонина (5-гидрокситриптамин, 5-НТ) , рецепторы для глицина и рецепторы ГАМК (гамма-аминомасляной кислоты).
Ацетилхолиновый рецептор - лиганд-зависимый ионный канал в постсинаптической мембране мышечного волокна. Это молекула массой 250 000 дальтон представляет собой пентамерный гликопротеин, состоящий из трансмембранных полипептидов четырех разных типов, каждый их которых кодируется отдельным геном, хотя они все во многом сходны по последовательности аминокислот, что говорит о происхождении их генов от общего гена-предшественника. Два из пяти полипептидов пентамера идентичны и образуют места связывания ацетилхолина. Две молекулы ацетилхолина присоединяются к пентамерному комплексу и вызывают конформационное изменение, приводящее к открытию канала.
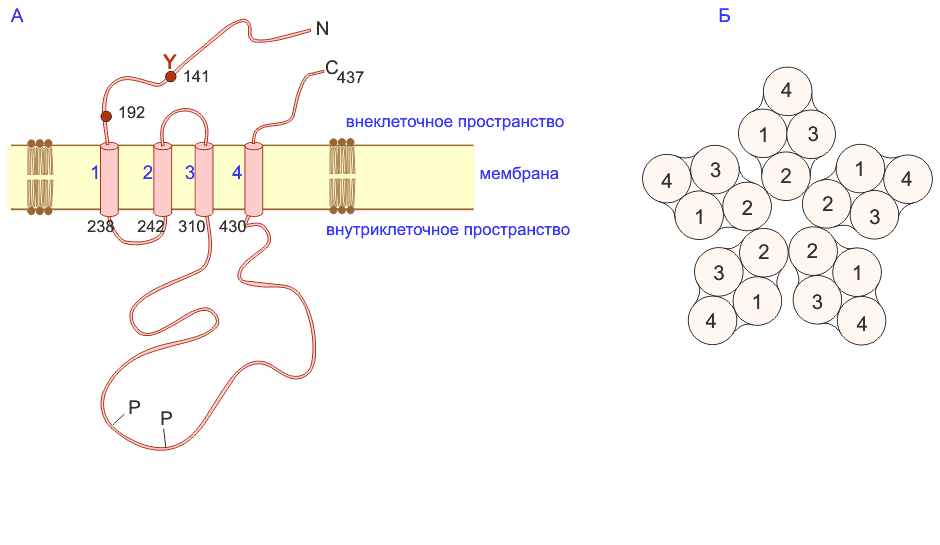
Пентамер объединяет две (по 461 аминокислоте) альфа-субъединицы, одну (493 аминокислоты) бета-субъединицу, одну (506 аминокислот) гамма-субъединицу и одну (522 аминокислоты) дельта-субъединицу. Каждая из субъединиц образует 4 трансмембранных сегмента (рис. 22, а ), а все вместе 5 субъединиц компактно собраны вокруг центральной ионной поры (рис. 22, б ). Когда лиганд, в данном случае ацетилхолин (АХ) , присоединяется к сайтам связывания двух альфа-субъединиц, канал открывается и одновалентные катионы двигаются по электрохимическому градиенту.
Четыре спирали, представленные цилиндрами, пересекают мембрану. И С-, и N-концы локализованы внеклеточно. (б) Сечение рецептора. Пентамерная структура целого рецептора сверху. Предполагается, что вторая спираль каждой субъединицы образует поверхность поры.
|
Рис. 22. Н-ацетилхолиновый рецептор: а) схематическое изображение альфа-субъединицы; б) схема пентамера.
|
Ацетилхолин-зависимый канал, подобно потенциал-зависимому натриевому каналу , имеет несколько дискретных альтернативных конформаций и в присутствии лиганда переходит из одного состояния в другое, внезапно открываясь или закрываясь. Связав ацетилхолин и перейдя в открытое состояние, канал остается некоторое время открытым, это время варьирует случайным образом и составляет в среднем 1 мс. При длительном воздействии ацетилхолина (что в нормальных условиях случается редко) канал переходит в состояние десенсибилизации, аналогичное инактивированоому состоянию натриевых каналов. В открытой конформации канал имеет просвет, сужающийся от наружного конца диаметром 2,5 нм к внутреннему концу диаметром 0,65 нм. Заряды распределены по стенке канала таким образом, что отрицательные ионы не проходят через него, а положительные могут проникать в клетку. Ток создают в основном ионы натрия и калия, а также некоторое количество ионов кальция. Так как в отношении катионов заметной избирательности нет, вклад каждого иона в канальный ток зависит от его концентрации и электрохимической движущей силы. Открытие каналов в ацетилхолиновых рецепторах приводит к значительному притоку катионов в клетку и в результате к деполяризации мембраны.
Никотиновые холинергические рецепторы подразделяют на два типа- мышечный и нейрональный . Оба типа рецептора стимулируют токи Na, K и Ca за счет того, что формируют ионные каналы с электропроводимостью 50 pS (мышечный) и 15-40 pS (нейрональный), однако эти каналы существенно различаются по структуре: мышечный состоит из (альфа1)2, бета1, ипсилон, дельта (мышцы эмбриона или электрический орган ската) нейрональный - из альфа3бета2-субъединиц. Полипептидная цепь каждой из субъединиц 4 раза пронизывает мембрану. Альфа-субъединица, связывающая ацетилхолин, имеет 7, а бета-субъединица - 4 изоформы.
Ацетилхолиновый никотиновый рецептор (Ah-рецептор), существует в неактивном состоянии в цитоплазме в комплексе с рядом белков, в том числе с pp60 src, которые высвобождаются при связывании рецептора с лигандом и фосфорилируют клеточные белки, индуцируя ряд генов. Белковый комплекса лиганд-(Ah-p)-рТБ взаимодействует с участком ДНК, называемым ксенобиотик чувствительный элемент (КЧЭ) (xenobiotic responsible element) и являющимся энхансером.
В результате взаимодействия изменяется структура определенных участков ДНК и транскрипционные факторы получают доступ к началу считывания ряда структурных генов.
Длительность взаимодействия ацетилхолина с рецепторами зависит от степени функциональной активности ацетилхолинэстеразы – фермента, расположенного в синаптической щели и разрушающего ацетилхолин на уксусную кислоту и холин, и обычно очень короткая. Холин захватывается обратно в пресинаптическое окончание для ресинтеза ацетилхолина.
М-холинорецепторы подразделяются на несколько подтипов (табл. 7, рис. 23):
- М1-холинорецепторы располагаются в ЦНС и, возможно, на нейронах парасимпатических ганглиев;
- М2-холинорецепторы - на гладких и сердечной мышцах и клетках железистого эпителия.
- М3-холинорецепторы располагаются на гладких мышцах и железах. Основными являются рецепторы М1 и М2.
Таблица 7
Мускариновые холинорецепторы
Название |
М1 |
М2 |
Селективные агонисты |
Бетанекол, мускарин, пилокарпин, оксотреморин М |
|
Селективные антагонисты |
Скополамин, атропин |
|
Механизмы действия медиатора |
ИФ3/ДАГ↑ |
ц-АМФ↓ К(G)↑ |
Примечание: ц-АМФ – циклический аденозинмонофосфат; ИФ3/ДАГ – инозитол-3-фосфат/диацилглицерол; G – G-белок.
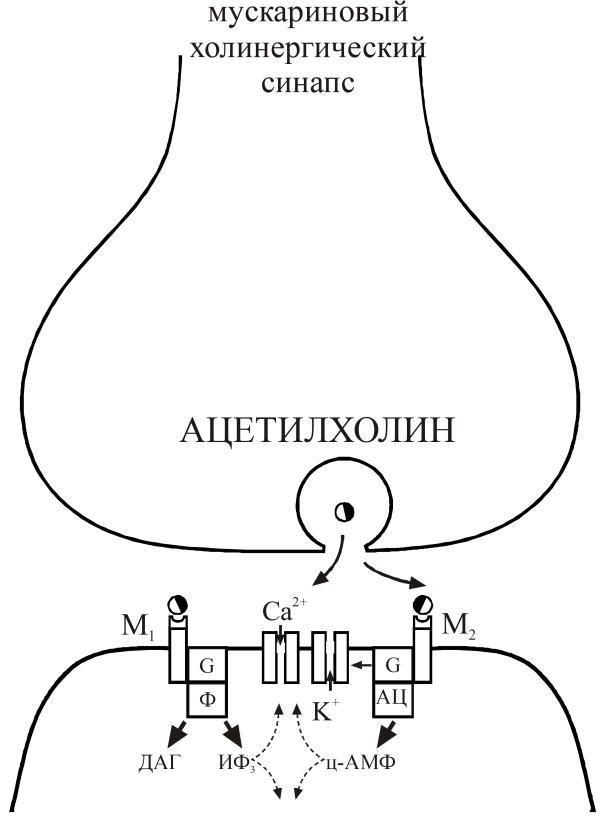
Рис. 23. Молекулярные механизмы в мускариновых холинергических синапсах. Секреция медиатора и взаимодействие с М1 постсинаптическим рецептором, что черезсистему вторичных посредников инозитол-3-фосфат/диацилглицерол модулирует Са-канал. Взаимодействиес М2 рецептором активирует G-белок, который напрямуюмодулирует К-канал и через систему ц-АМФ – Са-канал
Мускариновые рецепторы, в отличие от никотиновых, связаны с ионными каналами (калиевые и кальциевые каналы) не напрямую, а через системы вторичных внутриклеточных посредников. Поэтому, в отличие от никотиновых холинэргических синапсов, эффект взаимодействия ацетилхолина спостсинаптическими мускариновыми рецепторами отставлен по времени и более продолжителен.
Селективным стимулятором М2-холинорецепторов служит бетанехол. Пример селективного блокатора М1-холинорецепторов - пирензепин. Этот препарат резко подавляет выработку HCl в желудке.
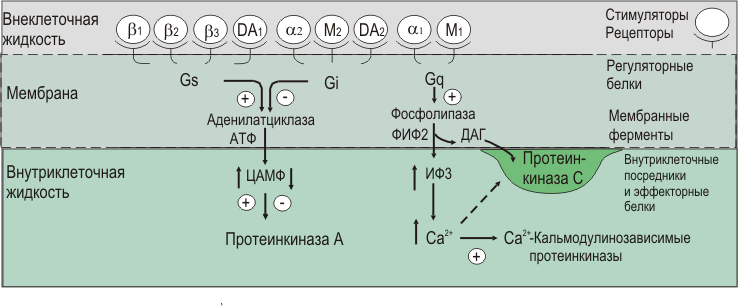
Стимуляция М2-холинорецепторов через Gi-белок приводит к ингибированию аденилатциклазы, а стимуляция М2-холинорецепторов через Gq-бeлок - к активации фосфолипазы С и образованию ИФ3 и ДАГ (рис. 24).
Вегетативные медиаторы, мембранные регуляторные белки и вторые посредники. Буквами и - - и -адренорецепторы, D - дофаминовые рецепторы; М - М-холинорецепторы; G - G-белки; Gs - стимулирование аденилатциклазы; Gi - ингибирование аденилатциклазы; Сq - стимулирование фосфолипазы С; ФИФ2 - фосфатидилинозитол-4,5-дифосфат; (+) - стимуляция; (-) - ингибирование.
Стимуляция М3-холинорецепторов также приводит к активации фосфолипазы С. Блокатором этих рецепторов служит атропин.
Методами молекулярной биологии были выявлены и другие подтипы М-холинорецепторов, однако они пока недостаточно изучены.
|
Рис. 24. Регуляторные белки и вторые посредники
|
«Абсолютный вес» ацетилхолина как центрального медиатора невелик, но холинергические синапсы располагаются на стратегических, ключевых позициях в ЦНС. В частности, холинорецепторы как мускаринового, так и никотинового типа обнаружены на нервных окончаниях нейронов различной природы. Ацетилхолин контролирует секрецию основных медиаторов мозга, как возбуждающих, так и тормозных. Если ацетилхолин будет тормозить секрецию ГАМК, то результатом будет ослабление торможения.
Если же главной мишенью будет нейрон, выделяющий глутамат, то функциональные последствия будут прямо противоположными. Наибольшая концентрация ацетилхолина определяется в гиппокампе и других корковых структурах. Ацетилхолин участвует в формировании памяти и процессах обучения, вовлечен в контроль ноцицептивной системы, так как активация центральных холинорецепторов проявляется мощным обезболивающим эффектом.
Для периферических холинергических синапсов вегетативной нервной системы наиболее, актуальный вопрос заключается в раздельном воздействии на парасимпатические и симпатические ганглии, поскольку медиатором в том и другом случае является ацетилхолин. В хромаффинной ткани надпочечников (объект, родственный симпатическим ганглиям) ацетилхолин отвечает за деполяризацию и последующую секрецию катехоламинов в кровь. В изолированных хромаффинных клетках медиаторная роль ацетилхолина находится под контролем двух нейропептидов, выделяемых как из нервной, так и хромаффинной ткани. Один из пептидов – CGRР (пептид генетически родственный кальцитонину) блокирует нейронные холинорецепторы по конкурентному типу, устраняя их слабую активацию. Другой же пептид – субстанция Р – не влияет на слабые сигналы, но селективно подавляет избыточную активацию надпочечников ацетилхолином на счет возникновения феномена десенситизации – нечувствительности рецепторов к медиатору.
Таким образом, взаимодействие классического медиатора ацетилхолина с двумя нейропептидами обеспечивает оптимальную активацию надпочечников, устраняя, с одной стороны, «шумовые» сигналы, а с другой, предохраняя этот орган от истощения. Знание этих механизмов может послужить основой для воздействия медикаментозными средствами на процесс выброса катехоламинов в кровь при стрессовых реакциях.
Биогенные амины.
Вещества, выполняющие функции медиатора и имеющие в своем составе аминогруппу объединены в группу моноаминов или биогенных аминов. К ним относятся:
1. Катехоламины – адреналин, норадреналин;
2. Дофамин;
3. Серотонин;
4. Гистамин.