
- •Основы наук о жизни
- •Введение
- •Требования к начальным знаниям студентов
- •Требования в области естественнонаучных дисциплин
- •Общие указания к выполнению практическиХ работ
- •Практическая работа № 1 устройство микроскопа и его использование
- •Теоретические положения
- •Практическая работа № 2 строение растительной клетки
- •Теоретические положения
- •Задания
- •1 ‑ Клеточная оболочка; 2 ‑ цитоплазма; 3 ‑ мембрана; 4 ‑ вакуоль;
- •5 ‑ Тонопласт (мембрана вакуоли); 6 ‑ ядро; 7 ‑ ядрышки
- •Задания
- •Результаты наблюдений
- •Классификация ферментов
- •Задания
- •Результаты наблюдений
- •Практическая работа № 5 влияние солей тяжелых металлов на коагуляцию растительных и животных белков
- •Теоретические положения
- •Задания
- •Задания
- •Практическая работа № 7 составление пищевых цепей
- •Теоретические положения
- •Задания
- •Задания
- •Практическая работа № 9 контроль качества питьевой воды
- •Теоретические положения
- •1. Определение запаха воды Задания
- •Характер запаха определите по табл. 12.
- •2. Определение вкуса воды
- •3. Определение цветности воды (интенсивности окрашивания)
- •Задания
- •4. Определение мутности и прозрачности воды
- •Задания
- •Определение прозрачности
- •Задания
- •5. Определение жесткости воды
- •Способы умягчения воды
- •Определение карбонатной жесткости воды
- •Определение общей жесткости воды
- •Определение кальциевой и магниевой жесткости воды
- •Заключение
- •Библиографический список
- •Строение растительной клетки
- •Основные различия животной и растительной клеток
- •Наблюдение плазмолиза и деплазмолиза в живых растительных клетках
- •Основные различия клеток прокариот и эукариот
- •1 ‑ Сужающая пирамида; 2 ‑ перевернутая пирамида
- •Принцип действия фотоэлектроколориметра кфк-2
- •Оглавление
- •Хорохордина Елена Алексеевна, Рудаков Олег Борисович Основы наук о жизни
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Наблюдение плазмолиза и деплазмолиза в живых растительных клетках
Таблица П.2
Основные различия клеток прокариот и эукариот
Составные части клетки |
Прокариоты |
Эукариоты |
Клеточная стенка |
Есть. Прочность придает муреин |
Есть у растений (прочность придает целлюлоза) и грибов (уплотняющее вещество – хитин) |
Капсула или слизистый слой |
Есть у некоторых бактерий |
Нет |
Ядро |
Нет. Имеется нуклеотид – часть цитоплазмы, где содержится ДНК, не окруженный мембраной |
Имеет оболочку из двух мембран, содержит одно или несколько ядрышек |
Генетический материал |
Кольцевая молекула ДНК, не связанная с белками |
Линейные молекулы ДНК, связанные с белками, организованы в хромосомы |
Эндоплазматический ретикулум, аппарат Гольджи, лизосомы, митохондрии |
Нет |
Есть |
Мезосомы |
Есть |
Нет |
Рибосомы |
Есть. Более мелкие, чем у эукариот |
Есть |
Жгутики |
Если есть, то не имеют микротрубочек и не окружены плазматической мембраной. d 20 нм |
Если есть, то имеют микротрубочки, окружены плазматической мембраной. d 200 нм |
Размеры |
Диаметр в среднем 0,5-5 мкм |
Диаметр обычно до 40 мкм |
Приложение 3
ВЛИЯНИЕ СОЛЕЙ ТЯЖЕЛЫХ МЕТАЛЛОВ НА КОАГУЛЯЦИЮ
РАСТИТЕЛЬНЫХ И ЖИВОТНЫХ БЕЛКОВ

Рис. П.3. Уровни структуры белков:
1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
Приложение 4
СОСТАВЛЕНИЕ ПИЩЕВЫХ ЦЕПЕЙ
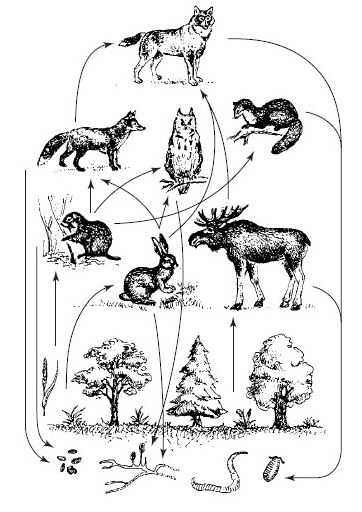
Рис. П.4.1. Пастбищная сеть питания в наземном биоценозе

Рис. П.4.2. Детритная пищевая цепь

Рис. П.4.3. Общая схема пищевой цепи

Рис. П.4.4. Экологические пирамиды:
1 ‑ Сужающая пирамида; 2 ‑ перевернутая пирамида
Приложение 5
КОНТРОЛЬ КАЧЕСТВА ПИТЬЕВОЙ ВОДЫ
Принцип действия фотоэлектроколориметра кфк-2
Колориметр фотоэлектрический концентрационный КФК-2 предназначен для измерения в отдельных участках диапазона длин волн 315-980 нм, выделенных светофильтрами, коэффициентов пропускания и оптической плотности жидкостных растворов, а также определения концентрации веществ в растворах методом построения градуировочных графиков.
Принцип измерения коэффициента пропускания состоит в том, что на фотоприемник направляются поочередно световые потоки, полный - F0 и прошедший через исследуемую среду Fα, и определяется Т исследуемого раствора.
Т =
![]() ·100 %.
·100 %.
На колориметре это отношение определяется следующим образом:
колориметр включить в сеть за 15 минут до начала измерений. Во время прогрева прибора кюветное отделение должно быть открыто.
ввести необходимый по роду измерений цветной светофильтр.
установить минимальную чувствительность колориметра ручкой «чувствительность» в положение 1, а ручкой «установка 100 грубо» в крайнее левое положение.
в световой пучок поместить кювету с растворителем, закрыть крышку кюветного отделения и ручками «чувствительность» «установка 100» сначала грубо, а потом точно установить отсчет 100 по шкале колориметра «Т» или 0 по шкале колориметра «Д».
затем поворотом ручки кювету с растворителем заменить на кювету с исследуемым раствором и снять отсчет по шкале колориметра, соответствующий оптической плотности Д.
