
- •Лекция 33 фенолы План
- •Классификация и номенклатура
- •Методы получения
- •Физические свойства и строение
- •Химические свойства
- •Получение простых и сложных эфиров фенолов
- •Перегруппировка Кляйзена аллилариловых эфиров
- •Галогенирование
- •Нитрование
- •Нитрозирование
- •Алкилирование и ацилирование по Фриделю-Крафтсу
- •Реакция Вильсмейера-Хаака
- •Реакция Реймера-Тимана
Получение простых и сложных эфиров фенолов
Нуклеофильные свойства атома кислорода фенолов понижены по сравнению со спиртами в результате сопряжения. Как следствие этого ариловые эфиры карбоновых кислот нельзя получать прямой этерификацией фенолов карбоновыми кислотами. Сложные эфиры получают ацилированием фенолов или их Na-и K-солей галогенангидридами или ангидридами кислот.
ArOH + RCOX RCOOAr + HX
ArO-Na+ + RCOX RCOOAr + NaX
(X=Cl, OCOR)
Феноляты легко алкилируются , алкилгалогенидами и диалкилсульфатами с образованием простых эфиров.
ArO-Na+ + RX ArOR + NaX
(X=Hal, ROSO3)
Метиловые эфиры фенолов получают также действием диазометана в эфирном растворе.
ArOH + CH2N2 AROCH3 + N2
В отличие от спиртов фенолы как более сильные кислоты метилируются диазометаном в отсутствие катализатора.
Перегруппировка Кляйзена аллилариловых эфиров
Аллиловый эфир фенола при нагревании до 200-220оС превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца.
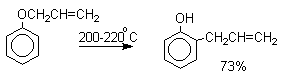
Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение:

У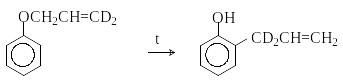 становлено,
что и орто-
и пара-перегруппировки
являются внутримолекулярными реакциями
первого порядка. Миграция в орто-положение
сопровождается инверсией аллильной
группы, т.е. она присоединяется к
бензольному кольцу -углеродным
атомом.
становлено,
что и орто-
и пара-перегруппировки
являются внутримолекулярными реакциями
первого порядка. Миграция в орто-положение
сопровождается инверсией аллильной
группы, т.е. она присоединяется к
бензольному кольцу -углеродным
атомом.
Из этого следует, что переходное состояние перегруппировки Кляйзена должно быть циклическим шестизвенным. Такое переходное состояние включает шесть -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия аналогична изомеризации кетона в енольную форму.
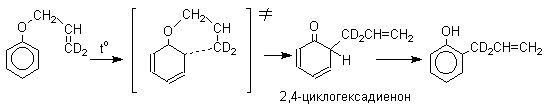
2,4-Циклогексадиенон является интермедиатом перегруппировки аллилариловых эфиров. Такой интермедиат может быть выделен при перегруппировке аллилового эфира 2,6-диметилфенола, когда аллильная группа мигрирует в пара-положение, поскольку енолизация кетона в фенол в этом случае не может происходить из орто-положения. Конечным результатом двух последовательных миграций аллильной группы является сохранение структуры мигрирующей группы.


Кроме того, при проведении перегруппировки в присутствии малеинового ангидрида 2,4-циклогексадиенон улавливается в виде аддукта диенового синтеза.
Реакции электрофильного замещения в ароматическом кольце
Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара-положения. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами.
Галогенирование
Галогенирование фенолов не требует катализа кислотами Льюиса и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион, который содержит очень сильную активирующую группу –O-. Скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем сам фенол, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.

Бромирование фенола в воде приводит к образованию нерастворимого 2,4,6-трибромфенола. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации 10-5М в водном растворе. 2,4,6-Трибромфенол взаимодействует еще с одним молем брома с образованием 2,4,4,6-тетрабромциклогекса-2,5-диенона, окрашенного в желтый цвет.

При обработке продукта этой реакции раствором гидросульфита натрия или другого слабого восстановителя он легко превращается в исходный 2,4,6-трибромфенол.
При бромировании фенола в растворе бромистоводородной кислоты диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол.


Аналогичным образом протекает хлорирование фенола хлором в соляной кислоте, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов.

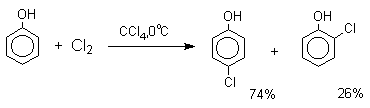
В качестве галогенирующего агента кроме самих галогенов можно использовать комплексы галогенов с диоксаном, ДМФА.

Во всех случаях соотношение пара/орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании.
